白藜芦醇对胰岛素抵抗3T3-L1脂肪细胞葡萄糖代谢的影响
陈思凡,柯梁汝,郑 琳,单智铭,周妮曼,冯 翔,*
(1.中山大学公共卫生学院,广东省营养膳食与健康重点实验室,广东 广州 510089;2.中山大学中山医学院,广东 广州 510089)
白藜芦醇对胰岛素抵抗3T3-L1脂肪细胞葡萄糖代谢的影响
陈思凡1,柯梁汝2,郑 琳1,单智铭2,周妮曼2,冯 翔1,*
(1.中山大学公共卫生学院,广东省营养膳食与健康重点实验室,广东 广州 510089;2.中山大学中山医学院,广东 广州 510089)
目的:研究白藜芦醇(resveratrol,Res)对胰岛素抵抗状态下3T3-L1脂肪细胞葡萄糖代谢的影响,并探讨其分子机制。方法:用地塞米松诱导3T3-L1细胞建立胰岛素抵抗模型,用不同剂量Res进行干预,添加或不添加胰岛素刺激,测定各组细胞的葡萄糖消耗量,实时荧光定量PCR检测各组细胞的脂联素(adiponectin)、瘦素(leptin)和抵抗素(resistin)mRNA表达,Western blotting检测腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)的蛋白质表达及磷酸化水平。结果:各组细胞经胰岛素刺激,0.01、0.1、1μmol/L的Res组的葡萄糖消耗量分别是对照组的1.3、1.5、1.4倍(P<0.05),添加Res可促进脂联素、瘦素mRNA的表达,降低抵抗素mRNA表达,增加AMPKα的磷酸化水平。结论:Res可以明显改善胰岛素抵抗状态下3T3-L1细胞葡萄糖代谢。其机制可能是通过增加脂联素、瘦素表达,降低抵抗素表达从而介导AMPKα磷酸化实现的。
白藜芦醇;胰岛素抵抗;脂联素;瘦素;抵抗素;脂肪细胞;糖代谢
白藜芦醇(resveratrol,Res)是一种多酚类化合物,具有抗癌、抗氧化、抗菌、抗炎等作用,可广泛地应用于医药、保健品、食品和化妆品等领域。研究表明,Res对于组织和细胞能量代谢有广泛的影响,可通过增加葡萄糖转运子(glucose transporter,Glut)的表达来增加骨骼肌细胞的葡萄糖摄取[1],还可以减少脂肪细胞的脂质形成,抑制前脂肪细胞向脂肪细胞分化[2]。然而,有关Res对于胰岛素抵抗状态下脂肪细胞的葡萄糖代谢的作用及机制研究相对较少。本实验选取3T3-L1脂肪细胞作为研究对象,旨在探讨Res对胰岛素抵抗状态下3T3-L1细胞葡萄糖代谢的作用及其机制。
1 材料与方法
1.1 材料与试剂
3T3-L1细胞株,购自中国科学院上海细胞库。
白藜芦醇、1-甲基-3-异丁基-黄嘌呤(IBMX)、地塞米松、合成人胰岛素 美国Sigma公司;高糖DMEM培养基、新生牛血清 美国Gibco公司;葡萄糖诊断试剂盒 瑞士Roche公司;Trizol 美国Invitrogen公司;Real time PCR试剂盒 日本TaKaRa公司;兔抗AMPKα、AMPKα Thr172单克隆抗体 美国CST公司;兔抗GAPDH单克隆抗体 Boster公司;BCA试剂盒、HRP标记的抗兔二抗 Beyotime公司。
1.2 方法
1.2.1 3T3-L1脂肪细胞的诱导分化
3T3-L1前脂肪细胞接种于6孔培养板,待细胞汇合后接触抑制48h,换用含0.5mmol/L IBMX、1μmol/L地塞米松、10mg/L胰岛素的培养基培养48h,然后换用含10mg/L胰岛素的培养基培养48h,随后再换用DMEM培养基继续培养,每2d换液1次,培养4d,90%以上细胞分化为成熟脂肪细胞。
1.2.2 胰岛素抵抗模型的建立
对3T3-L1脂肪细胞进行分组,添加1μmol/L的地塞米松作为胰岛素抵抗模型组,培养24h后给予100nmol/L的胰岛素,刺激15min后取培养基,计算培养基中葡萄糖消耗量,与非胰岛素抵抗组(100nmol/L胰岛素刺激15min)对比,评价胰岛素抵抗的程度。
1.2.3 葡萄糖消耗量的测定
建立胰岛素抵抗模型后,分别添加0、0.01、0.1、1μmol/L的Res,作用24h,每个剂量组平行分为两组,给予或不给予100nmol/L的胰岛素刺激15min,收集各组的培养基,按照葡萄糖诊断试剂盒说明书,在全自动生化分析仪上测定各实验组和原DMEM培养基的葡萄糖含量,葡萄糖消耗量为DMEM培养基葡萄糖量与实验组培养基葡萄糖量之差。以不加任何药物的组别为对照组,此组的葡萄糖消耗量设为100,其他组与之相比。
1.2.4 实时荧光定量PCR检测脂联素、瘦素和抵抗素mRNA表达
细胞经实验干预后用Trizol抽提细胞总RNA,逆转录合成cDNA。RT步骤:取1g/L的RNA 1μL,分别加入4μL的5×PrimeScriptTMBuffer、1μL的RT Enzyme Mix Ⅰ、1μL的Oligo dT Primer、1μL的Random 6 mers,补充13μL的DEPC水,RT反应液总体积为20 μL,37℃ RT 15min,85℃ 5s灭活反转录酶。RT后以cDNA为模板进行扩增。PCR步骤:取2μL的cDNA溶液,分别加入10 μL的2×SYBR Premix Ex TaqTM、0.4μL的Forward Primer、0.4μL的Reverse Primer、0.4μL的50×ROX Reference DyeⅡ,补充6.8μL的dH2O,PCR反应液总体积为20μL。扩增条件:95℃预变性30s,95℃ 5s变性、55℃ 30s退火、72℃ 30s延伸,扩增40个循环。引物为:脂联素正义链5'-GTC AGT GGA TCT GAC GAC ACC AA-3'、反义链5'-ATG CCT GCC ATC CAA CCT G-3',PCR产物171bp;瘦素正义链5'-CCA GGA TCA ATG ACA TTT CAC ACA C-3'、反义链5'-AGG TCA TTG GCT ATC TGC AGC AC-3',PCR产物184bp;抵抗素正义链5'-TTG GCT TAA ATT GCT GGA CAG TCT C-3'、反义链5'-GGA AGC GAC CTG CAG CTT ACA-3',PCR产物191bp;β-actin正义链5'-CAT CCG TAA AGA CCT CTA TGC CAA C-3'、反义链5'-ATG GAG CCA CCG ATC CAC A-3',PCR产物171bp。Real time PCR反应引物由TaKaRa公司设计并合成。用Sequence Detection System软件分析各组的循环阀值(Ct),通过计算2-△△Ct得出各组基因的相对表达水平。
1.2.5 Western blotting检测AMPKα蛋白表达及磷酸化水平
用NP-40裂解细胞,提取细胞总蛋白,采用BCA法进行蛋白定量。灌制10%的分离胶和5%的浓缩胶,恒压120V、80mA预电泳10min,上样,进行SDS-PAGE电泳,半干式转移,5%脱脂奶粉室温封闭1h,一抗按照1:1000的稀释度于4℃孵育过夜,二抗(1:5000)室温孵育1h,暗房中滴加发光底物混合物2mL于膜上,用X光片曝光、显影、定影。
1.3 统计学处理
采用SPSS 11.0统计软件,各组比较采用单因素方差分析,组间比较用Bonferroni法,检验水准α=0.05,P<0.05代表差异具有统计学意义。
2 结果与分析
2.1 Res对胰岛素抵抗状态下脂肪细胞葡萄糖消耗量的影响
正常状态下3T3-L1脂肪细胞经胰岛素刺激后,葡萄糖的消耗量极显著增加(P<0.01)。添加地塞米松后,加胰岛素刺激,与对照组相比,葡萄糖消耗量无明显变化,说明细胞出现胰岛素抵抗(图1A)。用0、0.01、0.1、1μmol/L的Res处理胰岛素抵抗状态下的细胞,经胰岛素刺激后,各处理组与对照组比较,葡萄糖消耗量均显著增加(P<0.05),而未经胰岛素刺激,与对照组比较,0.1μmol/L处理组葡萄糖消耗量增加(P<0.05,图1B)。
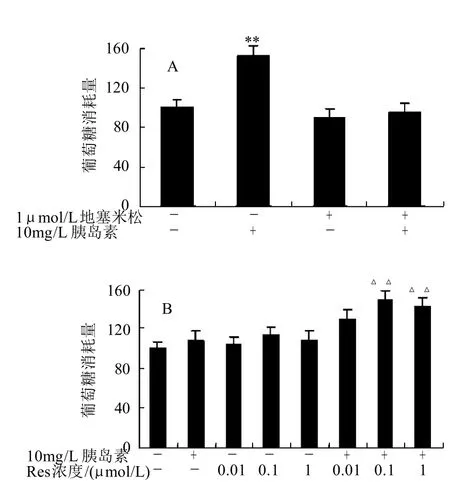
图1 Res对胰岛素抵抗状态下3T3-L1脂肪细胞葡萄糖消耗量的影响Fig.1 Effect of resveratrol on glucose consumption of insulin-resistant 3T3-L1 adipocytes
2.2 Res对胰岛素抵抗状态下脂肪细胞脂联素、瘦素和抵抗素mRNA表达的影响
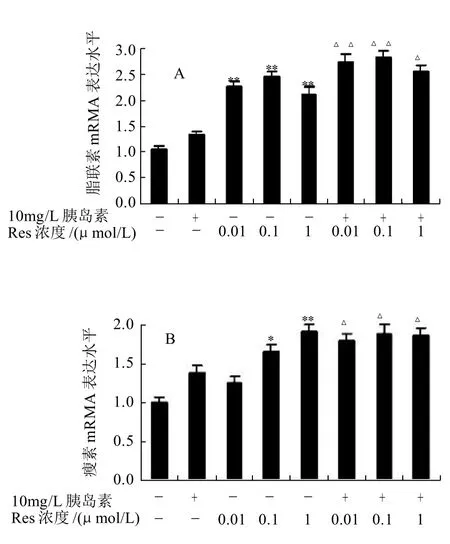

图2 Res对胰岛素抵抗状态下3T3-L1脂肪细胞脂联素、瘦素和抵抗素mRNA表达的影响Fig.2 Effect of resveratrol on mRNA expression of adiponectin, leptin and resistin of insulin-resistant 3T3-L1 adipocytes
由图2可知,给予或不给予胰岛素刺激,与相应的对照组比较,Res组脂联素的mRNA表达均显著增加(P<0.05,图2A);不给予胰岛素刺激,与对照组比较,0.1、1μmol/L的Res组瘦素的mRNA表达显著增加(P<0.05),而给予胰岛素刺激,3个剂量组瘦素的mRNA表达均显著增加(P<0.05,图2B);给予或不给予胰岛素刺激,与对照组比较,0.1、1μmol/L的Res组抵抗素的mRNA表达显著下降(P<0.05,图2C)。
2.3 Res对胰岛素抵抗状态下脂肪细胞AMPKα蛋白表达及磷酸化水平的影响
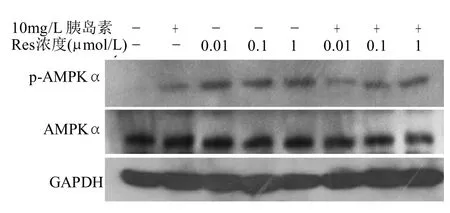
图3 Res对胰岛素抵抗状态下脂肪细胞AMPKα的蛋白表达及磷酸化水平的影响Fig.3 Effect of resveratrol on the phosphorylation of AMPK¦Á in insulin-resistant 3T3-L1 adipocytes
由图3可知,给予或不给予胰岛素刺激,与相应的对照组比较,R es组的p-A MPKα表达升高,即AMPKα Thr172的磷酸化水平增加,而AMPKα的总蛋白表达无明显变化。
3 讨 论
胰岛素与细胞膜上的胰岛素受体结合后,激活受体的内源性酪氨酸激酶活性,导致自身磷酸化和胰岛素受体底物(IRS)的酪氨酸磷酸化。活化的IRS可磷酸化下游的PI3K和akt,从而促进Glut4迁移到胞膜上介导组织细胞利用葡萄糖[3]。体内和体外研究证明,Res可以增加依赖或非依赖胰岛素的葡萄糖转运[4],其机制尚不完全清楚。本实验结果显示,无论胰岛素存在与否,Res均能增加胰岛素抵抗状态下3T3-L1脂肪细胞葡萄糖的摄取,但在有胰岛素刺激时,3种浓度的Res组均正向促进葡萄糖转运,而在缺乏胰岛素刺激的条件下,只有0.1μmol/L的Res组增加胰岛素抵抗状态下细胞葡萄糖的摄取,提示Res改善胰岛素抵抗状态下细胞的葡萄糖代谢可能通过IRS-PI3K-akt- Glut4通路,而且可能还存在其他不依赖胰岛素的通路,有待进一步的探讨。
脂联素、瘦素和抵抗素都是脂肪细胞分泌的因子。研究显示,脂联素可增加胰岛素的敏感性和脂肪组织的氧化,最终减少循环中脂肪酸水平和减少肝脏和脂肪细胞的TG水平[5],从而改善胰岛素抵抗。有研究证明,恒河猴自发展为2型糖尿病的过程中,脂联素含量下降,高胰岛素钳夹实验显示,随着胰岛素抵抗的加重,血中脂联素水平逐渐降低[6]。本实验结果显示,无论胰岛素存在与否,Res都可使胰岛素抵抗状态下的3T3-L1脂肪细胞脂联素的mRNA表达增加,提示Res可能通过增加脂联素的表达水平来改善胰岛素抵抗。
瘦素主要是由白色脂肪组织分泌的,且只有在成熟的脂肪细胞中才表达[7]。瘦素通过中枢神经递质抑制食欲,促进糖脂代谢,参与多种内分泌激素的相互协调,以控制肥胖的发生发展[8]。在对3T3-L1细胞的研究中发现,瘦素不能直接诱导脂肪细胞凋亡,但能直接抑制前脂肪细胞的成熟分化,减少细胞中的脂质堆积[9]。本实验结果显示,Res组瘦素mRNA表达增加,提示Res改善胰岛素抵抗可能与增加瘦素的表达有关。
抵抗素是由脂肪细胞分泌的多肽类激素。研究表明,在胰岛素抵抗的动物体内抵抗素水平明显高于正常个体,降低血清抵抗素水平能减少脂肪沉积,提高胰岛素的敏感性[10]。抵抗素通过降低胰岛素刺激的葡萄糖摄取来降低脂肪细胞、骨骼肌细胞和肝细胞以及胰腺β细胞的胰岛素敏感性,诱导产生胰岛素抵抗。本实验结果显示,经过或不经过胰岛素刺激,0.1、1μmol/L的Res组抵抗素的mRNA表达都下降,因此推测Res改善胰岛素抵抗可能与下调抵抗素的表达有关。
AMPK广泛存在于真核细胞中,属于丝/苏氨酸蛋白激酶家族成员,是一个异源三聚体,由具有催化作用的α亚基和具有调节作用的β和γ亚基构成,α亚基对整个激酶的活性是必需的。当代谢性应激引起细胞内AMP/ATP比值升高时,AMPK发生磷酸化并激活其下游靶分子,减少ATP的消耗和增加ATP的生成,即促进分解代谢;当AMP/ATP比值降低时,AMPK则促进合成代谢。对2型糖尿病患者和正常对照组进行的体外实验显示,5-氨基-4-咪唑甲酰胺核苷酸(AICAR,AMPK的激活剂)通过增加细胞表面Glut4含量,增加葡萄糖转运,这一过程依赖AMPK途径[11]。在大鼠原代脂肪细胞中,脂联素可通过磷酸化AMPK和ACC,促进细胞摄取葡萄糖[12]。在骨骼肌细胞中,瘦素可激活AMPKα2 亚单位的活性,加速脂肪酸氧化作用[13]。抵抗素可通过抑制AMPK活性而作用于脂肪、肝脏及骨骼肌等胰岛素靶器官,促进肝糖输出,导致产生胰岛素抵抗[14-15]。本实验结果显示,无论胰岛素存在与否,Res都增加胰岛素抵抗状态下3T3-L1脂肪细胞AMPKα的磷酸化水平。提示Res可能通过增加细胞脂联素与瘦素的表达,减少抵抗素的表达,从而增加AMPKα磷酸化,活化AMPKα经或不经胰岛素信号转导通路(IRSPI3K-akt),促进Glut4的转位,增加葡萄糖转运,改善胰岛素抵抗。
综上所述,Res增加胰岛素抵抗状态下3T3-L1脂肪细胞的葡萄糖代谢,改善其胰岛素抵抗。Res可能通过增加脂联素和瘦素的表达并下调抵抗素的表达,进而增加AMPK的磷酸化水平,经过或不经过胰岛素信号转导通路,增加葡萄糖摄取。本研究结果可为Res防治2型糖尿病及其他代谢综合征提供理论依据。
[1] CUCCIOLLA V, BORRIELLO A, OLIVA A, et al. Resveratrol: from basic science to the clinic[J]. Cell Cycle, 2007, 6(20): 2495-2510.
[2] PANG Weijun, SUN Shiduo, BAI Liang, et al. Effects of resveratrol on pig primary preadipocytes proliferation, differentiation and transcription expression of Sirt1 gene[J]. Chin J Biotechnol, 2006, 22(5): 850-855.
[3] PENDE M, KOZMA S C, JAQUET M, et al. Hypoinsulinaemia, glucose intolerance and diminished beta-cell size in S6K1-deficient mice[J].Nature, 2000, 408(6815): 994-997.
[4] DENG Jenying, HSIEH P S, HUANG Jiungpang, et al. Activation of estrogen receptor is crucial for resveratrol stimulating muscular glucose uptake via both insulin-dependent and independent pathways[J]. Diabetes,2008, 57(7): 1814-1823.
[5] BERG A H, COMBS T S, SCHERER P E. ACRP30/adiponectin: an adipokine regulating glucose and lipid metabolism[J]. Trends Endocrinol Metab, 2002, 13(2): 84-89.
[6] HOTTA K, FUNAHASHI T, BODKIN N L, et al. Circulating concentrations of the adipocyte protein adiponectin are decreased in parallel with reduced insulin sensitivity during the progression to type 2 diabetes in rhesusmon-keys[J]. Diabetes, 2001, 50(5): 1126-1133.
[7] 段刚, 许慕强, 张福平, 等. 糖尿病及肥胖患者血浆瘦素水平的检测[J]. 中国病理生理杂志, 2003, 19(6): 831-855.
[8] 宁鸿珍, 李清钊, 刘英莉, 等. 茶多酚对肥胖大鼠体重的影响及其与瘦素、血脂水平的关系[J]. 食品科学, 2008, 29(4): 358-360.
[9] AMBATI S, KIM H K, YANG J Y, et al. Effects of leptin on apoptosis and adipogenesis in 3T3-L1 adipocytes[J]. Biochem Pharmacol, 2007,73(3): 378-384.
[10] STEPPAN C M, BAILEY S T, BHAT S T, et al. The hormoneresistin links obesity to diabetes[J]. Nature, 2001, 409(3): 307-312.
[11] KOISTINEN H A, GALUSKA D, CHIBALIN A V, et al. 5-aminoimidazole carboxamide riboside increases glucose transportand cell surface GLUT4 content in skeletal muscle from subjects with type 2 diabetes[J]. Diabetes, 2003, 52(5): 1066-1072.
[12] WU Xiangdong, MOTOSHIMA H , MAHADEV K, et al. Involvement of AMP-activated protein kinase in glucose uptake stimulated by the globular domain of adiponectin in primary rat adipocytes[J]. Diabetes,2003, 52(6): 1355-1363.
[13] MINOKOSHI Y, ALQUIER T, FURUKAWA N, et al. AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus[J]. Nature, 2004, 428(6982): 569-574.
[14] PALANIVEL R, SWEENEY G. Regulation of fatty acid uptake and metabolism in L6 skeletal muscle cells by resistin[J]. FEBS Lett, 2005,579(22): 5049-5054.
[15] FILKOVA M, HALUZIK M, GAY S, et al. The role of resistin as a regulator of inflammation: Implications for various human pathologies[J]. Clin Immunol, 2009, 133(2): 157-170.
Effect of Resveratrol on Glucose Metabolism in Insulin-resistant 3T3-L1 Adipocytes
CHEN Si-fan1,KE Liang-ru2,ZHENG Lin1,SHAN Zhi-ming2,ZHOU Ni-man2,FENG Xiang1,*
(1. Guangdong Provincial Key Laboratory of Food, Nutrition and Health, School of Public Health, Sun Yat-sen University,Guangzhou 510089, China;2. Zhongshan School of Medicine, Sun Yat-sen University, Guangzhou 510089, China)
Objective: To explore the effect and mechanism of resveratrol on glucose metabolism in insulin-resistant 3T3-L1 adipocytes. Methods: Insulin-resistant model was established by the induction of dexamethasone in 3T3-L1 adipocytes. The glucose consumption of insulin-resistant 3T3-L1 adipocytes with and without resveratrol stimulation was determined. The mRNA expression of leptin, adiponectin and resistin was determined by real time PCR, and the expression and phosphorylation of AMPK α were determined by Western blotting. Results: After insulin stimulation with the concentration of 0.01, 0.1μmol/L and 1μmol/L, resveratrol could increase the glucose consumption by 1.3, 1.5 folds and 1.4 folds compared with the control (P < 0.05).Meanwhile, resveratrol could increase mRNA expression of adiponectin and leptin and decrease mRNA expression of resistin.Moreover, resveratrol increased the phosphorylation of AMPKα. Conclusion: Resveratrol can improve glucose metabolism in insulin-resistant 3T3-L1 adipocytes. The molecular mechanism may be the phosphorylation of AMPK α by increasing the expression of adiponectin and leptin and inhibiting the expression of resistin.
resveratrol;insulin resistance;adiponectin;leptin;resistin;fat cells;AMPK
Q946.8
A
1002-6630(2010)23-0285-04
2010-03-22
广东省医学科研基金资助项目(A2010143)
陈思凡(1984—),男,硕士,研究方向为营养与健康。E-mail:dishi1984@126.com
冯翔(1969—),男,副教授,博士,研究方向为营养与健康。E-mail:fengx@mail.sysu.edu.cn

