APC与肿瘤侵袭转移的关系
韩冲 王在军 王利东 中国医科大学
APC与肿瘤侵袭转移的关系
韩冲 王在军 王利东 中国医科大学
APC蛋白(adenomatous polyposiscoli,APC)具有多种功能:参与Wnt信号转导,抑制细胞生长和促进细胞调亡,影响细胞分化,调节细胞骨架运动,影响细胞迁移、黏合和分裂等。本文着重介绍APC蛋白的结构及与肿瘤的发生发展、侵袭转移的关系。
APC;肿瘤;Wnt;β-catenin;微管;细胞骨架
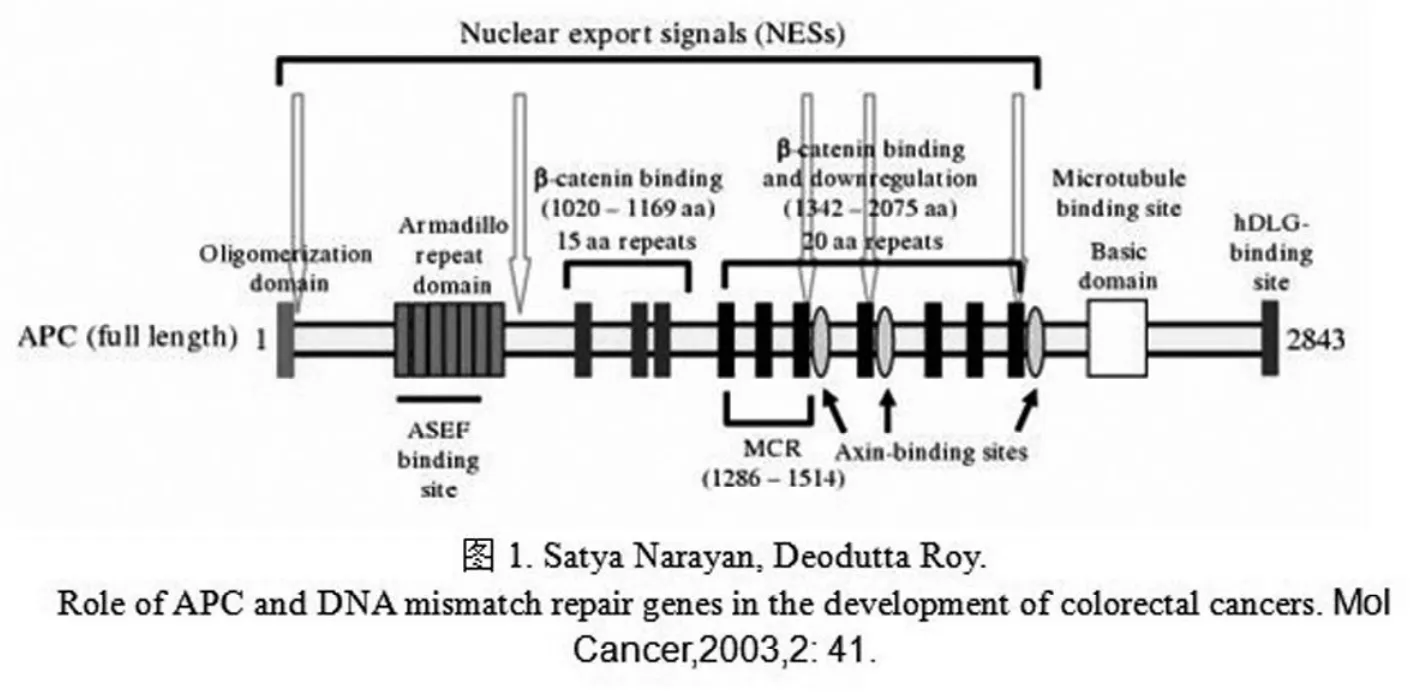
一、APC蛋白的结构
APC基因定位于染色体的5q21-q22,编码胞质蛋白[1],其中密码子第1286-1513之间的10%左右的编码区集中了约65%体细胞的突变,被称为“突变密集区”(MSR),MSR位于第15外显子内[2]。
APC蛋白由2843个氨基酸组成[8]。野生型APC 的N端的前十七个氨基酸通过形成α-螺旋介导APC同源二聚体的形成。紧接着是一个系列的七个保守的Armadillo重复区,它对于蛋白质之间的相互作用和细胞黏合是非常重要的,与该区域结合的蛋白质主要有P P2 A (phosphatase2a),Asef(APC-stimulated guanine nucleotide exchange factor for Rhofamily protein)和Kap3(kinesin superfamily-associated protein)以及轴蛋白[3]。在APC分子的中间区域包含了一个重要的结构域与β-catenin相连。与20个氨基酸重复区域相接的是三个称为“SAMP”的氨基酸序列,该序列涉及轴蛋白与APC的结合部位。APC的C端含有数个富含碱性氨基酸的结构域,是微管蛋白的结合位点。在此区域之后是与EB1(an ending binding protein)的结合位点[4]。
二、APC在Wn t信号通路中的作用
Wnt信号传递途径的异常调节可引起肿瘤发生[5]。APC在W nt途径中的主要功能是作为一个多种蛋白质复合物相互连接的骨架。该复合物中含有APC、糖原合成酶激酶3β(serine/theronine glycogen synthase kinase3β,GSK-3β)和轴蛋白(axin)[4],其中Axin的RGS功能域(regulators of G protein signaling domain)能与全长的APC蛋白结合[5]。β-
三、APC与细胞骨架
catenin将肌动蛋白action骨架与细胞间跨膜粘附受体钙粘素(cadherin)家族成员相连接[5],同时还是发育系统的一个信号传递分子[6]。Wnt/β-catenin通路能调节30多种基因的转录活性,当没有Wnt信号传入时,GSK-3β是活化的,它可以磷酸化APC/β-catenin/Axin,增加它们之间的相互作用。
多种机制可导致APC基因失活,包括等位基因丢失、基因突变、启动子CpG岛甲基化等。APC的致癌截短突变几乎总是使蛋白中心区能与β-catenin相互作用的串联重复序列的20个氨基酸至少丢失4个(通常为5个),从而产生截短的APC蛋白,丢失与轴蛋白结合的区域,不能形成APC—axin—GSK-3β多蛋白复合物,引起游离的β-catenin在细胞浆内集聚,并以一种与Imoporin beta类似的方式通过核孔被转运入核内[5],导致Wnt信号转导异常。Cyclin D1也是β-catenin/Lef-1途径激活的直接靶基因,它是细胞周期调节的正性调控因子,其含量及活化程度在细胞增殖周期卡点G1/S转换过程中起限速作用,过度表达可导致细胞周期调控异常,从而发生肿瘤[9]。
APC的功能不仅体现在W nt信号通路中,还参与细胞骨架两种主要成分微丝和微管的调节[10,11]。近来发现APC的突变可以导致染色体不稳定(chromosomal instability,CIN)[12,13],研究显示,APC蛋白可以通过其分子羧基末端的微管结合区域与微管正极直接结合,调节微管组装及增加微管稳定性,因此被称为微管正极示踪蛋白(plus-end tracking protein)。目前发现APC至少可以以三种方式与微管结合。APC的基本结构域可与微管直接结合[14];还可通过EB1间接与微管相互作用[15];当缺乏以上两个微管结合区域时,仍可以依赖ATP提供能量的方式向微管的远中心体端运动,成簇地聚集在细胞的突起部位[16],有研究表明,APC中段(1500bp-4800bp)可能通过SM AP/KAP3参与沿微管的运动[17]。APC通过与微管结合引发微管成束,使微管平行排列于高度极性上皮细胞基质膜区域[18],APC蛋白也能在体外促进微管聚合,这和其他微管结合蛋白(如:CLIP-170,dynactin,EB1以及CLASPs、L IS-1)的作用相类似。因此,APC与细胞骨架的相互作用在癌症细胞的发育过程中扮演了重要的角色。
四、APC与结直肠癌
APC基因的失活启动了结直肠癌沿正常黏膜-增生-腺瘤-癌的多阶段多步骤发生模式,且稳定存在于肿瘤发生发展的全过程[19]。在结直肠癌中APC基因突变的情况尤为重要。一种情况是基因突变进而翻译出截短蛋白,这些截短蛋白可以通过Wnt信号通路的异常激活而导致肿瘤的发生;另一种情况是APC基因由于二次打击而导致完全失活,此时杂合性缺失(LOH)加突变可能是其主要形式[20]。因此,大肠癌的形成源于基因组损伤的渐进性累积,最初的发病基础之一是W nt/β-catenin通路的异常激活。以Wnt/β-catenin通路中的APC为靶点,在大肠癌的诊断和治疗上有巨大的潜力[7]。
五、结论和展望
APC蛋白作为一种重要的多功能蛋白,处于多种信号通路的交汇处,作为潜在的细胞骨架调节分子将细胞骨架与重要的细胞信号转导通路紧密联系在一起,通过多种途径调控肿瘤的发生、发展、侵袭和转移。因此,APC蛋白对于研究肿瘤有重要的意义,检测APC基因对早期诊断和治疗肿瘤也有着重大的指导意义。因此,关于APC还有许多重要的问题亟待解决。例如失去微管结合区域的截短APC蛋白究竟如何与微管连结,其观点尚未统一;受W n t途径调节的APC-β-catenin-axin如何影响APC对细胞微管蛋白动力学的调节;Wnt途径与细胞周期染色体分离调节之间的关系;在临床方面,APC是否影响大肠癌的浸润深度、临床分期等还存有争议。这些问题有待于今后对APC基因的结构和功能的关系、作用机制,它与其它相关基因的相互作用以及细胞骨架调节与细胞间信号交流的分子机制深入研究。
[1]Thliveris, A. et al. Long-range physical map and deletion characterization of the1100-kb NotI restriction fragment harboring the APC gene. Genomics,1996,34~:226780.
[2]Smith Aj,Stern HS,Penner M,et al.Somatic APC and K-kascodon12 mutation in aberrant crypt foci from hum an colons [J]. Cancer Res,1994,54:5527-5530.
[3]Nathke IS et al. Annu Rev Cell Dev Bio l,2004,20:337-366.
[4]李卓玉,袁静明.肿瘤抑制蛋白APC的结构与功能.生命的化学.2006,26:136-138.
[5]高丰,张学,宋今丹.Wnt途径——调控细胞增殖和癌变的关键途径. 生命科学.2001,2,13:14-17.
[6]Po lakis P. Curr Opin Genet Dev,1999;9 (1):15-21.
[7]李琳娜,袁守军.Wnt/β-catenin信号通路与大肠癌的始发和防治策略.世界华人消化杂志.2006,1,18,14 (2):201-206.
[8]戴文斌.Wnt通路成员APC、β-catenin、c-myc及黏附分子E-cadherin与大肠癌的关系.中国肿瘤临床与康复.2007,14:73-75.
[9]Krecicki T,Smigiel R,Fraczek M,et al. Studies of the cell cycle regulatory proteins P16,cyclin D1 and retinoblastoma protein in laryngeal carcinoma tissue[J].J Laryngol Otol,2004,118(9):676-680.
[10]Van Noort M,Meeldijk J,van der Zee R, et al.Wnt signaling controls the phosphorylation status of beta-caten in[J].J Biol Chem,2002,277(20):17901-17905.
[11]Fodde R.The APC gene in colorectal cancer [J].Eur J Cancer,2002,38(7):867-871.
[12]Foddc R,Smits R,Clevers H.APC,signal transduction and genetic instability in colorectal cancer.Natu re Rev Cancer,2001,1(1):55-67.
[13]Kaplan K B,Burds A A,Swedlow J R,et al.A role for the adenomatous polyposis coli protein in chromosome segregation.Nat Cell Biol,2001,3(3):429-432.
[14]Zumbturm J,Kinoshita K,Anthony A L,et al.Binding of the adenomatons polyposis coli protein to micro tubules increases microtubule stability and is regulated by GSK3-beta phosphorylation.Current Biology,2001,11(1):44-49.
[15]Berrueta L,Tirnauer J S.The APC-associated protein EB1 associates with components of the dynactin complex and cytoplasmie dynein intermediate cham.Current Biology,1999,9(8):425-428.
[16]Mirnori K Y,Shrina N,Tsukita S.The dynamic behavior of the APC-binding protein EB1 on the distal ends of microtubules. Current Biology,2000,10(14):865-868.
[17]王成,郑多,et a l.结肠腺瘤性息肉病蛋白通过与SMAP/KAP3相互作用与微管结合.生物化学与生物物理进展.2002,29(6):885-890.
[18]Mogensen M M,Tucker J B,Mackie J B, et al.The adenomatous polyposis coli protein unambiguously localizes to microtubule plus end and is involved in establishing parallel arrays of microtubule bundles in highly polarized epithelial cells.J Cell Biol,2002,157(6):1041-1048.
[19]Yuan P,Sun MH,Zhang JS,et al.APC and K-ras gene mutation in aberrant crypt foci of hum an colon[J].World J Gastroenterol,2001,7(3):352-354.
[20]叶建新,许东坡,李心翔等.散发性结直肠癌APC基因杂合缺失和突变的研究[J].中华实验外科杂志.2004,21(10):1209-1211.
10.3969/j.issn.1001-8972.2010.14.089
——水芹主要害虫识别与为害症状

