基于烷基锌催化的不对称Henry 反应研究进展
李高伟,赵文献*,郭 蕊,刘新明,郭保国,王敏灿
(1.商丘师范学院化学系商丘师范学院有机新材料合成重点实验室,河南商丘476000;2.郑州大学化学系河南省化学生物与有机化学重点实验室,河南郑州450052)
基于烷基锌催化的不对称Henry 反应研究进展
李高伟1,赵文献1*,郭 蕊2,刘新明1,郭保国1,王敏灿2
(1.商丘师范学院化学系商丘师范学院有机新材料合成重点实验室,河南商丘476000;2.郑州大学化学系河南省化学生物与有机化学重点实验室,河南郑州450052)
Henry反应是一类有效的碳碳键形成反应,其产物邻硝基醇可进一步转化为含氮、氧原子的有机中间体.根据催化剂的结构类型对基于烷基锌金属络合催化的不对称 Henry反应进行了综述.
Henry反应;β-硝基醇;烷基锌;研究进展
Henry反应是Louis Henry[1,2]于1895年最早发现并命名的,它是基于羰基和含有α-活泼氢的硝基烷烃类化合物之间的碳碳键形成反应,其一般机理是硝基化合物的α-活泼氢在碱等夺质子试剂作用下成为碳负离子,然后进攻羰基形成新的碳碳键而得到含β-硝基醇的碳链增长反应.该产物β-硝基醇由于含有双官能团,因此是很重要的有机合成砌块,如硝基醇通过脱水能获得共轭的硝基烯;通过氧化能获得对应的酮;通过还原能获得邻氨基醇等.Henry反应在有机合成化学和药物化学上的应用非常广泛:Trost等[3]通过双功能的金属锌络合的手性催化剂高产率及高立体选择性地合成了两种β1-受体激动剂(-)-arbutamine(即阿布他明)和 (-)-denopamine(即地诺帕明),这两种药物对于慢性充血性心力衰竭的治疗有很好的疗效.(-)-arbutamine的合成首先经催化的不对称 Henry反应得到立体选择性的硝醇产物(85%ee),然后再经Pd/C还原,缩合,去保护基最终得到;相对应的(-)-denopamine也是经催化的不对称 Henry反应得到立体选择性的硝醇产物(90%ee),然后再经Pd/C还原,缩合为酰胺,还原羰基,去保护基最终得到(Scheme 1).
鉴于这一反应的重要性,近年来,特别是最近有关不对称 Henry反应的报道频繁[4-7].由于锌络合物在Henry反应中表现出卓越的催化性能,本文基于有机锌金属络合物催化的不对称 Henry反应予以概述.

Scheme 1
1 烷基锌金属络合物催化的不对称 Henry反应
1.1 双核锌配体螯合的双功能催化剂
Trost研究小组[8]于2002年报道了一种新型双核锌配体螯合的双功能催化剂1应用于催化不对称Henry反应(Scheme 2).这种金属络合催化剂是由相应的手性配体与2倍量的二乙基锌反应制得,然后直接应用于硝基甲烷和醛的反应中,络合物中两个Zn原子可以分别活化亲核试剂和亲电试剂,即烷基锌结构显示出较强的碱性,能与含有活泼氢的底物反应,释放一分子乙烷,增强底物的亲核性,同时另外一个金属锌作为Lewis酸,对底物中的亲电试剂进行活化与定位.这种协同作用,可以使反应很好地完成.经优化结果表明,四氢呋喃中反应结果最好,而在甲苯、二氯甲烷、乙醚溶剂中只能获得中等的对映选择性.低温下(-20℃)反应明显好于5℃,增加硝基甲烷的量可以显著提高反应产率而对其立体选择性影响不大,把催化剂的使用量从5%降到2.5%,ee值几乎没有变化而产率有所下降.应用于不同的醛的 Henry反应,ee值可达78%~93%.他们用该配体催化剂在不对称的aza-Henry反应中[9]同样取得很好的催化效果.

Scheme 2
1.2 氨基醇类催化剂
基于 Trost小组在双核锌催化剂上的工作,Reiser等[10]详细阐述了二乙基锌在二胺及氨基醇催化下的Henry反应,这些二胺或氨基乙醇配体催化下的硝基醇大多是外消旋产物,只有在叔丁基亮氨醇2催化下的少数底物醛才能达到较低的对映选择性(Scheme 3).

Scheme 3
林国强等[11]合成了带有二环[3.3.0]辛烷骨架氨基醇配体3(Scheme 4),配体与二乙基锌按1∶20的摩尔比络合为二核锌催化剂应用于不对称 Henry反应,在催化链状且为大取代基团的芳香族醛 的不对称Henry反应时得到了中等的对映选择性,机理推测可能是其中一分子锌原子作为Lewis酸与底物醛配位,另一分子锌原子作为Bronsted碱与硝基甲烷作用形成了亲核试剂.以环己醛为底物,配体3/Et2Zn的摩尔比为1∶2时,-25℃下反应8 h可得到中等ee值(52%).

Scheme 4
1.3 双唑啉类催化剂
杜大明等[12-13]合成了具有C2-对称轴的双噻唑啉配体4和双噁唑啉配体5,并将其应用于α-酮酸酯的不对称Henry反应.作者发现使用同一种手性配体使之与不同金属络合可以使产物的绝对构型发生反转(Scheme 5),当使用铜络合物时,可以得到 ee值最高达82%的 S型产物,而使用同样的配体与二乙基锌生成的络合物催化这个反应,能得到构型相反的产物(R型),ee值可高达85%.在这两类配体(噻唑啉和噁唑啉)中,当R为苯乙基时相应地比其他取代基的催化活性高,最好的为配体5d.二乙基锌的使用量在20%~60%均有较好的结果.作者根据Jorgenson提出的反应机理,推测了这两个反应的铜催化和锌催化的中间体如Scheme 5中的A和B所示.在铜催化时,配体的两个唑啉环上的N与Cu配位,Cu还可与α-酮酸酯的两个羰基配位.由于弱碱三乙胺不能使配体中两苯环之间的N-H脱氢,因而NH可以与硝基甲烷形成氢键,从而控制反应方向.而在使用Et2Zn时,N-H可脱去氢,留下两个电子对,可以与两个Zn配位.其中一个Zn的作用与Cu类似,可以与配体中的两个唑啉环上的N以及α-酮酸酯的两个羰基配位,而另一个Zn与硝基甲烷作用,从而形成双核锌的中间体,两个底物被两个不同Zn原子定向,反应的进攻方向发生改变,从而导致产物的绝对构型发生反转.可见配体中的N H起到关键作用,即同一配体在与不同金属Cu(Ⅱ)或Zn(Ⅱ)络合时能达到“一石二鸟”的目的.
Wolf小组[14]也报道了一个C2-对称的二噁唑烷6(Scheme 6)可有效催化脂肪醛和芳香醛的不对称Henry反应,产物β-羟基硝基烷烃,产率达99%,ee值达95%.该反应的优点在于所需的配体量大大降低,反应时间较短(9 h),反应条件较温和,且适用于广泛的底物,包括位阻较大的醛.
1.4 手性大环类多核锌络合的催化剂
Martell小组[15]报道了一种新型的手性N4S2和N6S3的大环配体7(Scheme 7)与二乙基锌的络合物可不对称催化Henry反应.该小组首先对与配体络合的金属离子进行了筛选,分别采用了Cu2+,Co2+,Zn2+,Ni2+,Ag+,Ca2+的高氯酸盐,结果表明锌离子与配体络合的催化反应产率最高.因此作者将锌离子与7a和7b的络合物用于不对称催化 Henry反应.催化剂由7a或7b与1~3 equiv.的Et2Zn制得,直接加入含有硝基甲烷及醛的反应体系中,其中形成三核锌催化剂与其单核、双核锌络合物相比,有明显的优点:即产率和立体选择性都有一定的提高(表1).1.5 氮杂环类催化剂

Scheme 5

Scheme 6

Scheme 7
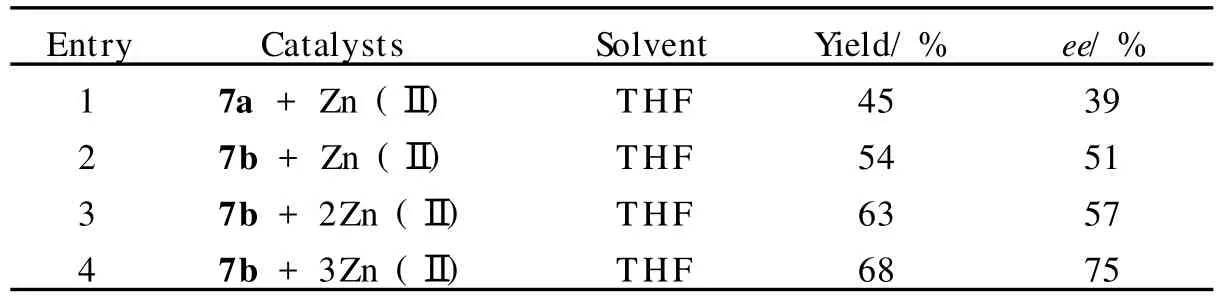
表1 多核锌金属络合催化的结果Table 1 Multinuclear complex Zn(Ⅱ)catalyst system displayed results
Qian小组[16]报道了二吡咯烷衍生的手性配体8(Scheme 8),与二乙基锌络合(1∶1的摩尔比)后,可不对称催化N-磺酰基亚胺的aza-Henry反应,产生中等的ee值(77%).反应在-78℃进行,增加反应温度,ee值显著降低(表2).
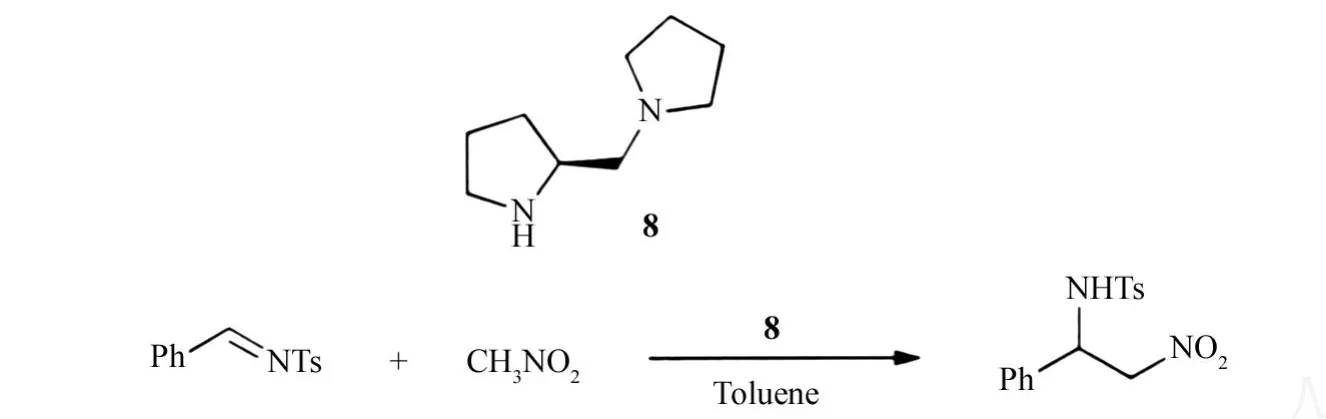
Scheme 8
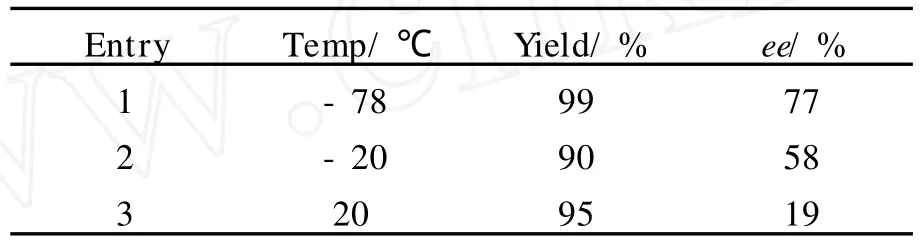
表2 不同温度下的催化结果Table 2 The catalytic results at different temperatures
Dogan小组[17]将二茂铁氮杂环丙基取代的氨基醇配体9与锌络合形成的催化剂用于不对称 Henry反应,手性配体9(Scheme 9)的合成可由丙烯酰二茂铁为原料经简单的三步反应而分别得到.这些光学异构体中配体9a的催化活性最高,作者还系统考察了溶剂、温度、CH3NO2和 Et2Zn的用量等反应条件,最好的反应条件是:-50℃,THF溶剂中,24倍量的CH3NO2,0.54倍量的Et2Zn.此催化剂适用于一系列醛(芳香、脂肪、α,β-不饱和及杂环芳香醛)及α-酮酸酯的不对称 Henry反应,产率达97%,ee值高达91%.该配体具有较高的普适性,同时手性配体可再次回收利用且不丧失催化活性.
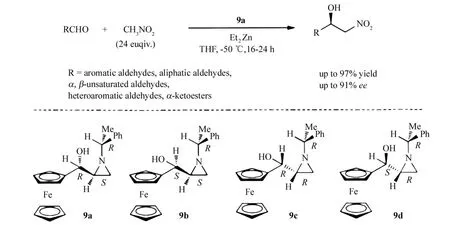
Scheme 9
2 总结与展望
Henry反应是作为一类重要的构建碳碳键的有机反应,最近几年,关于该反应的研究引起了广泛的兴趣,许多不同概念的催化体系被成功发展起来,以上所综述的催化剂同时存在两个活性中心,可以同时活化亲核前体和亲电前体,这种双活化的催化模式称之为双功能催化体系,这种催化体系往往能够使催化剂具有高活性与高选择性.
尽管 Henry反应在催化体系上有很多进步,但是也存在很多的不足,很多催化体系虽然能得到很好的化学产率和对映选择性,但在底物的选择上大多数局限在醛的反应,即使一般的酮 Henry反应也少有报道.同时很多方法对硝基烷烃的使用范围有限,一般只能对硝基甲烷有效.我们相信随着更多高性能、高选择性和廉价的催化剂的开发以及在有机合成中的应用,必将大大扩大这类反应的应用范围.
[1]Henry L,Hebd C R.Formation synthétique dàkool nitzés[J].C R Hebd Seances Acad Sci,1895,120:1265-1268.
[2]Henry L.Formation synthétique dàkool nitzés[J].B ull Sci Chim Paris,1895,13:999-1003.
[3]Trost B M,Lupton D W.Dinuclear zinc-catalyzed enantioselective aza-Henry reaction[J].Org Lett,2007,9(10):2023-2026.
[4]Boruwa J,Gogoi N,Saikia P P,et al.Catalytic asymmetric Henry reaction[J].Tetrahedron:Asymmetry,2006,17(24):3315-3326.
[5]Palomo C,Oiarbide M,Laso A.Recent advances in the catalytic asymmetric nitroaldol(Henry)reaction[J].Eur J Org Chem,2007,2007(16):2561-2574.
[6]雷厉军,何煦昌.不对称 Henry反应的研究进展 [J].合成化学.2006,14(1):7-13.
[7]甘昌胜,潘见.不对称催化 Henry反应研究进展 [J].有机化学.2008,28(7):1193-1198.
[8]Trost B M,Yeh V S C.A dinuclear Zn catalyst for the asymmetric nitroaldol(Henry)reaction[J].A ngew Chem Int Ed,2002,41(5):861-863.
[9]Trost B M,Lupton D W.Dinuclear zinc-catalyzed enantioselective aza-Henry reaction[J].Org Lett,2007,9(10):2023-2026.
[10]Klein G,Pandiaraju S,Reiser O.Activation of nitroaldol reactions by diethylzinc and amino alcohols or diamines as promoters[J].Tetrahedron Lett,2002,43(42):7503-7506.
[11]Zhong Y W,Tian P,Lin G Q.Newβ-amino alcohols with a bicyclo[3.3.0]octane scaffold in an asymmetric Henry reaction[J].Tetrahedron:Asymmetry,2004,15(5):771-776.
[12]Lu S F,Du D M,Zhang S W,et al.Facile synthesis of C2-symmetric tridentate bis(thiazoline)and bis(oxazoline)ligands and their application in the enantioselective Henry reaction[J].Tetrahedron:Asymmetry,2004,15(21):3433-3441.
[13]Du D M,Lu S F,Fang T,et al.Asymmetric Henry reaction catalyzed by C2-symmetric tridentate bis(oxazoline)and bis(thiazoline)complexes:metal-controlled reversal of enantioselectivity[J].J Org Chem,2005,70(9):3712-3715.
[14]Liu S L,Wolf C.Asymmetric nitroaldol reaction catalyzed by a C2-cymmetric bisoxazolidine ligand[J].Org Lett,2008,10(9):1831-1834.
[15]Gao J,Martell A E.Novel chiral N4S2-and N6S3-donor macrocyclic ligands:synthesis,protonation constants,metal-ion binding and asymmetric catalysis in the Henry reaction[J].Org Biomol Chem,2003,1(15):2801-2806.
[16]Gao F,Zhu J,Tang Y,et al.Asymmetric aza-Henry reaction of N-tosyl imine[J].Chirality,2006,18(9):741-745.
[17]Bulut A,Aslan A,DoganÖ.Catalytic asymmetric nitroaldol(Henry)reaction with a zinc-Fam catalyst[J].J Org Chem,2008,73(18):7373-7375.
Research Progress in Catalytic Asymmetric Henry Reaction Based on Alkylzinc Reagents
A review is provided of research progress in asymmetric Henry reaction based on alkylzinc reagents in relation to structure types of chiral catalysts.It is pointed out that Henry reaction is one of the powerful carbon-carbon bond formation reactions;the resulting product of the reaction,β-nitroalcohol,can be transformed into a number of nitrogen-and oxygen-containing derivatives.
Henry reaction;β-nitroalcohol;alkyl zinc;research progress
O 646.1
A
1008-1011(2010)05-0107-06
2010-04-30.
国家自然科学基金(20972091)资助项目.
李高伟(1984-),男,硕士,助教,从事不对称合成及催化研究.*
E-mail:zhwx195812@yahoo.com.cn.

