检测维生素C 的囊泡荧光传感器的制备
李广全,李国文
(1.中国石油兰州化工研究中心,甘肃兰州730060; 2.吉林大学超分子材料与结构国家重点实验室,吉林长春130012)
检测维生素C 的囊泡荧光传感器的制备
李广全1*,李国文2
(1.中国石油兰州化工研究中心,甘肃兰州730060; 2.吉林大学超分子材料与结构国家重点实验室,吉林长春130012)
利用合成的含有识别基团苯硼酸和荧光读出基团萘的新型双亲化合物(DNMPBA)在THF/水选择性溶剂中自组织成囊泡,囊泡的相变温度为56.8℃;当向囊泡体系加维生素C时,DNMPBA囊泡中的萘生色基在345 nm的荧光峰强度急剧减弱.荧光强度减弱归于所形成的硼酸酯增强了DNMPBA双亲化合物中一个氧原子孤对电子对萘生色基的淬灭作用.DNMPBA囊泡与维生素C的相互作用而导致体系荧光强度变化,使该体系有可能应用于检测生物物质如维生素C的化学传感器.
双亲化合物;传感器;囊泡;荧光光谱;维生素C
近年来,设计、合成用于检测生物物质的有效的荧光化学传感器已成为超分子化学领域极为活跃的研究课题[1].维生素C是维持生命活动的重要物质,研制新型检测维生素C浓度的方法,受到人们的广泛关注.目前,检测维生素C的方法有分光光度法、经典碘量法、催化动力学光度法、色谱分析法、导数光谱法、2,4-二硝基苯肼比色法、电化学法和流动注射光度法等多种方法.这些方法大多数具有明显的缺陷.如经典碘量法所用到的三氧化二砷是一种剧毒物质,并且操作过程复杂.2,4-二硝基苯肼比色法操作也很复杂,易受共存物的影响,而且活性炭对维生素C的氧化作用是基于表面吸附氧进行的界面反应,加入量直接影响到测试结果的准确性.流动注射光度法对于所用仪器的工作状态和测试时的工作条件都会对测试结果产生影响,并且这种方法要求被测物维生素C的浓度也要在一定的范围之内.因此寻求一种灵敏度高,操作简便,重复性好的检测维生素C的方法很有必要.目前尚未见用囊泡荧光传感器检测维生素C的方法的报道.
根据Czarnik[2]和后来Shinkai[3]等人的工作,硼酸衍生物已被广泛用于识别含邻二醇结构的碳水化合物和邻苯二酚,并涌现了许多成功的范例[4].已知苯硼酸(PBA)基团与1,2-和1,3-二羟基化合物形成可逆硼酸酯,这种紧密结合使硼酸可以用作构建联二醇类传感器识别的功能基团.由于苯硼酸化合物不能发荧光,所以根据内在的光谱性质变化来测定识别过程的光学变化是很困难的.James and Wang B等研究小组研发了多种含有苯硼酸和各种生色基组成的有机化合物作为糖的传感器[5],通过荧光强度的变化高效的检测了糖的浓度.维生素C在结构上和糖非常相似,也是含有邻二醇结构的环状化合物,但是也存在着明显的不同,即维生素C的环状结构中有电子云密度较高的双键存在.因此利用硼酸类化合物作为维生素C的检测器时,其作用机理也存在着明显的差异.以往的研究中多是利用糖与硼酸形成硼酸脂后糖环的吸电子作用削弱检测器分子的PET效应而使检测器分子的荧光强度得到恢复,而维生素C由于双键结构的存在不但不能削弱PET效应,反而进一步加强了这种作用,因此检测器的荧光强度进一步降低.
为了发展基于连续检测的化学传感器器件,人们需要进行进一步的探索.如果将识别基团苯硼酸和荧光生色基同时引入双亲分子中,通过自组织作用,制备囊泡传感器,这种囊泡传感器不但有利于提高检测的灵敏度还有可能实现制备可进入生物体内的连续检测传感器.因此我们对具有较高的选择性和适度的亲合性荧光囊泡传感器非常感兴趣[6].为此,我们利用合成的含有苯硼酸识别基团和荧光读出基团的对-((5-十二烷氧基-1-氧基)萘)甲基苯硼酸双亲化合物,在稀水溶液中自组织成双分子层排列的囊泡,通过囊泡在识别维生素C前后的生色基的荧光强度的变化,检测维生素C的浓度,制备了囊泡传感器,为制备连续检测维生素C浓度的生物传感器提供了有益的信息.
1 实验部分
1.1 试剂与仪器
所有的药品和溶剂均为分析纯,购于天泰化学试剂公司.水为二次去离子水.
囊泡形态用JSM-6700F型场扫描电镜观测,荧光光谱用日本岛津RF-5301PC荧光光谱仪测定,囊泡的相变用Netzsch DSC 204差示扫描量热仪测定.
1.2 实验过程
化合物对-((5-十二烷氧基-1-氧基)萘)甲基苯硼酸(DNMPBA)按照文献[7]制备.
1.3 DNMPBA囊泡的制备[8]
在10 mL容量瓶内,将0.0462 g的双亲化合物DNMPBA溶于色谱级的氯仿,用高纯氮气吹干溶剂后用真空泵抽真空0.5 h.使其在容器壁上形成薄膜.加入含有混合磷酸盐缓冲剂的去离子水与四氢呋喃的混合溶剂(φ=0.6),p H=6.86.浓度为1×10-4mol·L-1,用超声波超声震荡4 h,此时溶液的温度可达到50℃,将装有DNMPBA的容量瓶放入冰水中冷却0.5 h后,放置室温中.样品滴加在硅片上,真空干燥,待测扫描电镜.
2 结果与讨论
DNMPBA囊泡的形态由扫描电镜观测,典型的SEM([DNMPBA]=1×10-4mol·L-1)如图1所示.由图1得出囊泡的直径约70~500 nm.差示扫描量热(DSC)测得凝胶态到液晶态的相变温度56.8℃,如图2所示.实验结果表明,DNMPBA双亲化合物在 THF/水选择性溶液中形成了囊泡[8-9].
荧光光谱的测定:把维生素C的磷酸缓冲溶液(p H=6.86)用可调微量进样器滴加到DNMPBA囊泡THF/水选择性磷酸缓冲溶液(p H=6.86)中,用干净的注射器将溶液混匀后静置10 s.用295 nm光激发,囊泡溶液与各种不同浓度的维生素C体系的荧光光谱如图3所示.
从图3可用看出,DNMPBA囊泡溶液在345 nm的荧光峰的强度随维生素C浓度从0到1×10-2mol·L-1的增大而急剧减弱,表明DNMPBA囊泡中DNMPBA双亲化合物上的苯硼酸与维生素C形成了硼酸酯,硼酸酯的形成导致萘生色基的荧光强度减弱[10].以加入维生素C时的荧光强度 I与不含维生素C时溶液的荧光强度 I0的比值与维生素C加入量的关系作图得到图4.

图1 DNMPBA囊泡的电镜照片Fig.1 SEM images of DNMPBA vesicles
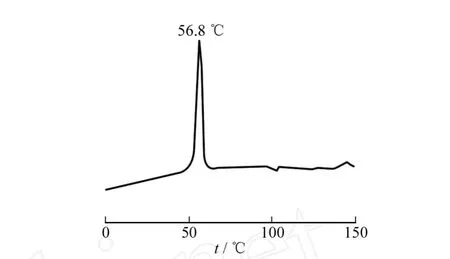
图2 DNMPBA囊泡的DSC扫描曲线Fig.2 DSC thermogram of the DNMPBA vesiculer solution
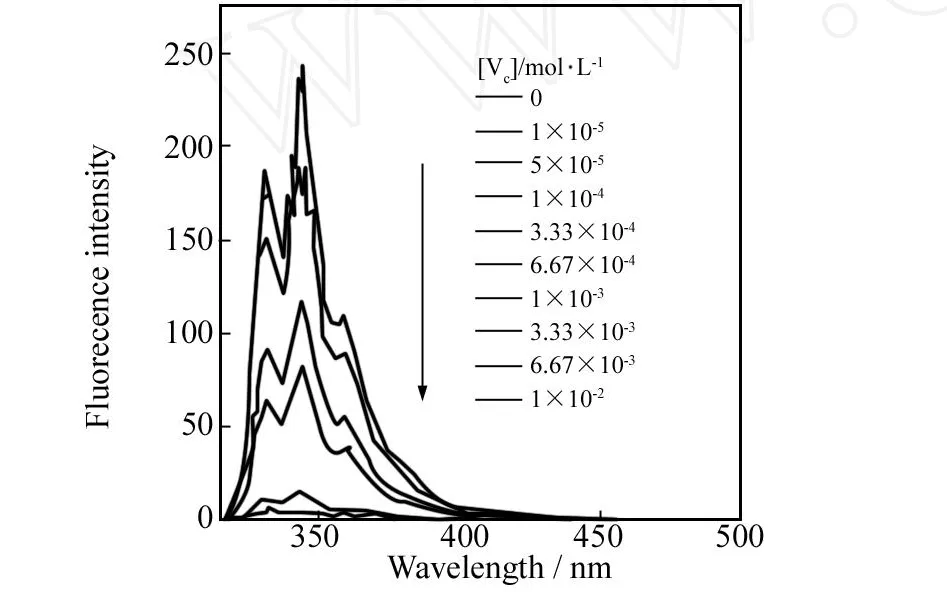
图3 DNMPBA囊泡溶液中加入维生素C(0~1×10-1 mol·L-1)的荧光光谱变化曲线;激发波长为295 nmFig.3 Fluorescence spectral changes of DNMPBA vesicular solution at different concentrations of vitamin C(0~1×10-1mol·L-1);λex=295 nm
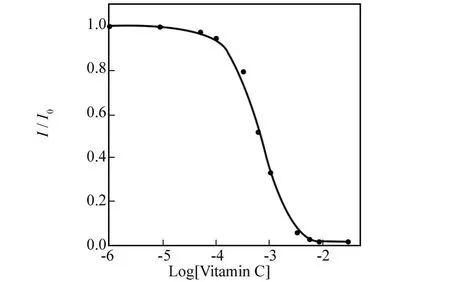
图4 DNMPBA囊泡溶液中加入不同浓度的维生素C时荧光光谱中 I/I0随维生素C浓度变化曲线(激发波长为295 nm)Fig.4 Fluorescence intensity changes(I/I0)of DNMPBA(1×10-4mol·L-1)as a function of vitamin C concentration in 0.1 mol·L-1 phosphate buffer at p H 6.86;λex=295 nm
从图4可以看出,溶液中的维生素C浓度为1×10-5mol·L-1时溶液的荧光光谱未发生显著变化,当溶液中的维生素C浓度为1×10-4mol·L-1时溶液的荧光光谱强度开始有明显的下降,当溶液中的维生素C浓度达到1×10-2mol·L-1时这种变化达到最大.通过图4可知,DNMPBA囊泡传感器对于维生素C的最低检出浓度可达1×10-4mol·L-1,是一种非常灵敏的检测方法.
利用硼酸与二醇共价键结合,为人们提供了识别含二醇结构化合物传感器的潜在功能.在DNMPBA双亲化合物中,O原子是连接在其他基团的对位,在DNMPBA囊泡体系中,囊泡中萘的荧光强度随维生素C浓度的增加而减弱,这可能是由于DNMPBA双亲化合物中与萘相连的氧原子的孤对电子,通过光电子转移淬灭了萘的荧光,而硼酸酯的形成则进一步加强了氧原子的孤对电子的淬灭作用(图5),从而导致荧光强度降低.
3 结论
含有苯硼酸和萘生色基分别作为识别基团和荧光读出基团的新型双亲化合物,对-((5-十二烷氧基-1-氧基)萘)甲基苯硼酸(DNMPBA)在 THF/水选择性溶剂中自组织成囊泡,囊泡的相变温度为56.8℃.当向囊泡体系加入维生素C时,DNMPBA囊泡中的萘生色基在345 nm的荧光峰的强度急剧减弱.荧光强度减弱可能是由于所形成的硼酸酯增强了DNMPBA双亲化合物中与萘环相连的一个氧原子孤对电子对萘生色基的淬灭作用所致.DNMPBA囊泡与维生素C相互作用而导致体系荧光强度变化,使该体系有可能被用来制备检测生物物质如维生素C的化学传感器.
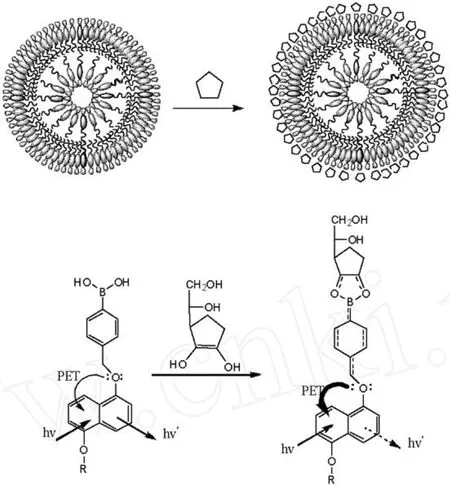
图5 DNMPBA与维生素C作用形成硼酸脂时引起体系的荧光强度变化的示意图Fig.5 Illustrative molecular recognition process of the DNMPBA and vitamin C as well as schematic binding of the proposed interaction mode for DNMPBA/vitamin C molecules on the surface of the vesicles
[1]Sessler J L,Camioolo S,Gale P A.Pyrrolic and polypyrrolic anion binding agents[J].Coord Chem Rev,2003,240:17-55.
[2]Yoon J,Czarnik A W.Fluorescent chemosensors of carbohydrates.A means of chemically communicating the binding of polyols in water based on chelation-enhanced quenching[J].J A m Chem Soc,1992,114:5874-5875.
[3]James T D,Shinkai S,Sadanay K.Chiral discrination of monosaccharides using a fluorescent molecular sensor[J].N ature,1995,374:345-347.
[4]Robertson A,Shinkai S.Cooperative binding in selective sensors,catalysts and actuators[J].Coord Chem Rev,2000,205:157-199.
[5]a.Zhao J Z,Fyles T M,James T D.Chiral binol-bisboronicacid as fluorescence sensor for sugar acids[J].A ngew Chem Int Ed,2004,43:3461-3464;b.Springsteen G,Wang B H.A detailed examination of boronic acid-diol complexation[J].Tetrahedron,2002,58:5291-5300;c.Yang W,Gao X,Wang B.Boronic acid compounds as potential pharmaceutical agents[J].Medicinal Res Rev,2003,23:346-368.
[6]Wang Q S,Li G Q,Li G W,et al.Glucose-responsive vesicular sensor based on boronic acid glucose recognition in the ARS/PBA/DBBTAB covesicles[J].Sensors and Actuators B,2006,119:695-700.
[7]李广全,张瑀健,李国文,等.新型含苯硼酸和萘双亲化合物的合成与囊泡荧光传感器的制备 [J].高等学校化学学报,2009,30(9):1809-1813.
[8]Moss R A,Okumura Y.Surface-differentiated model phospholipid bilayers[J].J A m Chem Soc,1992,114:1750-1756.
[9]Kunnitake T,Okahata Y.Formation of stable bilayer assemblies in dilute aqueous solution from ammonium amphiphiles with the diphenylazomethine segment[J].J A m Chem Soc,1980,102:549-553.
[10]a.James T D,Samankumara K R A,Iguchi R,et al.Novel saccharide-photoinduced electron transfer sensors based on the interaction of boronic acid and amine[J].J A m Chem Soc,1995,117,8982-8987;b.Gao S,Wang W,Wang B.Building fluorescent sensors for carbohydrates using template-directed polymerizations[J].Bioorg Chem,2001,29:308-320.
Preparation of Fluorescent V esicular Sensor for Determination of Vitamin C
A novel amphiphile containing two functional groups of both naphthalene and phenylboronic acid,p-((5-dodecyloxy-1-oxy)naphthalene)methyl-phenylboronic acid(DNMPBA)was synthesized.The amphiphile has self-organized into vesicles in the selective solution of THF/water(φ=0.6)buffered at p H 6.86.TheTcof the vesicles from crystal to liquid crystal is 56.8℃.Addition of vitamin C to the vesicular solution,the fluorescent intensities of naphthalene in DNMPBA vesicles centred at 345 nm weakened dramatically with increasing concentration of vitamin C.The decreace of fluorescence intensity is ascribed to boronic ester formation which might largen the photoinduced electron transfer(PET)progress.The vesicular sensor through the interactions between boronic acid and vitamin C displayed at a biomimetic membrane interface can be detected by means of fluorescence intensities.The results suggest that the fluorescent vesicles might be used as biosensors to determine vitamin C.
amphiphile;sensor;vesicles;fluorescence spectrum;vitamin C
O 629.4
A
1008-1011(2010)05-0068-04
2010-05-20.
李广全(1981-),男,工程师,博士,研究方向:生物检测器及树脂加工研究.*
,E-mail:liguangquan@petrochina.com.cn.

