海产动物体内虾青素的代谢及转运沉积
刘合露, 郑怀平, 张 涛, 李远友
(汕头大学 广东省海洋生物技术重点实验室, 广东 汕头 515063)
海产动物体内虾青素的代谢及转运沉积
Metabolism, transportation and deposition of astaxanthin in marine animals
刘合露, 郑怀平, 张 涛, 李远友
(汕头大学 广东省海洋生物技术重点实验室, 广东 汕头 515063)
在海洋生物中抗菌素头孢霉素及之后维生素 A和 β-胡萝卜素抗肿瘤活性的发现激发了人们研究海洋生物类胡萝卜素的热潮, 至今已有 650多种类胡萝卜素被发现[1]。虾青素(Astaxanthin) 是一种端基为酮基的类胡萝卜素色素, 化学名称为3, 3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素, 其化学结构如图 1所示(其中R=CH3), 分子式为C40H52O4, 分子质量为596。虾青素不溶于水, 但易溶于二硫化碳、丙酮、苯和氯仿等有机溶剂。虾青素不仅具有抗氧化、抗肿瘤、增强免疫力、提高繁殖力等生理功能, 而且拥有艳丽的红色及极强的色素沉积能力。因此, 虾青素已被广泛地应用于食品、饲料、医药、化妆品、养殖等行业。
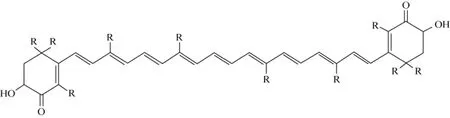
图1 虾青素的反式结构
基于虾青素有很高的商业价值, 目前国内的研究多集中在生产开发[2]、药物活性[3]、饲料应用[4]等方面, 而对它在生物体内的积累及代谢机制的研究很少。作者综述了国内外有关海产动物体内虾青素的来源、吸收、组织中的分布、代谢及转运沉积的研究, 以期为海产动物虾青素的开发利用、利用虾青素改善养殖海产动物品质及遗传育种工作提供参考。
1 海产动物体内虾青素的来源
虾青素是类胡萝卜素家族的成员之一, 是类胡萝卜素合成的终点。动物体内缺乏相关酶系自身不能合成虾青素, 海产动物也不例外。但研究发现, 海产动物从腔肠动物[5]、甲壳动物[6]、软体动物[7]、棘皮动物[8]、尾索动物[9]等无脊椎动物到鱼类[10]等脊椎动物的体内均含有丰富的虾青素。海产动物体内虾青素的主要来源是通过摄食含虾青素的藻类或其他微生物, 从而在体内积聚虾青素[11]。许多藻类及一些真菌具有合成虾青素的能力[12], 如衣藻Chlamydomonasnivalis、绿球藻Chlorococcumsp.、伞藻Acetabularia mediterranea、 栅藻Scenedesmus komarekii、裸藻Euglena rubida、小球藻Chlorella zofingiensis、雪藻Chlamydomonasspp.等在环境胁迫时能够合成虾青素。其中, 雨生红球藻是自然界中虾青素含量最高的生物, 其含量最高可达细胞干质量的4%。真菌中的红发夫酵母菌Phaffia rhodozyma,Rhodotorula rubra、Peniophorasp.、Cryptococcus和Sporobolomyces等都可以产生虾青素。许多海洋细菌如Paracoccus haeundaensis[13]也有合成虾青素的能力。海洋动物可通过摄食这些藻类或细菌在体内积累虾青素, 它们可能再被其他食肉性动物猎食, 从而导致虾青素在后者体内积累。Negro等[14]的试验已很好地证明了这一点。他们分析了鹳不同体成分的色素, 发现在有龙虾的地区, 该地区的鹳主要取食龙虾, 其皮肤、血液、脂肪组织都含有虾青素, 而在没有龙虾的地区,鹳的血液中检测不到虾青素, 同时他也检测到龙虾体内含有虾青素, 由此可见, 鹳体内虾青素来自虾并在自身体内积累。此外, 甲壳类等海产动物还具有把摄取的类胡萝卜素转化为虾青素的能力[15,16]。
2 海产动物虾青素的代谢机制
2.1 虾青素在动海产物体内的分布
动物种类不同, 其摄食方式以及保持、沉积虾青素的能力也不同, 因而导致它们体内虾青素含量也有很大差异, 如虹鳟Oncorhynchus mykiss中虾青素质量比为50.0 mg/kg, 大西洋鲑Salmo salar为49.2 mg/kg[10], 野生银大马哈鱼Coho salmon平均为14.0 mg/kg、红大马哈鱼O. nerka为40.0 mg/kg[17]; 米氏海参Holothuria moebi的体内虾青素质量比只有0.87 mg/kg[8], 而甲壳类的甲壳中含有很高的虾青素,Celia等[18]用乙酸乙酯从1kg对虾壳中可提取虾青素184.0 mg, Felix等[19]用CO2超临界萃取时最高可达207.6 mg/kg。因此, 利用甲壳类下脚料提取虾青素已发展成一个很大的产业。
即使是同一生物, 不同身体部位的虾青素含量也可能存在很大差异。在黑海参H. atra中, 内脏的虾青素质量比为36.8 mg/kg, 性腺为94.6 mg/kg, 同属的 H. leucospilota中, 体壁为 5.7 mg/kg, 内脏为35.5 mg/kg, 性腺高达147.9 mg/kg[8]。动物体内虾青素的这种不均匀分布可能与生物的生理、生化以及对环境的适应有关, Holothuria属生活在海底, 但卵是漂浮的, 虾青素可能为卵提供一种光保护机制,而性腺中高含量的虾青素可能有利于虾青素向卵中转移, 内脏可能有作为一种容器而暂时贮存虾青素的作用; 鲑鱼在停止投喂虾青素三天后血液中虾青素的浓度才开始下降[20], 由此也说明某些组织有暂时存储虾青素的能力。此外, 某些贝类体内的色素还具有季节性变化(作者待发表数据), 猜测这一方面可能与季节性环境变化有关, 如光照、水温、饵料种类与丰度等, 另一方面也可能与动物自身生长、繁殖等生理特性有关。
2.2 虾青素在海产动物体内的消化吸收
类胡萝卜素在动物胃肠道消化酶的作用下, 从其蛋白结合物中分离出来, 在十二脂肠中与其他脂类物质一起经胆汁乳化后形成微团(乳糜微粒), 自由扩散到肠壁表面, 然后由肠黏膜细胞吸收[21,22]。动物吸收虾青素与虾青素的来源、含量、食物成分以及动物自身遗传因素有关。Bjerkeng等[23]测得养殖56 d和112 d大比目鱼对虾青素的表观消化率(ADC)为77.8和71.1, 大西洋鲑为45.9和59.2, 但最终能保持下来的量很低, 保持率分别为0和3.9%。Wathne等[24]测得实际上食物中仅有 7.5%~12.5%的虾青素被大西洋鲑保留下来, 可见鲑鱼对虾青素的利用率是非常低的。
在食物中增加脂质有利于鲑体内虾青素的积累[25,26], Olsen[27]研究了鲑鱼食物中脂质含量及胆汁酸对虾青素吸收的影响: 与鱼油相比, 大豆卵磷脂能显著降低虾青素的吸收, 增加牛磺酸后吸收率可以提高 20%, 猪油也能显著地增加血液中虾青素的含量, 但升高卵磷脂的量却降低了虾青素的吸收。对此他认为磷脂的增加有利于混合微团的形成, 溶解性也增加, 但同时也增加了混合微团的体积, 较难扩散, 不易运输, 故大豆卵磷脂也出现类似的结果;对猪油为什么能增加虾青素的吸收的具体机制不是很明确, 他猜测虾青素溶于脂质后, 可以更好地与胆汁酸盐微团结合而被运送到肠道绒毛细胞被吸收;给鲑鱼投喂含14C标记的虾青素五天后在肠黏膜组织中可以检测到高含量的14C虾青素[28]。
肠道绒毛细胞吸收不同类胡萝卜素, 其机制不同, 对于疏水性的虾青素, 很多学者认为是通过被动运输的方式被吸收[20,29]。Choubert等[20]研究发现鲑鱼血液中虾青素的浓度与食物中浓度成线性剂量关系; Olsen等[27]进一步证实食物虾青素的浓度是影响血液虾青素浓度的主要因素。这表明虾青素的吸收最可能是通过被动方式进行[30,31], 但虾青素的吸收是否需要特殊蛋白的协助还需要更多的试验证据。
2.3 虾青素在海产动物体内的代谢
尽管人们对动物体内虾青素代谢的具体过程及相关的酶还不是很清楚, 但已有的研究显示, 虾青素的代谢方式在海产动物体内与在哺乳动物体内并不相同。在小鼠的离体培养肝细胞中, 虾青素的代谢产物有 3-羟基-4-酮基-p-紫罗(兰)酮和它的还原物 3-羟基-4-酮基-7, 8-二氢-p-紫罗(兰)酮两种[32]; 在人体中虾青素代谢和小鼠类似, 但代谢产物有4种, 分别是 3-羟基-4-酮基-p-紫罗(兰)酮和 3-羟基-4-酮基-p-紫罗(兰)醇, 及它们的还原物 3-羟基-4-酮基-7, 8-二氢-p-紫罗(兰)酮和 3-羟基-4-酮基-7, 8-二氢-p-紫罗(兰)醇, 其中, 两种醇类产物能与蛋白质结合以复合物的形式存在[33]。Bandaranayake等[8]研究了低等的无脊椎动物海参中色素成分及其次生产物, 虽不能确定虾青素的代谢物, 但在海参的次生代谢物中并没有检测到与小鼠或人体中相同的代谢产物; 而且虾青素在海产动物体内经代谢后能够被转化为idoxanthin和维生素A[34~39], 而在小鼠、人等的体内却不能[33]。表明虾青素在海产动物与陆生哺乳动物体内有不同的代谢途径。
Idoxanthin似乎是海水鱼代谢虾青素的第一个产物, 给大西洋鲑投喂用14C标记的虾青素6 h后, 可以在血液中检测到虾青素的还原产物 idoxanthin[40];Bjerkeng等[23]也检测到投喂虾青素的大西洋鲑和大比目鱼的血液、肝脏及全肾中都含idoxanthin, 由此他推测虾青素在两种鱼体内代谢方式可能是一致的,但有关idoxanthin的代谢缺乏相关报道。虾青素被转化为维生素 A在大西洋鲑[35]、比目鱼(Hippoglossus hippoglossus )[41]、淡水孔雀鱼(Lebistes reticulatus)和杂色剑尾鱼(Xiphophorus variatus)[42]中都有报道, 但在甲壳动物中似乎缺乏这种能力[43]。
在鱼类肠道中虾青素的代谢比较复杂, Schiedt等[35]和Al-Khalifa等[36]发现缺乏维生素A时大西洋鲑肠道中大量的虾青素被转化为维生素 A1和 A2;Schiedt等[44]等还检测到大西洋鲑肠道中78%的虾青素被转化为idoxanthin; Guillou等[45]通过同位素标记在虹鳟鱼肠道中检测到虾青素可以被代谢为金盏花黄质(adonirubin)。此外, 一些文献中提到虾青素能逆转化为 β-胡萝卜素及玉米黄质[46]。可见肠道组织是虾青素代谢重要场所。
3 虾青素在海产动物体内的转运沉积
3.1 虾青素在海产动物体内的转运
Ando等[47]发现在大西洋鲑血液中虾青素与脂蛋白结合, 同时也能与另一种不含脂质、大小与血清蛋白类似的高密度蛋白(HDPF)结合; Aas等[40]给大西洋鲑投喂14C标记的虾青素, 6 h后血液中可以检测到含14C标记的虾青素, 之后迅速上升, 30 h后饱和, 血液中HDPF、HDL、LDL含14C标记的虾青素,质量分数分别为58%、36%、6%。这表明虾青素可能和脂质一样, 通过这些蛋白载体运输到各组织中, 但只具有这些蛋白受体的组织细胞才能存储虾青素[47]。
Kitahara[48]发现在雌鲑鱼性成熟过程中肌肉中的虾青素也可通过血清脂蛋白运输到卵和腹被膜中,之后卵黄蛋白原被发现也参与了此过程[49,50]。
Bjerkeng等[23]通过比较大西洋鲑和大比目鱼对虾青素的积累, 发现经过112 d的养殖, 鲑体内虾青素的质量比(2.5 mg/kg)显著地高于比目鱼体内虾青素的质量比(0.04 mg/kg); Sarah等[51]研究发现大西洋鲑肌肉中与虾青素结合的蛋白为α-辅肌动蛋白,比目鱼中也存在能与虾青素结合的α-辅肌动蛋白。结合Bjerkeng的研究[23], Sarah推测比目鱼含虾青素低的原因可能是不同动物体内除虾青素的代谢途径不同外, 虾青素转运沉积能力也有很大不同, 结合蛋白不是虾青素积累的限制因素。
3.2 虾青素在海产动物体内的沉积
虾青素经转运进入动物体内各组织后, 以虾青素酯或类胡萝卜素蛋白质复合物形式暂时储存, 因为, 游离态虾青素的化学性质不稳定, 而酯化形式或类胡萝卜素蛋白质结合形式的虾青素能够稳定地存在[52]。游离虾青素以及与类胡萝卜素蛋白结合形式要沉积在动物体内, 仍需要经过酯化作用[53]。可见,酯化作用对虾青素在动物体内的沉积具有重要作用。但不同种类动物、同一动物不同组织中, 虾青素的储存形式略有不同, 如在鲑鱼的皮肤中, 虾青素以单酯或双酯的形式存在, 在肌肉中则以游离形式存在[54]; Dall等[16]发现在老虎对虾 Penaeus esculentus表皮中, 虾青素主要以单酯和双酯的形式存在,但性腺在成熟过程中, 游离虾青素浓度急剧升高可达总量的 80%, 并推测虾青素在这种对虾的卵及幼虫的发育过程中有重要的作用。虾青素的这种功能在后来的研究中得到很好的体现, 如 Sawanboonchun等[55]发现在饲料中添加虾青素后大西洋鳕产卵量稍减, 但卵的质量、孵化率却明显比对照组高。此外,虾青素酯可能有利于虾青素的大量存储和在组织间的转运。当血液及组织中游离虾青素含量升高时合成虾青素酯大量储存在某些组织中, 当血液及组织中游离虾青素含量降低时虾青素酯水解释放游离的虾青素维持各组织中虾青素浓度的动态平衡, 如在天鹅龙虾Panulirus cygnus性成熟过程中, 刚蜕下的红色壳中虾青素含量(以虾青素酯形式存在)是新生白色壳的2.4倍, 但表皮中游离的虾青素在蜕壳前后变化不大[51]; 另外, 酯化的虾青素也可能有具有某些生理功能, 如Wade认为酯化的虾青素在天鹅龙虾中可促进虾青素分泌进入外骨骼[51]。
虾青素在海产动物体内的沉积一方面与环境因素有关, 如食物、温度、栖息地背景色、光周期等[56],另一方面也与其自身的遗传因素有关, 如 Melville-Smith 等[57]发现天鹅龙虾体色的改变可能更多的取决于体内某些编码分子的改变, 环境因素的作用是微效的; Tlusty等[58]在研究全同胞美洲螯龙虾虾青素沉积后也发现遗传因素起到了重要的作用; Bjerkeng等[23]、Sarah等[51]发现与同样摄取含虾青素食物的鲑鱼相比, 大比目鱼的 ADC显著高于大西洋鲑, 但大比目鱼对虾青素的保持率几乎为零, 导致其体内虾青素的积累量极低, 可见高的ADC并不意味着能更多的积累虾青素; 另外, Bjerkeng等[23]的研究显示组织对不同构型的虾青素的沉积具有选择性, 鲑鱼肌肉和血液只保持全反式结构的虾青素, 而 13Z-虾青素只在肝脏和肾中积累。以上研究结果表明, 通过定向遗传选育, 培育出虾青素转化率及积累量高、具多种营养功能的海产动物新品种是可能的, 也为人们从自然界获取更多的虾青素提供了新思路。
4 展望
虾青素在动物体内的沉积转运、代谢吸收相当复杂, 许多过程还需更深入的探索, 如虾青素酯化的细微过程、细胞吸收的具体机制、代谢的清晰途径、转运与沉积中的基因控制等。由于虾青素的重要商业价值和广阔的应用前景, 阐明这些过程不但更有益于虾青素的商业利用, 而且从生理、生化、遗传等多个角度阐明动物体内虾青素的来源、转运、沉积、代谢等机制对培育富含虾青素的海产动物新品种具有重要指导意义。
[1] Matsuno T. Aquatic animal carotenoids [J]. Fish Sci,2001, 67: 771-783.
[2] 董庆霖, 赵学明, 马红武, 等. 生物技术生产虾青素研究的最新进展[J]. 生物加工过程, 2004, 2 (2): 18-24.
[3] 张晓丽, 刘建国. 虾青素的抗氧化性及其在营养和医药应用方面的研究[J]. 食品科学, 2006, 17 (1): 258-262.
[4] 蔡明刚, 王杉霖, 李文权, 等. 天然虾青素在水产养殖业中的应用研究进展[J]. 台湾海峡, 2003, 22 (3):377-384.
[5] Czeczugh B. Some carotenoids in the jelly-fish Aurelia aurita (Scyphozoa: Discomedusae) [J]. Mar Biol, 1970,5: 140-144.
[6] Czerpak R, Czeozuga B. Studies of the pigments in the shrimp Crangon crangon (Crustacea: Malacostraca) [J].Mar Biol, 1969, 3: 122-125.
[7] Dreon M S, Ceolín M, Heras H. Astaxanthin binding and structural stability of the apple snail Carotenoprotein ovorubin [J]. Arch Biochem Biophys, 2007, 460: 107-112.
[8] Bandaranayake W M, Des Rocher A. Role of secondary metabolites and pigments in the epidermal tissues, ripe ovaries, viscera, gut contents and diet of the sea cucumber Holothuria atra [J]. Mar Biol, 1999, 133:163-169.
[9] Rebachuk N M, Maksimov O B, Boguslavskaya L S, et al. Carotenoids of the ascidian Halocynthia aurantium[J]. Chem Nat Compounds, 1983, 20 (4): 407-409.
[10] Page G I, Davies S J. Tissue astaxanthin and canthaxanthin distribution in rainbow trout (Oncorhynchus mykiss) and Atlantic salmon (Salmo salar) [J]. Comp Biochem Physiol Part, 2006, 143 A: 125-132.
[11] Britton G, Liaaen-Jenson S, Pfander H. Carotenoids:Isolation and Analysis [M]. Vol. 1A. Basel: Birkhäuser,1995. 236-268.
[12] 滕长英.雨生红球藻控制虾青素合成的关键酶基因的转录调控元件[D]. 中国科学院研究生院(海洋研究所), 2003.
[13] Lee J H, Kim Y T. Functional expression of the astaxanthin biosynthesis genes from a marine bacterium Paracoccus haeundaensis [J]. Biotechnol Lett, 2006,28: 1 167-1 173.
[14] Negro J J, Garrido-Fernández J. Astaxanthin is the major carotenoid in tissues of white storks (Ciconia ciconia)feeding on introduced crayfish (Procambarus clarkii) [J].Comp Biochem Physiol Part, 2000, 126 B: 347-352.
[15] Tanaka Y, Matsugchi H, Katayama T, et al. The metabolism of the carotenoids in the prawn, Penaeus japonicus Bate [J]. Bull Jpn Soc Sci Fish, 1976, 42:197-202.
[16] Dall W, Smith D M, Moore L E. Carotenoids in the tiger prawn Penaeus esculentus during ovarian maturation [J]. Mar Biol, 1995, 123: 435-441.
[17] Turujman S A, Wamer W G, Wei R R, et al. Rapid liquid chromatographic method to distinguish wild salmon from aquacultured salmon fed synthetic astaxanthin [J].J AOAC Int, 1997, 80 (3): 622-632.
[18] Giovanni C. Extracting astaxanthin [P]. Eur Pat Appl,EP: 77583 A2, 1983-04-27.
[19] Felix V L, Higuera C I, Goycoolea V F. Supercritical CO2/ethanol extraction of astaxanthin from blue crab(Callinectes sapidus) shell waste [J]. J Food Proc Eng,2001, 24 (2): 101-112.
[20] Choubert G, Gomez R, Milicua J-C G. Response of serum carotenoid levels to dietary astaxanthin and canthaxanthin in immature rainbow trout Oncorhynchus mykiss [J]. Comp Biochem Physiol Part, 1994, 109 A:1 001-1 006.
[21] Furr H C, Clark R M. Intestinal absorption and tissue distribution of carotenoids [J]. J Nutr Biochem, 1997,8: 364-377.
[22] Thyssandier V, Lyan B, Borel P. Main factors governing the transfer of carotenoids from emulsion lipid droplets to micelles [J]. Biochim Biophys Acta, 2001, 1533:285-292.
[23] Bjerkeng B, Berge G M. Apparent digestibility coefficients and accumulation of astaxanthin E/Z isomers in Atlantic salmon (Salmo salar L.) and Atlantic halibut(Hippoglossus hippoglossus L.) [J]. Comp Biochem Physiol Part, 2000, 127 B: 423-432.
[24] Wathne E, Bjerkeng B, Storebakken T, Vassvik V, Odland A B. Pigmentation of Atlantic salmon (Salmo salar)fed astaxanthin in all meals or in alternating meals [J].Aquaculture, 1998, 159: 217-231.
[25] Nickell D C, Bromage N R. The effect of dietary lipid level on variation of flesh pigmentation in rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture, 1998,161: 237-251.
[26] Torrissen O J. Dietary delivery of carotenoids[A].Decker E A, Faustman C, Lopez-Bote C J. Antioxidants in Muscle Foods: Nutritional Strategies to Improve Quality [C]. New York: John Wiley & Sons, 2000.281.
[27] Olsen R E, Kiessling T A, Milley J E, et al. Effect of lipid source and bile salts in diet of Atlantic salmon,Salmo salar L., on astaxanthin blood levels [J]. Aquaculture, 2005, 250: 804-812.
[28] Torrissen O J, Ingebrigtsen K. Tissue distribution of14C-astaxanthin in the Atlantic salmon (Salmo salar) [J].Aquaculture, 1992, 108: 381-386.
[29] Castenmiller J M, West C E. Bioavailability and bioconversion of carotenoids [J]. Ann Rev Nutr, 1998, 18:19-38.
[30] Kiessling A, Dosanjh B, Higgs D, et al. Dorsal aorta cannulation: a method to monitor changes in blood levels of astaxanthin in voluntarily feeding Atlantic salmon [J]. Aquac Nutr, 1995, 1: 43-50.
[31] Kiessling A, Olsen R E, Buttle L. Given the same dietary carotenoid inclusion, Atlantic salmon, Salmo salar(L.) display higher blood levels of canthaxanthin than astaxanthin [J]. Aquac Nutr, 2003, 9: 253-261.
[32] Wolz E, Liechti H, Notter B, et al. Characterization of metabolites of astaxanthin in primary cultures of rat hepatocytes [J]. Drug Metab Dispos, 1999, 27: 456-462.
[33] Kistler A, Liechti H, Pichard L, et al. Metabolism and CYP-inducer properties of astaxanthin in man and primary human hepatocytes [J]. Arch Toxicol, 2002, 75: 665-675.[34] Wolf G. Multiple functions of vitamin A [J]. Physiol Rev, 1984, 64: 873-937.
[35] Schiedt K, Leuenberger F J, Vecchi M, et al. Absorption, retention and metabolic transformations of carotenoids in rainbow trout, salmon and chicken [J]. Pure Appl Chem, 1985, 57 (5): 685-692.
[36] Al-Khalifa A S, Simpson K L. Metabolism of astaxanthin in the rainbow trout (Salmo gairdneri) [J]. Comp Biochem Physiol Part, 1988, 91 B: 563-568.
[37] Guillou A, Choubert G, Storebakken T, et al. Bioconversion pathway of astaxanthin into retinol2 in mature rainbow trout (Salmo gairdneri Rich.) [J]. Comp Biochem Physiol Part, 1989, 94 B: 481-485.
[38] Moren M, Næss T, Hamre K. Conversion of β-carotene,canthaxanthin and astaxanthin to vitamin A in Atlantic halibut (Hippoglossus hippoglossus L.) juveniles [J].Fish Physiol Biochem, 2002, 27 (1-2): 71-80.
[39] White D A, Ørnsrud R, Davies S J. Determination of carotenoid and vitamin A concentrations in everted salmonid intestine following exposure to solutions of carotenoid in vitro [J]. Comp Biochem Physiol Part,2003, 136 C: 683-692.
[40] Aas G H, Bjerkeng B, Storebakken T, et al. Blood appearance, metabolic transformation and plasma transport proteins of14C-astaxanthin in Atlantic salmon(Salmo salar L.) [J]. Fish Physiol Biochem, 1999, 21:325-334.
[41] Mari Moren, Tore Næss and Kristin Hamre. Conversion of β-carotene, canthaxanthin and astaxanthin to vitamin A in Atlantic halibut (Hippoglossus hippoglossus L.)juveniles [J]. Fish Physiol Biochem, 2002, 27: 71-80.
[42] Gross J, Budowski P. Conversion of carotenoids into vitamins A1 and A2 in two species of freshwater fish[J]. Biochem J, 1966, 101: 747-754.
[43] Dall W. Carotenoids versus retinoids (Vitamin A) as essential growth factors in penaeid prawns (Penaeus semisulcatus) [J]. Mar Biol, 1995, 124: 209-213.
[44] Schiedt K, Mayer H, Vecchi M, et al. Metabolism of carotenoids in salmonids. Distribution and absolute configuration of idoxanthin in various organs and tissues of one Atlantic salmon (Salmo salar L.) fed with astaxanthin [J]. Helv Chim Acta, 1988, 71: 881-886.
[45] Guillou A., Choubert G, de la Noüe J. Absorption and blood clearance of labelled carotenoids ([14C]astaxanthin,[3H]canthaxanthin and [3H]zeaxanthin) in mature female rainbow trout (Oncorhynchus mykiss) [J]. Comp Biochem Physiol Part, 1992, 103 A: 301- 306.
[46] Xu Y Q, Ding Z K. Traced Studies on Metabolism of Astaxanthin in Atlantic Salmon (Salmo salar) [J]. J Exp Zool, 2004, 301 A: 317-323.
[47] Ando S, Hatano M. Bilirubin-binding protein in the serum of spawning-migrating chum salmon, Oncorhynchus keta: Its identity with carotenoid-carrying lipoprotein [J]. Fish Physiol Biochem, 1988, 5 (2): 69-78.
[48] Kitahara T. Behavior of carotenoids in the chum salmon(Oncorhynchus keta) during anadromous migration [J].Comp Biochem Physiol Part, 1983, 76 B: 97-101.
[49] Ando S, Takeyama T, Hatano M, et al. Carotenoid-carrying lipoproteins in the serum of chum salmon(Oncorhynchus keta) associated with migration [J].Agric Biol Chem, 1985, 49: 2 185-2 187.
[50] Ando S, Hatano M. Deterioration of chum salmon Oncorhynchus keta muscle during spawning migration-XIV. Carotenoids in the serum lipoproteins of chum salmon associated with migration [J]. Bull Fac Fish Hokkaido Univ, 1986, 37: 148-156.
[51] Sarah J, Lall S P, Tom A, et al. Astaxanthin binding protein in Atlantic salmon [J]. Comp Biochem Physiol Part, 2006, 144 B: 206-214.
[52] Arai S, Mori T, Miki W, et al. Pigmentation of Juvenile Coho Salmon with Carotenoid Oil Extracted from Antarctic Krill [J]. Aquaculture, 1987, 66: 255-264.
[53] Wade N, Ken C G, Wilson K J, et al. Esterified astaxanthin levels in lobster epithelia correlate with shell colour intensity: Potential role in crustacean shell colour formation [J]. Comp Biochem Physiol Part,2005, 141 B: 307-313.
[54] Simpson K L. Carotenoid pigments in seafood[A].Martin R E,Flick G J, Ward D R. Chemistry and Biochemistry of Marine Food Products [C]. Westport, CT:AVI Publishing Company, 1982.115-136.
[55] Sawanboonchun J, Roy W J, Derek A, et al. The impact of dietary supplementation with astaxanthin on egg quality in Atlantic cod broodstock (Gadus morhua, L.)[J]. Aquaculture, 2008, 283: 97-101.
[56] Rao K R. Pigmentary effectors[A]. Bliss D E, Mantel L H. Integuments, Pigments and Hormonal Processes [C].New York: Academic Press, 1985. 385-462.
[57] Melville-Smith R, Cheng Y W, Thomson A W. Factors affecting colour change in white western rock lobsters Panulirus cygnus [J]. J Exp Mar Biol Ecol, 2003, 291:111-129.
[58] Tlusty M, Hyland C. Astaxanthin deposition in the cuticle of juvenile American lobster (Homarus americanus): implications for phenotypic and genotypic coloration [J]. Mar Biol, 2005, 147: 113-119.
S968
A
1000-3096(2010)04-0104-05
2009-03-18;
2009-07-02
广东省海洋渔业科技推广专项项目(A200899E03); 广东省教育部产学研结合项目(2009B090300344)
刘合露(1984-), 男, 湖北黄石人, 硕士研究生, 电话:0754-82903285, E-mail: 08glliu@stu.edu.cn, 研究方向: 贝类遗传育种;郑怀平, 通信作者, 电话: 0754-82903285, E-mail: hpzheng@stu.edu.cn
(本文编辑: 康亦兼)

