氨氮对文蛤存活及能量收支的影响
陈金凤, 黄鹤忠, 徐汗富, 何华敏, 范皖苏, 丁飞飞
(苏州大学 生命科学院, 苏州大学 水产研究所, 江苏 苏州 215123)
氨氮对文蛤存活及能量收支的影响
陈金凤, 黄鹤忠, 徐汗富, 何华敏, 范皖苏, 丁飞飞
(苏州大学 生命科学院, 苏州大学 水产研究所, 江苏 苏州 215123)
在实验室条件下, 研究了氨氮(NH3-N)对文蛤(Meretrix meretrix)的急性毒性作用以及对其能量收支的影响。实验结果表明: 在水温(24.5±0.5)℃, 盐度21.5, pH8.00的条件下, 文蛤(壳长3.85~4.35cm)死亡率随着氨氮质量浓度、胁迫时间的增加而增加(P<0.05)。96 h文蛤死亡率与添加氨氮(NH3-Nt) 质量浓度对数的回归方程为Y=2.3787x+0.3246 (R2=0.978 9), 文蛤对总氨氮(NH3-Nt)或分子氨(NH3-Nm)的安全浓度(SC96h)为9.237 mg/L或0.418 mg/L; 随着环境中添加氨氮(NH3-Nt)质量浓度的不断上升(0, 0.5,1, 2, 4, 9, 18, 36 mg/L), 文蛤摄食能不断下降, 呼吸能和排泄能则呈现出先升高后降低的趋势; 当总氨氮(NH3-Nt)在0~2 mg/L (或NH3-Nm≤0.090 mg/L)时, 文蛤的生长余力没有显著变化(P﹥0.05); 当总氨氮(NH3-Nt)≥4 mg/L(或NH3-Nm≥0.181mg/L)时, 文蛤的生长余力显著降低(P<0.05)。因此, 文蛤养殖环境中的NH3-Nt或NH3-Nm应控制在2mg/L 或0.090 mg/L以下水平。
文蛤(Meretrix meretrix); 氨氮胁迫; 安全质量浓度; 能量收支; 生长余力
给文蛤增养殖业带来了较大的经济损失, 甚至威胁到该产业的生存。研究表明, 环境污染是引起文蛤大量死亡的重要原因之一, 其中, 氨氮胁迫可能是其重要诱因[1,2]。氨氮是水产养殖中重要的水体环境指标, 是影响水生生物生存的重要环境因子。养殖水体中残饵、排泄物等有机物经微生物分解后均可产生大量的氨氮、硫化氢以及亚硝酸氮等有毒物质, 其中,
氨氮量增加尤为显著, 已成为水产养殖业中的常见胁迫因子[3]。它可能通过影响文蛤的摄食、呼吸、排泄等基本生理活动, 影响其能量代谢效率, 甚至导致其死亡。然而, 有关氨氮胁迫对文蛤的毒性及其能量收支影响的研究国内外尚未见报道。作者在实验室条件下研究了氨氮对文蛤的急性毒性作用, 以及文蛤在不同氨氮质量浓度胁迫下的能量代谢和生长余力, 以期查明文蛤的安全氨氮质量浓度, 以及环境氨氮质量浓度对文蛤能量收支的影响, 从而为文蛤增养殖生产的密度控制、水质管理以及活体运输等提供有益的帮助。
1 材料与方法
1.1 实验材料
实验于2009年4月至2009年7月在室内进行。实验所用文蛤(Meretrix meretrix)均采自江苏省南通市通州沿海滩涂养殖区, 取回实验室后, 清洁壳表污物和附着生物, 于实验室暂养2周以上, 选择健康无病、活力强、规格基本一致的个体进行实验。暂养和实验所用海水为按照海洋调查规范中的配方配制的人工海水, 盐度 21.5, pH控制为 8.00±0.05, 水温控制在(24.5±0.5)℃。暂养期间充气, 每天全换水2次(9: 00, 21: 00); 以纯种小球藻作为饵料, 密度保持在4×105个/mL左右。
1.2 实验方法
1.2.1 急性毒性实验
实验在水体为15 L的玻璃水槽中进行。根据预实验的结果, 正式实验的氨氮质量浓度梯度按等对数间距设置分组, 依次为: 0, 63, 112, 200, 355, 631mg/L, 用 NH4Cl(分析纯)配制, 每组投放文蛤 20只,并设3个重复。

表1 一个换水周期(12 h)内各组实验水体的水质情况Tab. 1 The water quality of the different concentration group in 12 h
实验期间每隔 4 h用化学分析法测定一次各组水体实际的氨氮质量浓度、溶氧量、pH值和水温, 并调节pH值在7.95~8.05之间(表1)。每12 h全换水一次, 实验历时96 h。每隔4 h观察记录1次死亡个数并及时挑出死亡个体, 以贝壳张开, 碰触无闭壳反应为死亡标准。参照《水生生物监测手册》[4], 采用概率单位法求出半致死浓度(LC50)和安全浓度(SC=0.1×96 h LC50)。
1.2.2 摄食率和同化效率的测定
根据急性毒性实验结果(96h LC50为92.37 mg/L;SC为9.237 mg/L), 设置以下各氨氮质量浓度组: 0,0.5, 1.0, 2.0, 4.0, 9.0, 18.0, 36.0 mg/L。文蛤于实验室暂养 1周后先进行氨氮胁迫驯化, 每天逐渐提高氨氮质量浓度, 5天内提高至各组实验所需质量浓度。在各实验质量浓度下继续驯化5 d后开始正式实验。
采用静水系统法[6]测定摄食率。25 L的玻璃实验水槽, 每个加入20 L预先配好的一定饵料密度的海水, 小球藻密度约为4×105个/mL, 然后添加氨氮至各实验组所需质量浓度, 调节pH 为7.95~8.05。每个质量浓度设置3个重复, 一个对照。实验组每个水槽放置8只文蛤, 对照组不放文蛤,n=24。实验进行6 h, 分别于实验开始和结束时取500 mL水样, 测定玻璃水槽中饵料密度, 以颗粒有机物(POM)表示。
摄食率(RI)根据实验前后水体中饵料密度的变化来计算, 计算公式如下:

式中,V为实验水体体积(L);W为实验文蛤的软体干质量(g);t为实验持续的时间(h);C0和Ct分别为实验开始和结束时实验水槽内的饵料密度(以POM表示,mg/L);C1和C2分别为实验开始和结束时对照水槽内的饵料密度(以POM表示, mg/L)。
同化效率(Abs)依 Conover(1966)的灰分比例法进行测定。

式中,F′代表摄入食物中有机物对干质量的比率;E′代表排出的粪便中有机物对干质量的比率。
1.2.3 耗氧率和排氨率的测定
耗氧率和排氨率的测定也采用静水系统法[7]。实验在5.85~6.05 L的细口玻璃瓶中进行, 瓶口用插有进水管和出水管的橡皮塞密封。预先在玻璃缸中配制好各种质量浓度的氨氮溶液各 50 L, pH调控为7.95~8.05。然后采用虹吸法将配置好的各种氨氮质量浓度的实验海水从进水管引入细口瓶中, 轻轻晃动瓶子, 气泡自出水管中流出, 流水约20 min, 待文蛤张口后, 依次关闭进水管和出水管。实验结束后,使实验水体混匀, 打开进水管, 流水 300~400 mL后, 取两份水样, 测定水中溶氧和氨氮含量。根据预实验结果, 确定每个实验组文蛤放置数量为6只、持续时间为5 h(实验结束时瓶内的溶氧量≥5.0 mg/L)。每个质量浓度组均设置 3个重复, 一个空白对照,n=18。
耗氧率(ROC)和排氨率(RN)根据实验前后溶解氧和氨氮的质量浓度变化来计算, 计算公式如下:

式中,O0和O1分别为实验结束时空白和处理的溶解氧含量(mg/L);N0和N1分别为实验结束时空白和处理的氨氮含量(mg/L);V为实验容器的容积(L);t为实验持续的时间(h);W为实验文蛤的软体干质量(g)。
1.2.4 贝类能量收支模型
能量收支分配模式一般采用Bayne和Carfoot[8,9]提出的能量基本模型:C=F+U+R+P;C-F=A×Abs
式中,C为贝类摄取食物中的总能量;F为贝类摄取的食物中没有被利用而随粪便排出的能量(即排粪能);U为排泄能;R为呼吸代谢消耗的能量;P为贝类用于生长消耗的能量, 也称为生长余力(SFG);A为同化能;Abs为同化效率。
摄食能C根据摄食率及POM能量转换公式求出,1mg POM=20.78 J[10]; 呼吸能R根据耗氧率及O2能量转换公式求出, 1μmol O2=0.45 J[11]; 排泄能U根据排氨率及NH3-N能量转换关系: 1μmol NH3-N=0.34 J[12]。
1.3 数据处理
对相关实验数据做统计分析, 数据以平均值±标准差表示, 用SPSS13.0软件进行单因素多重方差分析, 以P<0.05表示差异显著, 以P<0.01表示差异极显著。
2 结果与分析
2.1 急性毒性实验结果
从表 2中可以看出, 文蛤死亡率随着氨氮质量浓度、胁迫时间的增加而增加。具体而言, 24 h、48 h、72 h和96 h时添加NH3-N质量浓度(0, 63, 112,200, 355, 631 mg/L)与文蛤死亡率间的各相关系数分别为: 0.869、0.918、0.950、0.864; 在相同胁迫质量浓度下, 文蛤的死亡率随胁迫时间而提高, 质量浓度越高其趋势越明显。另外, 在实验过程中发现, 最高质量浓度组(631 mg/L)的文蛤出现双壳夹断斧足软体组织的现象, 其他质量浓度组呈现出伸出进出水管的文蛤的个数随质量浓度递增而递减的趋势。
对表 2的数据作直线回归处理, 以添加氨氮(NH3-N)质量浓度对数为横坐标, 死亡概率单位为纵坐标, 作出质量浓度对数与96 h死亡率变化趋势图,得出回归方程Y=2.378 7x+0.324 6(R2=0.978 9), 从而计算出总氨氮(NH3-Nt)对文蛤 96 h的半致死浓度(LC50)和安全浓度(SC)分别为 92.37(其中 NH3-Nm4.18 mg/L)和 9.237 mg/L(其中 NH3-Nm0.418 mg/L)。
2.2 氨氮胁迫对文蛤摄食率、同化效率、耗氧率和排氨率的影响
由表 3可以看出, 氨氮(NH3-N)胁迫对文蛤(3.85~4.35cm)单位体质量摄食率、同化效率、耗氧率和排氨率有显著影响。氨氮从4.0 mg/L上升至最大值 36.0 mg/L过程中, 随着质量浓度的逐渐增加,摄食率呈显著降低趋势(P<0.05); 氨氮从 9.0 mg/L上升至36.0 mg/L过程中, 随着质量浓度的逐渐增加,同化效率呈显著降低趋势(P<0.05)。表明文蛤在高质量浓度氨氮胁迫下, 摄食减少, 同化能力降低; 氨氮从0上升至9.0 mg/L过程中, 随着质量浓度的逐渐增加, 耗氧率呈显著增加趋势(P<0.05), 继续增加氨氮质量浓度时, 耗氧率则逐渐显著下降(P<0.05); 排氨率则是随氨氮质量浓度从0上升至4.5 mg/L, 呈现显著增加趋势(P<0.05), 但继续增加氨氮质量浓度时,排氨率出现显著下降(P<0.05), 甚至出现了负排氨现象。表明文蛤在高质量浓度氨氮胁迫下, 其生理状态出现了异常。
消耗的O原子与排出的N原子之间的比值(O/N),在一定程度上反映了海水无脊椎动物能量代谢中蛋白质的利用情况, O/N比值大小来推测贝类在一定的环境条件下是以哪种代谢方式为主。如果机体主要由脂肪或碳水化合物供能, 则其 O/N值较大甚至无穷大; 若由蛋白质和脂肪共同氧化供能, 则 O/N值约为 24; 如果完全由蛋白质氧化供能, O/N约为7[13]。本实验结果表3显示, 低氨氮质量浓度(NH3-Nt≤4.50 mg/L)条件下文蛤的 O/N值与对照组无显著性差异(P>0.05), 此时文蛤消耗的能量较多来源于蛋白质; 较高氨氮质量浓度(NH3-Nt18 mg/L)胁迫下O/N的比值却显著高于对照组(P<0.05), 此时文蛤消耗的能量则可能较多来源于脂肪和糖类; 而高质量浓度的氨氮 NH3-Nt≥36.00 mg/L)胁迫下, 会引起文蛤代谢混乱。
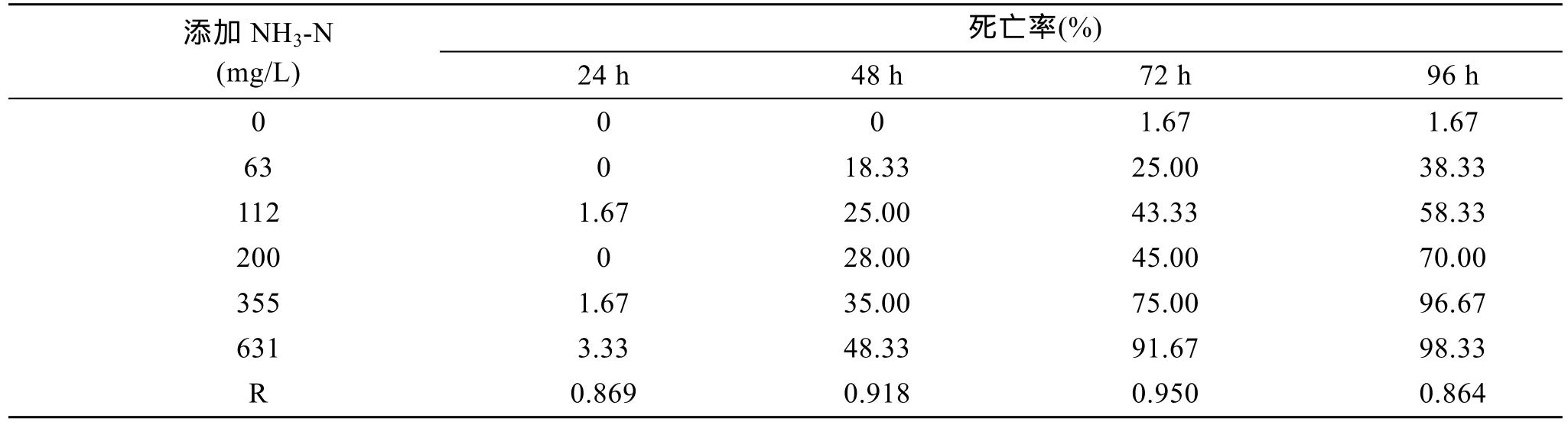
表2 氨氮(NH3-N)对文蛤死亡率的影响Tab. 2 Effect of NH3-N on the mortality rate of M. meretrix

表3 氨氮胁迫对文蛤摄食率、同化效率、耗氧率和排氨率的影响Tab. 3 Effects of NH3-N on ingestion rate, assimilation rate , oxygen consumption rate and ammonia excretion rate ofM. meretrix
2.3 氨氮胁迫对文蛤能量收支的影响
单因素方差分析表明, 水体添加氨氮显著影响文蛤摄食能、同化能、呼吸能和排泄能(表4)。氨氮从0上升至4.0 mg/L过程中, 随着质量浓度的逐渐增加, 呼吸能和排泄能都呈逐渐升高的趋势, 而摄食能和同化能呈递减趋势, 这说明在氨氮胁迫下文蛤摄入的能量减少, 而用于呼吸和排泄等基本新陈代谢的能量增加, 导致用于生长的能量相对减少了;当氨氮上升至 18 mg/L时, 呼吸能和排泄能虽较对照组降低, 但由于摄食能的大量降低, 贝类用于生长的能力仍显著低于对照组。
3 讨论
水体中氨氮以NH3和NH4+两种形式存在, 其比率取决于水中的 pH 值、水温、含盐量等。生产上大多以直接测定的总氨质量浓度(NH3-Nt)作为水质指标, 而氨的毒性主要取决于 NH3(即 NH3-Nm)[14],因此, 目前偏向于以分子氨(NH3-Nm)来表示氨对水生生物的毒性[14,15]。分子氨不带电荷, 具有较高脂溶性, 很容易透过细胞膜, 它能降低鱼虾贝类的产卵能力,损害鳃组织以至引起死亡。国家海水水质标准(GB3097 - 1997)规定海水中 NH3-Nm的质量浓度应小于 0.020 mg/L, 显然这是对大多数海洋生物尤其是幼体的安全性而言。本实验结果, 分子氨(NH3-Nm)对壳长为3.85~4.35cm文蛤的96 hLC50为4.18 mg/L,SC为0.418 mg/L, 该值处于秦宗[16]报道的分子氨对贝类的96 hLC50范围3.3~6.0 mg/L内。
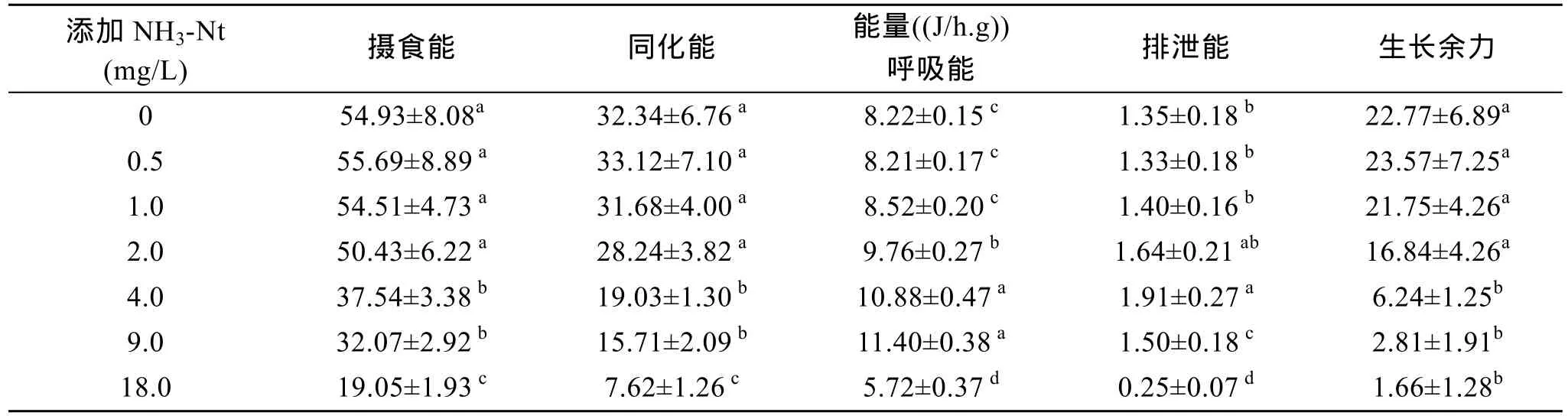
表4 氨氮胁迫对文蛤能量收支的影响Tab. 4 The effects of NH3-N on energy budget of M. meretrix
养殖环境中氨积累对养殖动物的毒害效应之一是促进了动物的耗氧率和抑制了动物的排氨率。Needham[17]曾指出青圆蟹(Carcinus maenas)体内氨的排放受到外部环境中氨质量浓度的抑制。在本实验中, 当氨氮在0~4 mg/L范围内增加时, 文蛤的耗氧率和排氨率都呈现了逐渐上升的趋势, 这与 Chen等[18]研究报道的中国对虾(Penaeus chinensis)暴露于0, 1.2, 2.1, 2.9, 4.3, 5.5 mg/L的氨氮环境中时, 其耗氧率和排氨率均上升的研究结果一致。当氨氮在9~36mg/L范围内增加时, 文蛤的排氨率不断下降,甚至在最高质量浓度组(36 mg/L)出现了负排氨。当氨氮质量浓度较高时排氨率降低, 这与 Wang等[19]报道的日本沼虾暴露于0, 9.1, 18.3, 36.6 mg/L的氨氮环境中时, 其排氨率均下降也吻合。一些研究[20]也曾指出, 当环境中的氨氮质量浓度过高时, 会出现排氨率为负值(即氨氮渗入体内)。
在低质量浓度的氨氮条件下, 文蛤的耗氧率和排氨率均升高, 原因可能是低质量浓度的氨氮对文蛤产生胁迫作用, 使其活动能力增强, 呼吸频率加快, 代谢增强。当质量浓度过高时, 文蛤组织和血液里的氨越来越高, 不能及时排出体外, 血液和组织中氨的质量浓度升高, 血液载氧能力降低, 导致组织缺氧, 呼吸量减少。氧氮比(O/N)是估计生物体代谢中能源物质的化学本能, 尽管尚未证明 O/N值差异对有机体的生长速率及生长结束时所能达到的个体大小有直接的影响, 但已有诸多迹象表明 O/N值可代表有机体对环境压力适应程度的一项指标[21]。一般认为, 在适宜的条件下贝类体内的蛋白质是不断积累的, 对贝类的供能, 以蛋白质为主, 以脂肪和碳水化合物为次。本次实验中当氨氮质量浓度在0~9.0 mg/L内变化时, O/N 值没有显著差异(P>0.05),供能物质主要以蛋白质为主。当氨氮增加到18 mg/L时, O/N 有显著增加(P<0.05), 这表明此时文蛤体内的供能物质已发生了变化。当氨氮质量浓度增加到36 mg/L时, 文蛤甚至出现了负排氨, 这些都说明在高质量浓度氨氮环境下文蛤的能量代谢功能已经出现了紊乱。
在水生动物中, 排氨的可能机制是被动的排出NH3和 NH4+, 以及 NH4+与 Na+的交换。有学者[22,23]已经证实了美洲蓝蟹(Callinectes sapidus)和一些海洋鱼类的 NH4+排出和 Na+泵入存在一个平衡。Armstrong等[24]报道了环境中 NH4+引起了罗氏沼虾NH3排出的抑制和 NH4+摄入的增加。所以从某种程度上推断, 环境氨氮对于动物排氨率的抑制可能是因为破坏了这个离子泵的平衡。分子氨(NH3-Nm)可以通过水生动物鳃上皮细胞以扩散的方式从血液进入到水中。Kinne[25]报道分子氨从血液向水中扩散是鱼类氨代谢的一种主要途径。但是如果环境中的氨质量浓度增加, 氨分子则可以通过扩散进入鱼体。氨分子在紧贴鳃上皮的酸性边缘层中与 CO2水解所形成的 H+结合而成氨离子, 形成并维持离子氨从血液到鳃所需要的电压梯度[26], 这也是一种将氨排出体外的方式。但是若环境中pH的增加使得鳃上皮边缘层电压梯度逆转, 氨排泄就被抑制[27]。同时外界分子氨的增加往往引起向体内扩散能力的增加, 体内分子氨的增加导致体内的NH3和NH4+将重建平衡, 分子氨(NH3-Nm)向离子氨(NH4-N+)转化, 又促进分子氨进入体内。这样, 水生动物不仅难以将含氮废物以氨的形式排出, 反而会从水环境中吸入一部分氨,导致体内积累大量的氨。
生长余力代表的是动物在维持摄食、呼吸与排泄等基本生理需要后所能提供其生长和繁殖的能量。Harris等[28]报道白鲍幼体在高含量的氨氮环境中, 其食物消耗减少, 能量支出增加, 耗氧率提高,因此生长受到抑制。本实验中 NH3-Nt≤2 mg/L(或NH3-Nm≤0.090 mg/L)时, 文蛤生长余力没有显著差异(P 0.05), 当 NH3-Nt≥4mg/L 时, 文蛤的生长余力显著下降, 说明此质量浓度已对文蛤的生长已经产生了抑制作用。
4 结论
研究表明, 氨氮对文蛤的生存和生长都有显著的影响。在水温(24.5±0.5)℃, 盐度21.5 , pH 8.0的条件下, 急性毒性实验显示, 氨氮(NH3-N)对壳长3.85~4.35cm 文蛤 96 h LC50为 92.37mg/L(NH3-Nm4.18 mg/L), SC 为 9.237 mg/L(NH3-Nm0.418 mg/L)。贝类生理能量学实验显示, 当氨氮(NH3-Nt)≤2 mg/L(NH3-Nm≤0.090 mg/L)时, 对文蛤的生长无显著影响; 当氨氮(NH3-Nt)≥4 mg/L(NH3-Nm≥0.181 mg/L)时, 文蛤的生长已经受到抑制。故从能量学角度来看, 文蛤养殖水体应控制氨氮(NH3-Nt或NH3-Nm)质量浓度在2 mg/L或0.181 mg/L以下。
[1] 于志华. 高潮区小文蛤大批死亡原因及防治技术[J].水产养殖, 1997, 5: 27-28.
[2] 刘军义, 赖卫昌, 等. 浅析广西文蛤大批死亡的原因及防治对策[J]. 中国水产, 2001, 1: 52-53.
[3] 孙舰军, 丁美丽. 氨氮对中国对虾抗病力的影响[J].海洋与湖沼, 1999, 3: 267-272.
[4] 国家环保局《水生生物监测手册》编委会. 水生生物监测手册[M]. 南京: 东南大学出版社, 1993. 44-51.
[5] 国家海洋局. 海洋监测规范[Z]. 北京: 海洋出版社.1991. 23-57.
[6] Coughlan M P, Rajagopalan K V. On the inducibility of a pancreatic lactase[J]. Archives of Biochemistry and Biophysics, 1969, 131: 177-179.
[7] 刘英杰. 青蛤摄食生理和代谢生理以及能量收支的基础研究[D]. 青岛: 中国海洋大学, 2005.
[8] Bayne B L, Newell R C. Physiological energetics of marine mollusks[J]. The Mollusca, 1983, 4(1):407-515.
[9] Carfoot T H. Animal energetics[M]. New York: Academic Press, 1987. 89-172.
[10] Jorge M. The effects of salinity on the physiological ecology of Choromytilus chorus[J]. Mar Biol Ecol,1988, 122: 19-33.
[11] Gnaiger E. Calculation of energetic and biochemical equivalents of respiratory oxygen consumption [J].Aquatic and Physiological Application, 1983, 337-345.[12] Bayne B L, Hawkins A J S, Navarro E. Feeding and digestion by the mussel Mytilus edulis L.(Bivalvia:Mollusca)in mixture of silt and algal cells at low concentration[J]. Mar Biol Ecol, 1987, 111: 1-22.
[13] Bayne B L, Widdows J. The physiological ecology of two populations of Mytilus eelulis L.[J]. Oecologia,1978, 37: 137-162.
[14] Thurston R V, Russo R J, Vinogradov G A. Effect of the pH on the toxicity of the un-ionized ammonia species[J]. Environ Sci Technol, 1981, 15: 837~840.
[15] 魏天柱, 董海林. 非离子态氨对鲤鱼种的毒性实验[J]. 河北渔业, 2008, 12: 22-32.
[16] 秦宗 , 氨氮对水生生物的毒性[J]. 养鱼世界, 1986,4: 36-37.
[17] Needham A E. Factors affecting nitrogen excretion in Pennant[J]. Physiol Comp Oecol, 1957, 4: 209-239
[18] Chen Jian-chu , Nan Fan-hua. Oxygen consumption and ammonia-N excretion of prawns(Penaeus chinensis )exposed to ambient ammonia[J]. Arch Environ Contain Toxicol, 1991, 21: 377-382.
[19] Wang A L. Effect of dietary vitamin C supplementation on the oxygen consumption, ammonia-N excretion and Na+/K+ ATPase of Macrobrachium nipponense exposed to ambient ammonia[J]. Aquaculture, 2003, 220:833-841.
[20] Chen J C, Lin C Y. Responses of oxygen consumption,ammonia-N excretion and urea-N excretion of Penaeus chinensis exposed to ambient ammonia at different salinity and pH levels[J]. Aquaculture, 1995, 136:243-255.
[21] Widdows J. Physiological in dices of stress in my tilus edulis [J]. J Mar Biol Ass U K, 1978, 58: 125-142.
[22] Booth C E. Mechanisms of branchial H+and ammonia excretion in exercising blue crabs, Callinectes sapidus[J]. Biochemistry and molecular Biology,2000, 13-15.
[23] Michael P W. Mechanisms of ammonia excretion across fish gills[J]. Biochem Physiol, 1997, 118:39-50.
[24] Armstrong D A, Chippendale D, Knight A W,et al.Interaction of ionized ammonia and unionizedammonia on short term survival and growth of prawn larvae[J].Biol Bull, 1978, 154: 15~31.
[25] Kinne O. Cultivation of marine organisms: Water quality management[J]. Marine ecology, 1976, 1: 79-300.
[26] Wi1kie M P. Ammonia excretion and urea handling by fish gills: Present understanding and future research challenges[J]. Journal of Experimental Zoology, 2002,293: 284-301.
[27] Wilson J M, Iwata K, Iwama G K. Inhibition of ammonia excretion and production in rainbow trout during severe alkaline exposure[J]. Comparative Biochemistry and Physiology, 1998, 121: 99-109.
[28] Harris J O, Maguire G B, Edwards S, et al. Effect of ammonia on the growth rate and oxygen consumption of juvenile greenlip abalone, Haliotis laevigata Donovan[J]. Aquaculture, 1998, 160: 259-272.
Ammonia effects the survival and the energy budget of clam Meretrix meretrix
CHEN Jin-feng, HUANG He-zhong, XU Han-fu, HE Hua-min, FAN Wan-su,DING Fei-fei
(Institute of Life Science, Suzhou University, Fisheries Research Institute of Suzhou University, Suzhou 215123,China)
May., 24, 2008
Meretrix meretrix ; ammonia stress ; safe concentration(SC) ; energy budget; scope for growth(SFG)
How ammonia affects the survival and the energy budget of clam Meretrix meretrix was studied. Under the conditions of (24.5 ± 0.5 )℃, 21.5 ‰ and pH 8.00, the mortality of M. meretrix with the shell length of 3.85 ~4.35cm significantly increased with increasing ammonia concentrations and stress durations (P <0.05).The relationship between 96 h mortality of M. meretrix and the concentration logarithm of ammonia could be expressed by Y=2.378 7x+0.324 6 (R2=0.978 9), where x is the concentration logarithm of ammonia, Y is 96 h the mortality of M.meretrix.The safe concentration of ammonia at the 96 h treatment was 9.237 mg/L,NH3-Nt(0.418 mg/L,NH3-Nm).When M. meretrix was exposed to ammonia ranging from 0 to 36 mg/L, the ingested energy decreased; and the respiration energy reached peak value at 9 mg/L and began to decrease at 18 mg/L; and excretion energy reached a maximal value at 4 mg/L then began to decrease at 9 mg/L .There was no significant effect on the growth of M.Meretri in the presence of ammonia below 2 mg/L, NH3-Nt(0.090 mg/L, NH3-Nm); but significant effect was observed when M. meretrix was exposed to ammonia of 4 mg/L,NH3-Nt(0.181 mg/L,NH3-Nm)( P<0.05). Therefore,the level of ammonia in the environment of the clam M. meretrix aquaculture should be controlled below 2 mg/L ,NH3-Ntor 0.090 mg/L, NH3-Nm.
Q493
A
1000-3096(2010)03-0040-07文蛤(Meretrix meretrix)俗称天下第一鲜, 不但肉味鲜美, 而且营养丰富, 具有诸多保健功能, 深受国内外消费者的喜爱, 是中国重要的经济贝类和大宗鲜活出口水产品。近年来, 随着国内外对文蛤需求量的急剧上升, 中国各地的文蛤增养殖面积和养殖密度不断扩大, 但文蛤大量死亡的现象也频繁发生,
2008-05-24;
2008-08-17
江苏近海海洋综合调查与评价项目(JS908)
陈金凤(1984-), 女, 江苏常州人, 硕士研究生, 主要从事水生生物生理生态学研究, E-mail: cjf-03-2@163.com; 黄鹤忠, 通信作者, 副教授, 硕士生导师, 电话: 0512-62276802. E-mail: suda-shui@163.com
(本文编辑: 梁德海)

