应用二温式PCR检测诊断爱德华氏菌病
邓显文, 谢芝勋, 刘加波, 庞耀珊, 谢志勤, 谢丽基, 董建宝
(广西兽医研究所, 广西 南宁530001)
应用二温式PCR检测诊断爱德华氏菌病
邓显文, 谢芝勋, 刘加波, 庞耀珊, 谢志勤, 谢丽基, 董建宝
(广西兽医研究所, 广西 南宁530001)
根据爱德华氏菌(Edwardsiella)的16S rDNA基因序列设计一对特异性引物, 用二温式PCR对6株爱德华氏菌均扩增出与预期大小相一致的576 bp产物, 而对嗜水气单胞菌(Aeromonas hydrophila)、温和气单胞菌(Aeromonas sobria)、荧光假单胞菌(Pseudcmonas fluoroscercs)、柱状屈挠杆菌(Cytophaga columnaris)、链球菌(Streptococcus)、葡萄球菌(Staphylococci)、弧菌(Vibrio)、大肠杆菌(Escherichia colibacillus)和沙门氏菌(Salmonella)等10种病原体的扩增, 结果全为阴性。该二温式PCR可以检测到1 pg的爱德华氏菌DNA模板和48个菌体。本实验建立的二温式PCR为爱德华氏菌病的早期诊断与有效的防治提供了快速检测方法, 对水产品的食品安全有重要的意义。
爱德华氏菌(Edwardsiella); 二温式PCR; 检测
爱德华氏菌(Edwardsiella)是目前在水产养殖中有极大危害的病原菌,在已知爱德华氏菌属(Edwardsiella Ewing and Mcwhorter 1965)中, 记述有迟钝爱德华氏菌(Edwardsiella tarda)、鲇鱼爱德华氏菌(Edwardsiella ictalur)和保科爱德华氏菌(Edwardsiella hoshinae)共3个种[1]。爱德华氏菌所引起的鱼类传染病不仅具有流行广、发病率及死亡率高等特点, 而且能引起多种鱼类感染发病[2],同时由于集约化养殖, 导致鱼类爱德华氏菌病等病害发生增多,已引起水产养殖业的高度重视。目前, 爱德华氏菌病原分离培养、血清学检测等传统方法都无法快速检测鉴别爱德华氏菌, 不能适应规模化养殖的需要, 因此应用特异、快速、敏感的聚合酶链反应式(PCR)检测爱德华氏菌技术就显得非常重要。本实验根据爱德华氏菌的16S rDNA基因序列, 设计1对特异性引物, 建立了二温式 PCR快速检测诊断爱德华氏菌的方法,现将结果报告如下。
1 材料与方法
1.1 菌株
草鱼嗜水气单胞菌(H5)、温和气单胞菌(0392)、荧光假单胞菌(武汉大学)、柱状嗜纤维菌(03135)、欧曼迟缓爱德华氏菌(03134) 均从中国农业部动植物病原库购买; 罗非鱼迟缓爱德华氏菌(Etgx0601)[3],斑点叉尾迟缓爱德华氏菌(Etgx0704)、斑点叉尾鲇鱼爱德华氏菌(Eigx0501, Eigx0602,Eigx0703)[4]、罗非鱼嗜水气单胞菌(AGX1,AGX4)[5]、链球菌、河弧菌、大肠杆菌、葡萄球菌、沙门氏菌由本室分离鉴定并保存。
1.2 试剂与仪器
PCR试剂盒PMD18-T试剂盒购自大连宝生生物技术有限公司; 100 bp DNA ladder购自北京天为时代科技有限公司; DNA片断回收试剂盒购自BioDev公司; PCR仪购自美国Perkin Elmer Cetus公司生产的PE9600仪。
引物设计与合成。根据爱德华氏菌株的16S rDNA基因(DQ985469), 设计 1对引物 XZE7b,XZE8, 其中XZE7b与16S rDNA基因的38~56位核苷酸相同, XZE8与16S rDNA 基因的613~596位的核苷酸互补。这对引物可扩增出长度为576 bp的DNA片段。并通过 blast验证, 该引物由上海生物工程中心合成, 引物序列如下:
XZE7b: 5′-GCT TGC TTT CTC CGC TGA C-3′XZE8: 5′-CTC TAG CTT GCC AGT CTT-3′
1.3 DNA抽提
将菌株分别接种于LB培养基, 30℃培养24~48 h至变混浊时, 离心收集菌体, 用PBS缓冲液洗涤2次后, 用适当TE缓冲液悬浮沉淀, 参照文献[6]方法抽提其DNA, 对照菌(毒)株的DNA的抽提则按文献[6]方法进行。
1.4 PCR扩增反应体系
在100 μL的反应体系中含: 25 mmol MgCl25 μL,10×PCR buffer 10 μL, 10 mmol dNTP×2 μL, Taq 聚合酶5单位0.5 μL, 上游引物和下游引物各300 μg,模板各 5 μL。
1.5 PCR各反应条件的优化
以爱德华氏菌株培养物抽提的DNA为模板, 对PCR各循环参数和各引物浓度等进行优化, 以确定最佳的PCR模式。
1.6 PCR特异性试验
将已提取的爱德华氏菌、欧曼嗜水气单胞菌、荧光假单胞菌、嗜纤维菌的DNA以及对照菌(毒)株的DNA分别加入到含有XZE7b, XZE8引物的PCR反应体系中进行扩增, 检测其特异性。
1.7 PCR的敏感性
测定Etgx0601爱德华氏菌株模板的DNA含量后, 按10倍递增稀释, 同时加入到最佳的PCR反应体系中进行扩增, 检测其敏感性。取培养好的菌液按10倍递增稀释,从每管中吸取 2 μL稀释菌液直接加入到最佳的 PCR反应体系中进行扩增, 检测其敏感性, 同时从10-6, 10-7倍稀释管中分别取0.1mL进行菌落计数。
1.8 PCR产物的电泳分析及克隆测序
用凝胶回收试剂盒纯化回收PCR产物, 将PCR产物克隆至PMD18-T, 用PCR快速鉴定, 阳性克隆菌送大连宝生生物技术有限公司进行测序。
2 结果
2.1 PCR条件优化
通过对PCR的引物浓度、各反应温度、时间及循环次数等进行优化, 最后确定 PCR中引物的最佳工作浓度分别XZE7b, XZE8各为300 μg; PCR的最佳反应模式为 94℃变性 5 min, 然后进入 94℃变性1 min, 65℃退火 1.5 min的循环, 共进行35个循环,最后再经65℃延伸10 min后, 于4℃结束反应。
2.2 PCR特异性扩增结果
应用该程序对爱德华氏菌株DNA及对照菌毒株DNA分种类进行病原体(嗜水气单胞菌、荧光假单胞菌、嗜纤维菌、链球菌、 河弧菌)的 PCR扩增, 结果爱德华氏菌株只扩增出576 bp一条带, 而其他对照菌毒株均未出现任何扩增条带, 爱德华氏菌 PCR特异性试验结果见图1。
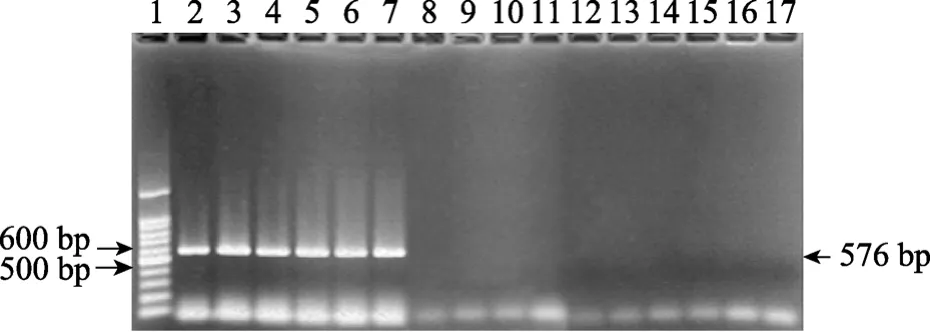
图1 爱德华氏菌PCR特异性试验Fig. 1 PCR specifically amplifies the target Edwardsiella DNA1.100 bp DNA ladder; 2. 欧鳗迟缓爱德华氏菌; 3. 罗非鱼迟缓爱德华氏菌; 4~6.斑点叉尾鲇鱼爱德华氏菌; 7. 斑点叉尾迟缓爱德华氏菌; 8. 温和气单胞菌; 9. 荧光假单胞菌; 10. 柱状嗜纤维菌; 11. 链球菌; 12, 13. 罗非鱼嗜水气单胞菌; 14. 弧菌;15. 大肠杆菌; 16. 沙门氏菌; 17.葡萄球菌1.100 bp DNA ladder; 2. Edwarsiella tarda in European eels (Anguillia anguillia); 3. Etgx0601; 4~6. Eigx0501, Eigx0602, Eigx0703;7. Etgx0704; 8. Aeromonas sobria; 9. Pseudcmonas fluoroscercs;10. Cytophaga columnaris; 11. Streptococcus; 12,13. AGX1, AGX4;14. Vibrio; 15. Escherichia colibacillus; 16. Salmonella; 17. Staphylococci
2.3 PCR的敏感性扩增结果
爱德华氏菌PCR的敏感性试验结果及菌体敏感性试验结果分别见图 2和图 3。经过敏感性测定,PCR最低能检出1pg 爱德华氏菌株DNA模板(图2);经10-7倍稀释管中取0.1mL进行菌落计数为24个菌落, 即每毫升原菌液中含 2.4×109个菌, PCR最低能检出48个菌体(图3)。
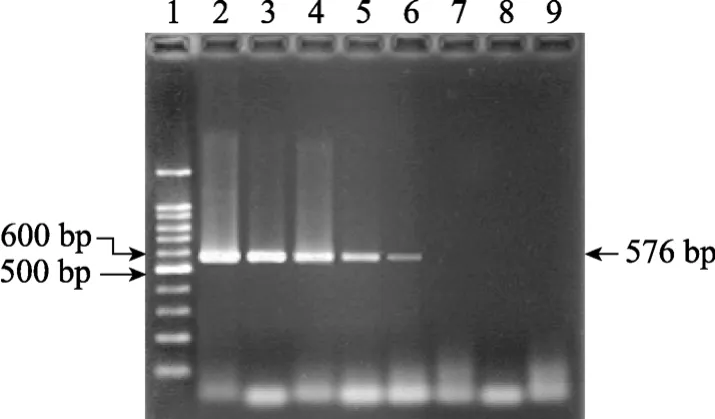
图2 爱德华氏菌PCR的敏感性试验Fig. 2 Detection limit of Edwardsiella DNA by PCR1. 100 bp DNA ladder; 2. 10 ng; 3. 1 ng; 4. 100 pg; 5. 10 pg; 6. 1 pg;7. 100 fg; 8. 10 fg; 9. 1 fg
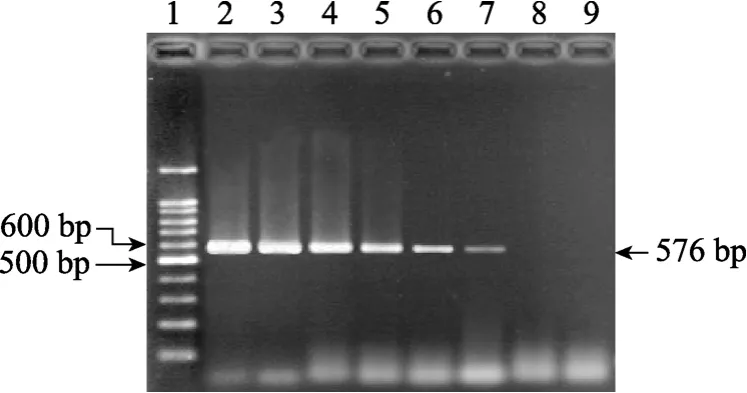
图3 爱德华氏菌PCR的菌体敏感性试验Fig. 3 Detection limit of Edwardsiella by PCR 1. 100 bp DNA ladder; 2. 4.8×106个菌; 3. 4.8×105个菌; 4. 4.8×104个菌; 5. 4.8×103个菌; 6. 4.8×102个菌; 7. 4.8×10个菌; 8. 4.8个菌; 9. 0个菌1. 100 bp DNA ladder; 2. 4.8×106 bacteria; 3. 4.8×105 bacteria;4. 4.8×104 bacteria; 5. 4.8×103 bacteria; 6. 4.8×102 bacteria;7. 4.8×10 bacteria; 8. 4.8 bacteria; 9. 0 bacteria
2.4 测序结果与序列分析
经测序与序列Blast比对分析, 证明了PCR扩增产物与设计大小 576 bp 相符, DNA序列与引物设计模板(DQ985469)16S rDNA基因对应片段的同源性为100%。
3 讨论
鱼类集约化养殖导致鱼类爱德华氏菌病等病害增多, 迟钝爱德华氏菌还是一种重要的人畜共患病的病原菌, 是爱德华氏菌属中唯一感染人的菌种[7]。人们通过接触带有迟钝爱德华氏菌的动物或水产品甚至观赏性鱼类都有可能受到感染[8]。目前, 鱼类爱德华氏菌的传统诊断方法包括病原分离培养和血清学检测等方法, 但这些传统方法都无法快速鉴别爱德华氏菌, 不能适应规模化养殖的需要。因此本试验建立的能简便、快速、特异、敏感地检测鉴定爱德华氏菌, 便于在渔业生产中推广应用的二温式 PCR,对于在鱼类爱德华氏菌病的发病早期提供准确的诊断结果, 切断其传播途径有重要意义。
本试验设计针对爱德华氏菌株 16S rDNA基因序列保守区域的 1对引物对鱼类爱德华氏菌分离株进行二温式PCR扩增结果均能扩增出与设计大小相符的576 bp条带, 该片断测序结果与原参照序列基因组成一致, 而该PCR对其他10种病原体则均不能扩增出任何条带, 说明本研究设计的引物对爱德华氏菌株DNA的扩增是特异的。该二温式PCR的敏感性最低可检测到1 pg的鱼类爱德华氏菌株总DNA,用菌液直接加入到PCR反应体系中进行扩增最低能检出 48个菌体, 如此高的特异性和敏感性, 提示该技术不但可以用于对该病的诊断, 也可用于表面健康的带毒鱼的检疫和感染初期或潜伏期的鱼的检测及环境监测。研究表明该方法可以有效地预防和治疗鱼类的爱德华氏菌病,以确保鱼类养殖的健康持续发展。
[1] Holt J G, Krien N R, Sneath P H A,et al.Berney's manual of determinative bacteriology [M]. Ninth Edition. Baltimore: Williams & Wilkins, 1994. 178,204, 225.
[2] 陈翠珍. 爱德华氏菌及鱼类爱德华氏菌病[J]. 河北科技师范学院学报, 2004, 18(3): 70-76.
[3] 邓显文, 谢芝勋, 刘加波, 等. 罗非鱼迟缓爱德华氏菌病的分离鉴定[J]. 水生态学杂志, 2009, 2(1):114-117.
[4] 邓显文, 谢芝勋, 刘加波, 等. 广西斑点叉尾爱德华氏菌的分离鉴定[J]. 广西农业科学, 2008, 39(2):231-235.
[5] 刘加波, 谢芝勋, 邓显文,等. 罗非鱼嗜水气单胞菌的分离鉴定[J]. 水利渔业, 2006, 26(4): 100-103.
[6] Xie Zhixun, Fadl A A, Theodore G,et al. Detection of avian adenovirus by polymerase chain reaction [J].Avian Diseases, 1999, 43: 98-105.
[7] 郑大海, 麦康森. 迟钝爱德华氏菌(Edwardsiellatarda)研究概况[J]. 海洋湖沼通报, 2004, 1: 52-59.
[8] 陆承平. 致病性迟钝爱德华氏菌的检测及其胞外产物的免疫效果评价[J]. 鱼类病害研究, 2001, 23(3-4): 55-56.
Detection of Edwardsiella by two-temperature PCR
DENG Xian-wen, XIE Zhi-xun, LIU Jia-bo, PANG Yao-shan ,XIE Zhi-qin, XIE Li-ji,DONG Jian-bao
(Guangxi Veterinary Research Institute, Nanning, 530001, China)
Dec., 26, 2007
Edwardsiella; two-temperature PCR; detection
One pair of primers were designed and synthesized according to the published sequence of the 16S rDNA of Edwardsiella. A two-temperature polymerase chain reaction method was developed for detection of Edwardsiella. DNAs isolated from six Edwardsiella strains were amplified by the two-temperature PCR, leading to the PCR products of 576 bp. But the other 10 pathogens, such as Aermonas hydrophila, Aermons sobria, Pseudomonas fluorescens, Cytophaga columnaris, Streptococcus, Staphylococci, Vibrio, Escherichia colibacillus and Salmonella,failed to show any positive results. It was found that as little as 1 pg of Edwardsiella DNA and 48 bacteria were sufficient to be detected by this method. This two-temperature PCR provides a rapid diagnostic method for early identification and control of Edwardsiella in the field of aquatic food safety.
Q789
A
1000-3096(2010)03-0032-03
2007-12-26;
2009-07-09
广西省科技攻关项目(0428001-2)
邓显文(1963-), 男, 广西贺州人, 副研究员,学士, 主要从事动物分子生物学研究; 谢芝勋, 通信作者, E-mail: Xiezhixun@126.com
(本文编辑: 刘珊珊)

