HIF-1α转染骨骼肌细胞的诱导产物VEGF对血管内皮细胞增殖的影响
陈 博,陈剑秋
(天津医科大学第二医院普通外科,天津 300211)
缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)是Semenza[1]最先于1992年在研究缺氧诱导的红细胞生成素基因表达时被发现的,HIF-1是以异源二聚体蛋白的形式存在,由HIF-1α与HIF-1β两个亚单位组成,其中HIF-1α氧依赖性较强,当周围氧浓度下降时,HIF-1α表达增加,HIF-1β氧依赖性较弱,表达恒定,但在HIF-1中也必不可少,只有在两个亚单位聚合并且发生适形变化后,与其要调节的下游因子或酶的缺氧反应元件(hypoxia response element,HRE)结合时才能发挥调节作用,调节下游基因的表达,其中包括与血管形成相关的众多基因,是组织缺血时重要的调节因子。本实验以含HIF-1α质粒体外转染骨骼肌细胞,观察细胞培养液中血管内皮生长因子(VEGF)蛋白的分泌,及其表达产物对体外培养的血管内皮细胞的促增殖作用,为进一步向缺血组织内注射含HIF-1α质粒治疗缺血性疾病提供体外实验依据。
1 材料与方法
1.1 动物和试剂 Wistar乳鼠(出生3 d内)及大鼠(120 g)购自中国军事医学科学院动物实验中心。质粒 pHOX-EF1α-GFP(pHOX,8686 bp) 和 pHOXEF1α-HIF-1α-IRES-GFP(pHOX/HIF-1α,11360 bp)由瑞典Karolinska大学王丰博士惠赠;小鼠抗人横纹肌肌动蛋白单克隆抗体(ZM-0002)、小鼠抗人结蛋白单克隆抗体(ZM-0091)、兔抗人八因子相关抗原(FaⅧ)、FITC标记的羊抗兔Ig G抗体、罗丹明标记抗小鼠IgG购自北京中杉金桥科技有限公司;GENMED细胞核染色试剂盒购自上海杰美基因医药科技有限公司;大鼠VEGF(r)Elisa检测试剂盒购自武汉博士德公司;LipofectamineTM2000购自Invitrogen公司。
1.2 方法
1.2.1 大鼠骨骼肌细胞的分离、培养及鉴定 乳鼠颈椎脱位法处死,无菌状态下取双侧大腿肌肉组织剪碎,加入0.25%胰蛋白酶,37℃、100 r/min振荡消化5次,每次10min;吸取上清液,移入预加5ml含20%FBS的DMEM培养液15ml的离心管中并混匀;室温下离心(1 000 r/min,5min),弃上清液,重悬细胞,经100目不锈钢细胞筛过滤后转移至培养瓶内置细胞培养箱内培养,每3 d全量换液;倒置相差显微镜下观察细胞形态,并通过中间丝结蛋白免疫组化法、α-横纹肌肌动蛋白免疫细胞化学法及透射电镜法鉴定骨骼肌细胞。
1.2.2 大鼠主动脉内皮细胞的培养及鉴定 颈椎脱位法处死大鼠,无菌状态下取出胸腹主动脉,剥除外膜,切成1mm2大小组织块,内膜面朝下以1块/cm2的间距铺于培养瓶底;细胞培养箱内静置贴壁2 h后加入10ml含20%FBS的RPMI1640培养基进行培养,每3 d全量换液;倒置相差显微镜下观察细胞形态,第Ⅷ因子相关抗原免疫细胞化学染色鉴定内皮细胞。
1.2.3 pHOX/HIF-1α转染骨骼肌细胞后诱导分泌VEGF的测定 实验共分为3组:质粒(pHOX/HIF-1α)转染组、空载质粒(pHOX)转染组及空白对照(DMEM)组;转染前1d将骨骼肌细胞以1.5×105/孔的密度接种到24孔板。1∶1将LipofectamineTM2000及质粒混匀,质粒1μg加入培养孔,对照组加入相同体积 DMEM,分别于转染后 24、48、72、96 h 收集各孔中培养上清液,离心后以VEGF(r)ELISA检测试剂盒测量其中VEGF浓度,各组每个时间点测6孔。
1.2.4 产物VEGF对血管内皮细胞增殖的影响 取3~5代血管内皮细胞,每孔5×103密度接种于96孔板内。实验组分别加入转染后骨骼肌细胞分泌的含VEGF 10、25、50、100 pg(根据ELISA 结果计算加入体积)培养液上清,以DMEM补至200μl;对照组加入DMEM 200μl。分别于培养后第24、48、72 h去除培养液,按MTT法于490 nm处测吸光度(A)值,各组每个时间点测6孔。
2 结果
2.1 骨骼肌细胞原代培养及鉴定 刚分离出来的细胞呈圆形,24 h后细胞完全贴壁,细胞开始逐渐变大呈梭形,具有良好的折光性(图1a)。培养约50 h后,细胞进入快速融合期,可见多个细胞融合成多核的肌管细胞,体积约为未融合细胞的3~5倍,核有数个至十几个不等(图1b)。培养3~5 d后肌管数目明显增多,相互连接成网状,并可见肌管细胞的短暂收缩现象。中间丝结蛋白免疫细胞化学检测:70%~80%的细胞胞质呈阳性反应(图1c)。α-横纹肌肌动蛋白免疫细胞化学法检测:阳性细胞在荧光激发下显示红色荧光(图1d)。电镜鉴定:细胞体积大,直径40~100μl之间,细胞核不规则,胞浆丰富,胞浆中有大量肌丝,同时可见大量次级溶酶体,粗面内质网高度扩张,线粒体丰富,细胞突起多(图1e)。
2.2 血管内皮细胞的原代培养及鉴定 培养3~5 d,动脉植块周围可见细胞生长,呈短梭形或多角形(图2a)。约 8~10 d 细胞融合成片(图 2b),呈单层镶嵌状排列,大小均匀,胞核清晰,呈卵圆形,表现为“铺路石样”排列(图2c)。Ⅷ因子相关抗原免疫细胞化学鉴定:荧光显微镜下可见细胞的胞浆显示为绿色荧光,细胞核为蓝色荧光(图2d)。

2.3 转染后细胞培养上清液中VEGF含量的测定
ELISA法检测转染后细胞培养上清液中VEGF含量的测定结果见表1。可见转染后各时间点转染(pHOX/HIF-1α)组明显高于相同时间点的空载质粒转染(pHOX)组和空白对照(DMEM)组(P<0.05),而后两者则无明显区别。
表1 ELISA法检测转染后细胞上清液中VEGF 含量(pg/m l,)(n=6)
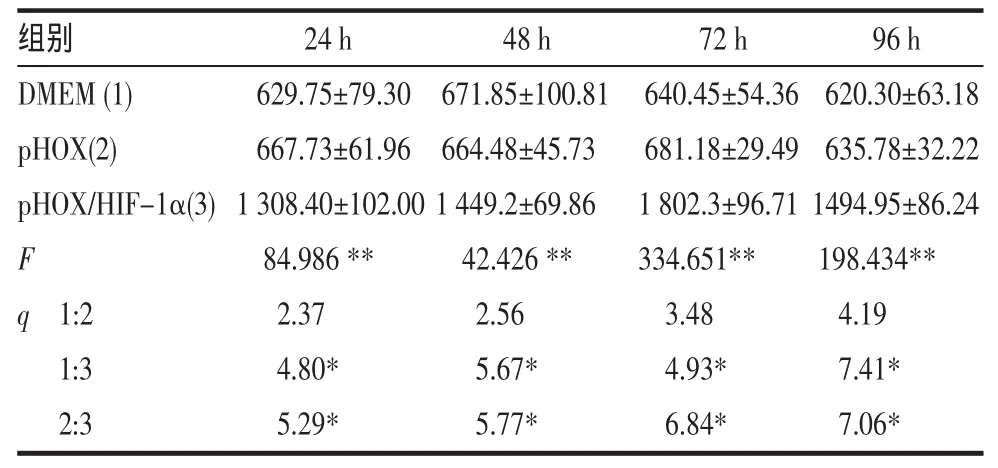
表1 ELISA法检测转染后细胞上清液中VEGF 含量(pg/m l,)(n=6)
与对照组比较*P<0.05,**P<0.01
24h 629.75±79.30 667.73±61.96 1308.40±102.00 84.986**2.37 4.80*5.29*72 h 640.45±54.36 681.18±29.49 1 802.3±96.71 334.651**3.48 4.93*6.84*48h 671.85±100.81 664.48±45.73 1449.2±69.86 42.426**2.56 5.67*5.77*组别DMEM(1)pHOX(2)pHOX/HIF-1α(3)F q 1:2 1:3 2:3 96h 620.30±63.18 635.78±32.22 1494.95±86.24 198.434**4.19 7.41*7.06*
2.4 MTT比色法检测转染后上清液中VEGF对内皮细胞增殖的影响 在加入MTT并培养后各组吸光度值测量结果见表2。加入VEGF 24 h后,10 pg组促增殖作用不明显,而25、50、100 pg组内皮增殖明显加快,与对照组相比P<0.05。加入后48、72 h,各剂量组与对照组比较能显著刺激血管内皮细胞增殖,并且各不同剂量组之间差别有统计学意义(P<0.05)。结果显示转染后细胞培养上清液中的VEGF能有效地促进原代培养内皮细胞的增殖。
表2 加入不同浓度VEGF培养血管内皮后的吸光度值(n=6, )
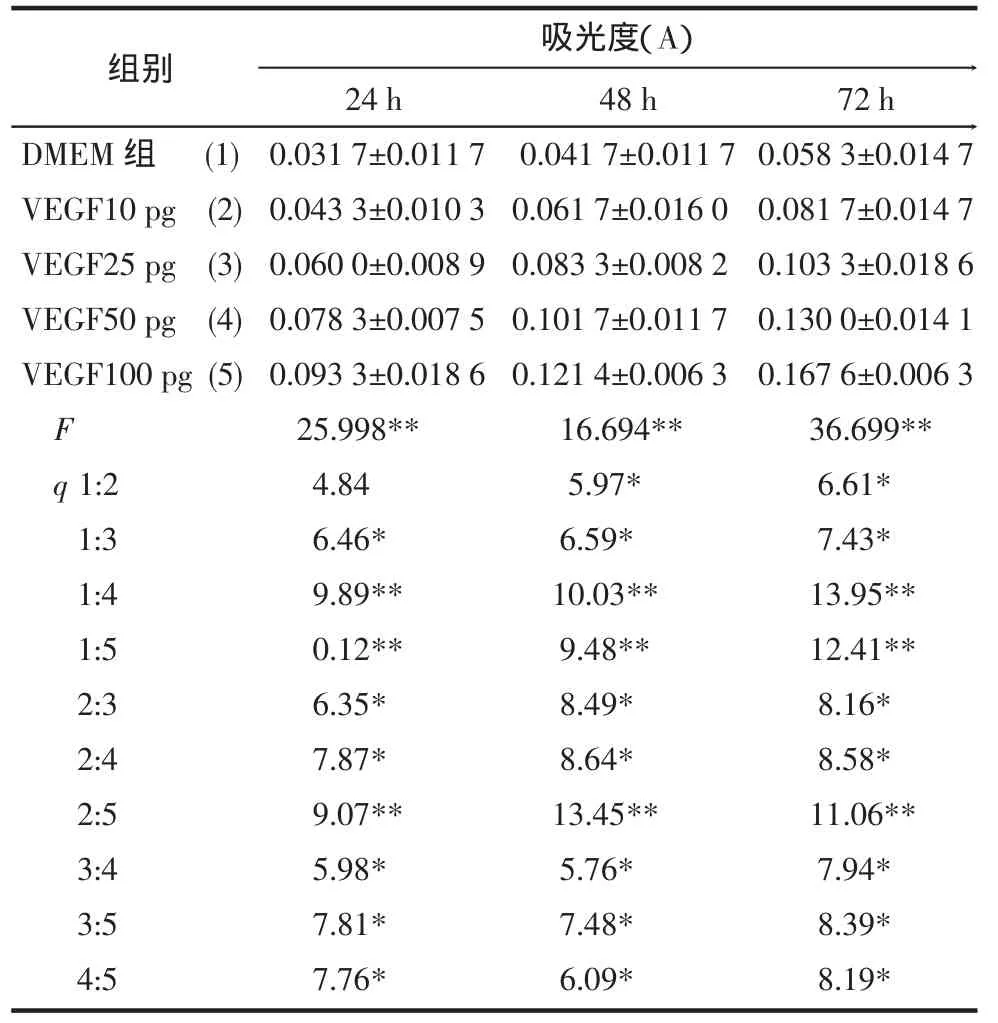
表2 加入不同浓度VEGF培养血管内皮后的吸光度值(n=6, )
与对照组比较*P<0.05,**P<0.01
48 h 0.041 7±0.011 7 0.061 7±0.016 0 0.083 3±0.008 2 0.101 7±0.011 7 0.121 4±0.006 3 16.694**5.97*6.59*10.03**9.48**8.49*8.64*13.45**5.76*7.48*6.09*24 h 0.031 7±0.011 7 0.043 3±0.010 3 0.060 0±0.008 9 0.078 3±0.007 5 0.093 3±0.018 6 25.998**4.84 6.46*9.89**0.12**6.35*7.87*9.07**5.98*7.81*7.76*72 h 0.058 3±0.014 7 0.081 7±0.014 7 0.103 3±0.018 6 0.130 0±0.014 1 0.167 6±0.006 3 36.699**6.61*7.43*13.95**12.41**8.16*8.58*11.06**7.94*8.39*8.19*DMEM组 (1)VEGF10 pg (2)VEGF25 pg (3)VEGF50 pg (4)VEGF100 pg(5)F q 1:2 1:3 1:4 1:5 2:3 2:4 2:5 3:4 3:5 4:5组别 吸光度(A)
3 讨论
HIF-1通过调控其下游基因的表达来实现其功能,HIF-1做为转录因子,目前已知的受其调控的基因已超过60种[3],涉及到细胞的代谢、自分泌、氧稳态、能量维持及增生等方面。目前进行研究较多的HIF-1的靶基因主要包括以下种类:促红细胞生成素(EPO);VEGF,内皮素-1(endothelin-1);葡萄糖转运子-1(glucose transporter-1,GLUT-1)、葡萄糖转运子-3(glucose transporter-3,GLUT-3)和糖酵解酶等。其中许多在缺血组织的新血管形成过程中发挥重要作用。
现在研究已经明确HIF-l对于VEGF的调控主要是通过作用于VEGF基因转录起始点上游大约1kb的5′侧翼区域-28bp的HRE来实现的,VEGF基因的 HIF-1结合点序列为 5′-CACAG-3′和 5′-ATCGTGGG-3′。HIF-1结合点和上游的激活蛋白-1(activator protein l,AP-1)结合点共同构成 HRE。HIF-1可与VEGF的DNA相结合,激活HIF-1α羧基端转录激活区,从而加强HIF-1α羧基端与P300/CBP的结合力,将转录信号传递给RNA序列,发挥其转录活性[4]。此外也有研究表明HIF-1α能诱导VEGF受体Flt-1的表达[5],Flt-1表达增高使得VEGF的效应得到放大。同时研究发现低到中等水平表达VEGF的成肌细胞能诱导生成结构正常的毛细血管网,而高水平表达的成肌细胞移植后则诱导血管瘤的生成,导致肌肉严重水肿并加速缺血肢体的坏死[6]。因此在VEGF诱导新生血管治疗缺血性疾病时,控制VEGF的表达水平具有重要意义。而由于HIF-1α在正常氧浓度下迅速降解的特点使其有可能避免VEGF在局部过度表达的危险:当局部缺氧时HIF-1α局部积聚,可以诱导VEGF表达增加,而一旦局部的氧供应充足,则HIF-1α会迅速降解,失去对VEGF的诱导作用,使局部VEGF不会产生过量表达。
在本实验中通过LipofectamineTM 2000阳离子脂质体介导将pHOX/HIF-lα质粒转染原代培养的大鼠骨骼肌细胞,然后检测细胞培养上清中VEGF 的含量, 转染 HIF-lα24、48、72、96 h 后 VEGF蛋白的量分别为(1 308.40±102)、(1 449.20±69.86)、(1 802.30±96.71)和(1 494.95±86.24)pg/ml,明显高于相同时间点的空载质粒(pHOX)组和DMEM组(P<0.05),后两组则无统计学差别,证明了HIF-1α转染骨骼肌细胞后可以诱导VEGF高表达。进一步的实验表明加入含VEGF的转染后细胞培养上清液后,除24 h、10 pg组外各组的吸光度值均较对照组增加,表现出明显的促内皮细胞增殖作用,且呈明显的剂量依赖效应(各剂量组间比较P<0.05)。其中24 h、10 pg组与对照组无明显差别的原因可能是VEGF剂量小且作用时间较短所致。
本实验的最终设想是通过对缺血组织局部注射含HIF-1α的质粒来促进局部的血管形成,改善局部缺血症状,现已证实将外源性含HIF-1α质粒成功转染体外培养骨骼肌细胞后可以诱导VEGF高表达,且转染后细胞培养上清液含有的VEGF对内皮细胞具有明显的促增殖作用,表明其诱导骨骼肌细胞合成的VEGF有正常功能。但本实验是在相对简单的体外环境中完成,对于在环境更为复杂的在体情况下将质粒转染骨骼肌细胞后所能发挥的作用尚需进一步研究。
[1]SemenzaGL,WangGL.A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer ata site required fortranscriptional activation [J].Mol Cell Biol,1992,12(12):5447
[2]Iyer NV,Leung SW,Semenza GL,et al.The human hypoxia-inducible factor 1alphagene:HIF-1α structureand evolutionary conservation[J].Genomics,1998,52(2):159
[3]SemenzaGL.Targeting HIF-1 for cancer therapy[J].NatRev Cancer,2003,3(10):721
[4]Kalio PJ,Okamoto K,O’Brien S,et al.Signal transduction in hypoxic cells:inducible nuclear translocation and recuitment of the CBP/p300 coactivator by the hypoxia-inducible factorr-1 alpha[J].EMBOJ,1998,17(22):6573
[5]Manalo DJ,Rowan A,Lavoie T,etal.Transcriptional regulation of vascular endothelial cell responses tohypoxiaby HIF-1[J].B1ood,2005,105(2):659
[6]Masaki I,Yonemitsu Y,Yamashita A,etal.Angiogenic gene therapy for experimental critical limb ischemia:acceleration of limb loss by over expression of vascular endothelial growth factor but not of fibroblastgrowth factor-2[J].Circ Res,2002,90(9):966

