双重PCR方法检测沙门氏菌和空肠弯曲菌
陈 诺,唐善虎,*,陈进会,岑璐伽,李 雪,龙 虎
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.东莞出入境检验检疫局,广东 东莞 523072)
双重PCR方法检测沙门氏菌和空肠弯曲菌
陈 诺1,唐善虎1,*,陈进会2,岑璐伽1,李 雪1,龙 虎1
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.东莞出入境检验检疫局,广东 东莞 523072)
为建立能够同时检测食品中沙门氏菌和空肠弯曲菌的双重PCR方法。采用沙门氏菌鞭毛基因fimY和空肠弯曲菌马尿酸酶基因hipO设计特异性引物,并对影响PCR扩增的主要因素——引物浓度、退火温度、Mg2+浓度因素进行优化,比较单一PCR和双重PCR的检测效果。结果表明:采用单一PCR法检测沙门氏菌和空肠弯曲菌时,灵敏度分别可达到3.98pg和4.05pg;而采用双重PCR检测时,灵敏度较单一PCR法有所下降,沙门氏菌和空肠弯曲菌检出限量分别为398pg和40.5pg。本研究建立的特异性强和灵敏度高的双重PCR检测方法,可为实现食品中沙门氏菌和空肠弯曲菌的同时检测提供新方法。
沙门氏菌;空肠弯曲菌;双重PCR;检测
Abstract:A rapid assay for simultaneous detection ofSalmonella sppandCampylobacter jejuniin food was developed. The primers were designed based on thefimYgene ofSalmonellaspp andhipOgene ofCampylobacter jejuni. Annealing temperatures,Mg2+concentrations, and primer concentrations were optimized. The detection limit was 3.98 pg forSalmonellaspp and 4.05 pg forCampylobacter jejuniusing the single PCR method. However, the detection limit of the duplex PCR method was significantly higher, which was 398 pg, 40.5 pg forSalmonellaspp andCampylobacter jejuni, respectively. In this study, a duplex PCR with high specificity and sensitivity was developed and it would provide useful information for the simultaneous detection ofSalmonellaspp andCampylobacter jejuniin food.
Key words:Salmonellaspp;Campylobacter jejuni;Duplex PCR;Detection
沙门氏菌和空肠弯曲菌是常见的重要食源性致病菌,常污染肉、乳和禽等动物性食品。污染的食品引起腹泻、呕吐等急性肠胃炎症状,严重的可引起死亡[1]。此外,空肠弯曲菌的感染与人的格林-巴氏综合症等具有自身免疫特性的疾病有关[2]。
对这两种致病菌的检测通常采取传统的方法,先选择性增菌,然后作生化试验和血清学鉴定,大约需要3~14d获得检测结果。由于沙门氏菌血清型繁多、污染食品时数量少,并且易受食品成分及食品深加工等影响,若采用常规方法检测沙门氏菌难度较大,容易出现错检和漏检。而对空肠弯曲菌的检测方法,普遍采用快速马尿酸酶试验[3]。由于空肠弯曲菌分类复杂、生长条件苛刻、生化检测不可靠,传统方法都存在着不同程度的假阴性率、假阳性率现象[4]。采用多重PCR技术可以很好地解决这些问题,多重PCR技术具有特异性强、灵敏度高、操作简便和成本低等优点,已经广泛地应用于沙门氏菌和空肠弯曲菌的检测。在沙门氏菌检测时,采用的靶点主要有invA、fimA、stn、hilA等基因[5],而空肠弯曲菌检测的基因主要有mapA、hipO和ceuE等基因[3],并且大多数研究主要针对单个菌进行的,尚未见使用双重PCR同时检测食品中沙门氏菌和空肠弯曲菌的研究报道。因此,本研究以沙门氏菌保守的鞭毛基因fimY和空肠弯曲菌马尿酸酶基因hipO为目的基因设计特异性引物,建立同时能够检测出沙门氏菌和空肠弯曲菌的双重PCR方法,并通过优化双重PCR的条件提高双重PCR检测的灵敏度。
1 材料与方法
1.1 材料、试剂与仪器
沙门氏菌C79-13、46株沙门氏菌初步分离菌株、空肠弯曲菌ATCC33560、金黄色葡萄球菌ATCC25923、大肠杆菌ATCC25922由本实验室保存,沙门氏菌、志贺氏菌由本实验室分离保存,单核细胞增生性李斯特菌由东莞出入境检验检疫局惠赠。沙门氏菌、空肠弯曲菌培养基配制及增菌参考国标GB/T 4789.4—2008[6]和GB/T 4789.9—2008[7],其余菌株均接种营养琼脂培养基,37℃培养18h备用。
TaqDNA聚合酶(5U/μL)、10×PCR Buffer(Mg2+free)、MgCl2(25mmol/L)、dNTP Mixture(各 2.5mmol/L)、100bp DNA ladder Marker 大连宝生物工程有限公司;GOLD-VIEWTM染料和琼脂糖 上海赛百盛基因技术有限公司。
PCR扩增仪 Eppendorf公司;核酸蛋白检测仪Beckman公司;改良Skirrow氏琼脂培养基、SS琼脂培养基 杭州微生物试剂有限公司。
1.2 方法
1.2.1 模板DNA制备
取沙门氏菌LB增菌液进行10倍倍比稀释,取10-4~10-7四个稀释度菌液涂板,37℃培养24h后平板计数,计数原始菌液浓度。取空肠弯曲菌布氏肉汤培养液,稀释同沙门氏菌稀释,涂改良Skirrow氏血平板,42℃微需氧条件下培养24h后,进行菌落计数。原始菌液中沙门氏菌浓度为1.27×107CFU/mL、空肠弯曲菌浓度为2.12×106CFU/mL。参考黄金林等[8]报道的方法提取细菌基因组D NA,并利用核酸蛋白测定仪测定沙门氏菌DNA质量浓度为39.81μg/mL、空肠弯曲菌的质量浓度为 40.50μg/mL。
1.2.2 引物设计
根据沙门氏菌fimY基因、空肠弯曲菌hipO基因序列,用Primer 5.0软件设计引物,由英潍捷基(上海)贸易有限公司合成。引物序列及产物大小见表1。

表1 引物序列及扩增产物Table 1 Primer sequences and amplified products
1.2.3 单基因PCR扩增及特异性分析
对沙门氏菌C79-13、空肠弯曲菌ATCC33560菌株的基因组DNA分别进行单基因扩增。扩增体系[9]为:10×PCR Buffer 2.5μL、Mg2+1.5mmol/L、dNTP Mixture 200μmol/L,上下游引物各0.4μmol/L、TaqDNA聚合酶1U、模板DNA 1μL,加灭菌去离子水至25μL。扩增条件:94℃预变性5min,94℃变性30s、52℃退火30s、72℃延伸30s共35个循环,最后72℃ 5min。取6μL PCR产物经GOLD-VIEWTM染色,于100V电压下进行30g/L琼脂糖凝胶电泳40min检测。
1.2.4 双重PCR扩增体系
扩增体系为:10×PCR Buffer 2.5μL、Mg2+1.5mmol/L、dNTP Mixture 200μmol/L,两对上下游引物各0.4μmol/L、TaqDNA聚合酶1U、两种模板DNA各1μL,加灭菌去离子水补齐25μL,扩增条件同1.2.3节。
1.2.5 双重PCR扩增条件优化
分别对影响PCR扩增的主要条件引物浓度、退火温度、Mg2+浓度。确定最佳PCR反应体系。
1.2.6 双重PCR特异性与灵敏度分析
取沙门氏菌、空肠弯曲菌、志贺氏菌、单核细胞增生性李斯特菌、金黄色葡萄球菌、用优化好的双重PCR扩增条件进行PCR扩增。将已经测定浓度的沙门氏菌、空肠弯曲菌DNA模板分别作100~10-7梯度稀释,取不同稀释度的模板进行单基因PCR扩增,取相同稀释度的不同模板混合,对不同梯度混合模板用优化好的扩增条件进行双重PCR扩增。
2 结果与分析
2.1 单基因PCR特异性分析
采用沙门氏菌鞭毛基因fimY和空肠弯曲菌基因hipO设计引物,通过在线BLAST程序[10-11]验证两对引物特异性。用设计的引物分别对沙门氏菌、空肠弯曲菌进行单基因PCR扩增,以46株沙门氏菌分离株与常见食源性致病菌单核细胞增生性李斯特菌、金黄色葡萄球菌、志贺氏菌、大肠杆菌等为供试菌株做特异性试验。结果显示46株沙门氏菌均出现423bp扩增条带,其它菌株均无特异性扩增条带。
2.2 双重PCR反应条件优化
将两种DNA模板混合,分别使用不同浓度的单对引物进行PCR扩增,确定一个合适的引物浓度范围,再采用不同引物浓度组合进行双重PCR扩增,结合扩增效果和引物用量,确定最佳引物浓度组合为沙门氏菌0.6μmol/L和空肠弯曲菌为0.4μmol/L,结果见图1。按退火温度一般低于Tm值3~5℃优化原则[12],选择46.2、47.1、48.4、50.1、52、53.1、55.8、57.6、59、60、60.8℃ 11个不同温度进行多重PCR退火温度优化。结果发现50.1~59℃间退火温度的条带最为理想,考虑到退火温度较高可能降低扩增效率,取52℃作为退火温度,结果见图2。在其他最佳条件下,选择Mg2+浓度为0.5~3.0mmol/L,以0.5mmol/L为梯度调整Mg2+浓度,根据结果,再在1.0~3.0mmol/L之间,以0.2mmol/L为梯度调整Mg2+浓度,确定最佳Mg2+浓度为2.0mmol/L,结果见图3。
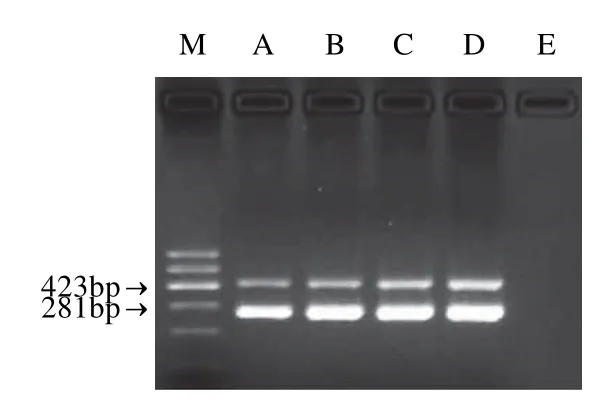
图1 双重PCR不同引物浓度组合电泳图Fig.1 Various primer concentrations and electrophoretic bands from duplex PCR
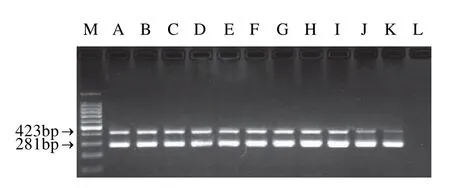
图2 双重PCR不同退火温度电泳图Fig.2 Various annealing temperatures and electrophoretic bands from duplex PCR

图3 双重PCR不同Mg2+浓度电泳图Fig.3 Various Mg2+concentrations and electrophoretic bands from duplex PCR
2.3 双重PCR特异性与敏感性分析
单一PCR和双重PCR扩增结果见图4。单一PCR只出现单一目的条带,混合模板PCR出现两条目的条带,片段大小与设计相符,扩增结果均无非特异性扩增与引物二聚体出现。单一PCR扩增沙门氏菌灵敏度可以达到3.98pg,空肠弯曲菌的灵敏度可达到4.05pg。比较单一PCR扩增结果与双重PCR扩增结果(图5~7),表明双重PCR扩增灵敏度较单一PCR扩增低。在双重PCR扩增结果中,沙门氏菌灵敏度降低两个数量级,为398pg,空肠弯曲菌减少一个数量级,为40.5pg。

图4 双重PCR特异性结果Fig.4 Electrophoresis test for the specificity of duplex PCR
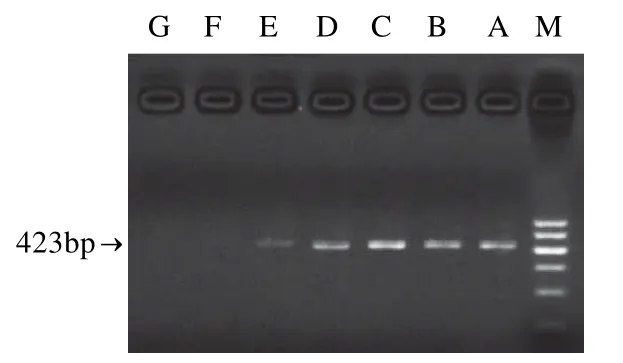
图5 沙门氏菌单基因PCR灵敏度结果Fig.5 Test for the sensitivity of PCR forSalmonellaspp
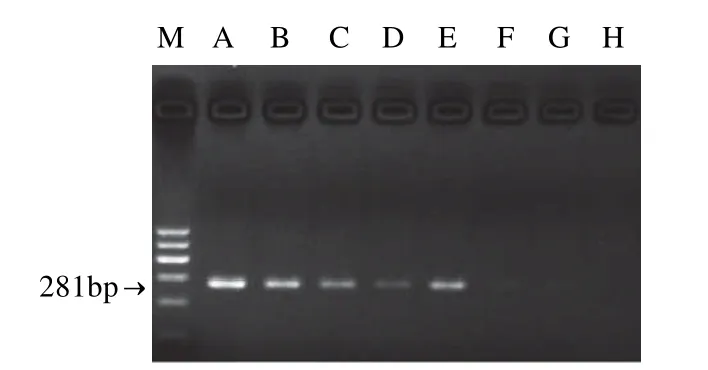
图6 空肠弯曲菌单基因PCR灵敏度结果Fig.6 Test for the sensitivity ofCampylobacter jejuni

图7 双重PCR灵敏度结果Fig.7 Test for the sensitivity of duplex PCR
3 讨 论
随着食品卫生要求的不断提高,快速检测食品微生物在食品安全中的重要性愈加明显。沙门氏菌和空肠弯曲菌是世界范围内食品污染的主要病原菌之一[13]。如何快速检测食品中沙门氏菌和空肠弯曲菌,缩短检测时间,提高检测灵敏度,减少错检、漏检是食品病原微生物检测的重点。用于沙门氏菌检测最常见的靶基因有编码吸附上皮细胞的蛋白基因invA[14]和肠毒素基因stn[15]等,而常用于空肠弯曲菌检测靶基因有mapA、ceuE、flaA等[3]。对于单个基因的PCR方法已有较多报道[16-17],而采用多重PCR对这两种菌进行检测的报道较少[3,18]。本实验采用的是高度保守的fimY基因和hipO基因设计特异性引物,建立了一个快速、同时检测沙门氏菌和空肠弯曲菌的双重PCR方法。
实验中设计的特异性引物用沙门氏菌和空肠弯曲菌标准株、46株沙门氏菌分离株以及金黄色葡萄球菌等其余的9株菌进行特异性检测。受试的46株沙门氏菌均能扩出目的条带,而金黄色葡萄球菌等其余的9株菌无特异性扩增条带,说明试验设计的引物有较高的种间特异性和属间特异性。实验对影响PCR反应的退火温度、引物浓度和Mg2+浓度主要因素进行优化,获得最佳反应体系。在本研究中,发现单一PCR的灵敏度与报道[18]一致,实验建立的双重PCR检测方法检出沙门氏菌和空肠弯曲菌的灵敏分别达到398pg和40.5pg,较单一PCR灵敏度低,但比凌霞等[12]报道的三重PCR检测空肠弯曲菌灵敏度有所提高。在本实验中导致双重PCR灵敏度降低的可能原因是各对引物扩增时存在对底物以及Taq酶等的竞争,降低了扩增产量[19]。本研究基于沙门氏菌fimY基因和空肠弯曲菌的hipO基因建立了特异性强、灵敏度高的双重PCR检测方法,该方法在食品沙门氏菌和空肠弯曲菌的检测中的具有一定的指导意义。
[1] 何国庆, 贾英民. 食品微生物[M]. 北京:中国农业出版社, 2002.
[2] Mc CARTHY N, GIESECKE J. Incidence of Guillain Barre Syndrome following infection withCampylobacter jejuni[J]. Am J Epidemiol,2001, 153(6):610-614.
[3] 吴高林, 乔昕, 袁宝君. 空肠弯曲菌多重PCR快速检测方法建立的研究[J]. 现代预防医学, 2007, 34(2):98-99.
[4] STEPHEN L W O, JORDAN P J. Evaluation of 11 PCR assays for species-level identification ofCampylobacter jejuniandCampylobacter coli[J]. Clin Microbiol, 2003, 41:330-336.
[5] 向雪菲, 刘斌, 张利达, 等. 食品中沙门氏菌分子检测靶点的筛选与评价[J]. 微生物学报, 2008, 48(7):941-946.
[6] GB/T 4789.4—2008 食品微生物检验:沙门氏菌检验[S].
[7] GB/T 4789.9—2008 食品微生物检验:空肠弯曲菌检验[S].
[8] 黄金林, 焦新安, 文其乙, 等. 应用聚合酶链反应快速检测沙门氏菌[J]. 扬州大学学报, 2002, 23(3):5-11.
[9] 魏群. 分子生物学实验指导[M]. 北京:高等教育出版社, 2005.
[10] NCBI. [EB/OL]. [2010-06-10]. http://www.ncbi.nlm.nih.gov/tools/primer-blast/primertool.cgi?ctg_time=1287639280&job_key=JSID_01_28371_130.14.22.21_9000.
[11] NCBI. [EB/OL]. [2010-06-10]. http://www.ncbi.nlm.nih.gov/tools/primer-blast/primertool.cgi?ctg_time=1287640027&job_key=JSID_01_30069_130.14.24.201_9000&Check+Status=Check.
[12] 凌霞, 沙丹, 肖勇, 等. 空肠弯曲菌、单增李斯特菌和大肠杆菌O157多重PCR分子检测研究[J]. 检验医学, 2009, 24(2):101-105.
[13] 胡哲, 王振国, 刘金华, 等. 利用PCR技术检测鸡肉产品中的空肠弯曲杆菌[J]. 吉林农业大学学报, 2005, 27(6):671-674.
[14] RAHN K, GRANDIS S A, CLARKE R C. Amplification of aninvAgene sequence ofSalmonella typhimuriumby polymerase chainreaction as a specific method of detection ofSalmonella[J]. Molecular and Cellular Probes, 1992, 6(4):271-279.
[15] DINJUS U, HANEL I, BAUERFEIND R, et al. Detection of the induction ofSalmonellaenterotoxin gene expression by contact with epithelial cells with RT-PCR[J]. FEMS Microbiol Lett, 1997, 146(2):175-179.
[16] 李鑫, 刘骞. 食源性沙门氏菌快速检测技术[J]. 肉类研究, 2008(10):67-70.
[17] 侯建军, 郝永清, 朱建国, 等. 空肠弯曲杆菌分子生物学检测方法研究进展[J]. 中国畜牧兽医, 2007, 34(11):87-90.
[18] 何蕊, 黄金林, 许海燕, 等. 弯曲菌多重PCR检测方法的建立及其初步应用[J]. 扬州大学学报, 2007, 28(1):5-8.
[19] 邵碧英, 陈彬, 汤敏英, 等. 沙门氏菌多重PCR检测方法的建立[J].食品科学, 2007, 28(10):489-492.
Development of a Duplex PCR for Detection ofSalmonellaspp andCampylobacter jejuniin Food
CHEN Nuo1,TANG Shan-hu1,*,CHEN Jin-hui2,CEN Lu-jia1,LI Xue1,LONG Hu1
(1. College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China;2. Dongguan Inspection and Quarantine Bureau, Dongguan 523072, China)
S855.11
A
1002-6630(2010)22-0403-04
2010-07-06
西南民族大学研究基金项目
陈诺(1984—),女,硕士研究生,研究方向为食品质量与安全。E-mail:cn2003910@163.com
*通信作者:唐善虎(1964—),男,教授,博士,研究方向为食品科学与食品安全。E-mail:stang01@126.com

