耦合Plastein反应的大豆蛋白降压肽酶法制备技术
高 博,赵新淮*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
耦合Plastein反应的大豆蛋白降压肽酶法制备技术
高 博,赵新淮*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
利用碱性蛋白酶酶解大豆分离蛋白,制备出水解度为16.6%的大豆蛋白水解物,随后对水解物进行Plastein反应修饰。利用响应面分析优化修饰反应条件,得到适宜参数:底物质量分数45%、酶添加量275U/g蛋白质、反应时间3~4h、温度30℃。制备修饰反应程度不同的9种修饰产物并评价其体外ACE抑制活性,发现修饰产物的IC50值为0.64~1.30mg/mL,均小于大豆蛋白水解物IC50值(1.45mg/mL)。排阻色谱分析结果确认,修饰产物中有更多的高分子质量肽段存在。结果显示,大豆蛋白的酶解以及耦合Plastein反应修饰,是一种制备高ACE抑制活性大豆蛋白降压肽的新技术。
大豆蛋白水解物;Plastein反应;ACE抑制活性;碱性蛋白酶;排阻色谱
Abstract:Soybean protein hydrolysates (SPHs) with a degree of hydrolysis of 16.6% were prepared by 4 h hydrolysis with alcalase, and then subjected to plastein reaction for modification. Response surface analysis was applied to optimize the conditions for plastein reaction, and the optimal conditions obtained were as following:substrate concentration 45%, enzyme loading 275 U/g proteins, reaction time 3 to 4 h and reaction temperature 30 ℃. Nine modified products were prepared, and their ACE inhibitory activities were evaluatedin vitro. It was found that the IC50 values of the modified products were in the range of 0.64 to 1.30 mg/mL, lower than that of SPHs (1.45 mg/mL). The analytical results from size exclusion chromatography confirmed that more large peptides with higher molecular weight were generated in the modified products. This study suggests that enzymatic hydrolysis coupled with plastein reaction might be served as a new approach to prepare ACE inhibitory peptides with higher activity from soybean protein isolate.
Key words:soybean protein hydrolysates;plastein reaction;ACE inhibitory activity;alcalase;size exclusion chromatography
高血压是导致成年人健康问题的多发病。血管紧张素转换酶(ACE)使人体正常的血压调节系统失衡而引起血压升高。常用的ACE抑制剂,如人工合成的卡托普利、恩那普利、阿拉普利等已经广泛地应用于高血压临床医疗[1],但是它们有咳嗽、味觉障碍和皮疹等副作用[2]。利用蛋白质的酶解获得具有ACE抑制活性的蛋白质水解物——降压肽,为食品科学家和营养学家所重视。
Plastein反应是一种肽链延长反应,反应过程中,由较低分子质量的肽形成较高分子质量、类似于蛋白质的混合物,称为Plastein(类蛋白)[3],反应机制有3种:缩合作用[4]、转肽作用[5]和物理聚集[6]。可以预料,蛋白质经过酶解以后,水解物再耦合进行Plastein反应,如果发生缩合作用和转肽作用,就会形成原水解物中不存在的新肽段,就有可能改变其生物活性。已经证明,酪蛋白水解物耦合Plastein反应修饰后,可以有效改善其抗氧化活性和ACE抑制活性[7-8]。
大豆蛋白水解物具有较好的ACE抑制活性[9]。本研究利用碱性蛋白酶Alcalase制备大豆蛋白水解物,并利用Plastein反应对水解物进行修饰,通过响应面分析法优化修饰反应条件,评价修饰产物的ACE抑制活性,并利用排阻色谱分析修饰产物的肽组成变化,从而为高ACE抑制活性大豆蛋白降压肽的制备提供技术依据。
1 材料与方法
1.1 材料与试剂
脱脂大豆蛋白粉 哈尔滨高科技蛋白有限公司;碱性蛋白酶(酶活力11.3×104U/g) 南宁庞博生物工程有限公司;兔肺丙酮粉、FAPGG(FA-Phe-Gly-Gly) Sigma公司;其他试剂均为分析纯,所用水为去离子水或蒸馏水。
1.2 仪器与设备
UV-2401PC型紫外-可见分光光度计 日本岛津公司;Kjeltec TM2300型自动凯氏定氮仪 瑞士Foss公司;LGJ-1型空冷冻干燥机 上海医用分析仪器厂;HZQ-F160型全温振荡培养箱 哈尔滨东联电子技术开发有限公司;DELTA 320型精密pH计 梅特勒-托利多中国有限公司;H-1型微型旋涡混合器 上海精科实业有限公司;YH-4BS型远红外恒温干燥箱 天津市中环实验电炉有限公司;AKTA explorer100型蛋白质快速层析系统 美国GE公司。
1.3 方法
1.3.1 大豆分离蛋白制备
参照文献[10]并略作修改。取250g脱脂大豆粉,加入2.5L蒸馏水,用1mol/L NaOH溶液调pH值至8.5,搅拌浸提2h。4000r/min离心20min后,弃去残渣。2mol/L HCl溶液调上清液pH值至4.5,静置1~2h,弃去上清液,下层蛋白质凝乳4000r/min离心20min,弃去上清液。蛋白质沉淀加500mL蒸馏水,搅拌、离心,弃去上清液;重复2次。蛋白质中加入200mL蒸馏水,1mol/L NaOH溶液调pH值至7.0,冷冻干燥即得大豆分离蛋白,其蛋白质质量分数约为96%(干质量)。
1.3.2 大豆蛋白水解物制备
配制质量浓度为10g/100mL的大豆分离蛋白溶液,2mol/L NaOH溶液调节pH值至8.5,加入碱性蛋白酶(550U/g蛋白质),55℃恒温水浴中进行酶解。不同解时间(0.5~7h)取出样品20mL,迅速在100℃沸水浴中加热15min,冷却至室温后6000r/min离心30min,分离出上清液。测定各个上清液的蛋白质含量和游离氨基含量,计算其水解度。再将各个上清液稀释至同一浓度,测定其ACE抑制活性。根据ACE抑制活性测定结果,确定适宜的水解时间,放大实验制备ACE抑制活性最高的大豆蛋白水解物,冷冻干燥后保存于-20℃备用。
1.3.3 大豆蛋白水解物的Plastein反应条件优化
采用中心组合试验,固定反应温度为30℃,以反应体系的游离氨基减少量为响应值,分别研究酶添加量、底物质量分数、反应时间的影响,采用三因素五水平响应面方法分析,其因素水平编码见表1。
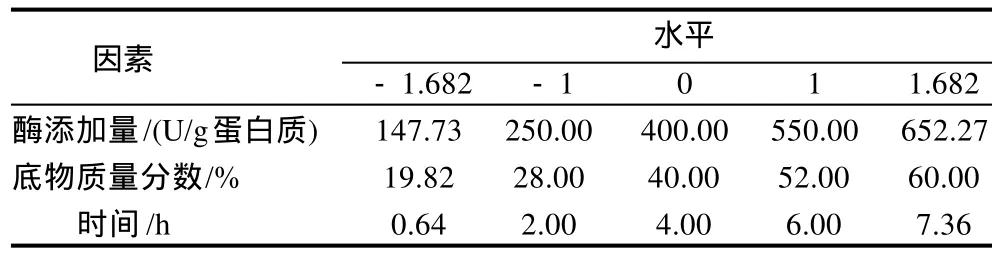
表1 响应面分析的因素水平编码表Table 1 Factors and levels in central composite design
1.3.4 相关分析
1.3.4.1 酶活力、蛋白质含量、游离氨基含量与蛋白质水解度的测定
碱性蛋白酶活力测定参照福林酚法[11].;蛋白质含量测定参照凯氏定氮法[12];游离氨基含量与蛋白质水解度(DH)测定参照OPA法[13-14]。
水解度计算公式[15]见式(1)。

式中:5.71为大豆蛋白质的换算系数;0.35为大豆分离蛋白的游离氨基含量/(mmol/g);7.8为大豆蛋白的肽键含量/(mmol/g);N1为大豆蛋白水解物的氮含量/(mg/mL)。
1.3.4.2 ACE抑制活性分析
参照文献[16]并略作修改。
ACE酶液提取:取50mg兔肺丙酮粉,浸泡于4℃、5mL的100mmol/L硼酸缓冲液(pH8.3)中,4℃恒温摇床中振摇12h,过滤、清液4℃保存。使用前用缓冲液稀释至一定倍数。
FAPGG底物溶液配制:称取一定量FAPGG溶于100mmol/L pH8.3的硼酸缓冲液(含300mmol/L的NaCl),配制成1.6mmol/L溶液。
ACE抑制活性测定和计算:将500μL FAPGG底物溶液与100μL超纯水或抑制剂(大豆蛋白水解物、修饰反应产物或卡托普利)混匀,37℃恒温水浴中预热2min,加入300μL ACE酶液,37℃水浴中反应30min,立即加入100μL 100mmol/L的EDTA终止反应,再加入3mL超纯水稀释,340nm波长处测定吸光度,平行3次。各个样品均作0min的对照样。对照样先加入EDTA,再加入ACE酶液,其他操作步骤相同。ACE抑制活性计算公式[17]见式(2)。

式中:ΔAc为加入超纯水时吸光度在30min内的变化;ΔAi为加入抑制剂时吸光度在30min内的变化。
IC50值测定和计算:配制不同浓度的ACE抑制剂(抑制肽为mg/mL,卡托普利为nmol/L),同上步骤测定各浓度ACE抑制剂的ACE抑制活性。以抑制剂浓度的常用对数为横坐标、ACE抑制活性为纵坐标制作标准曲线,利用回归方程计算出抑制剂的半抑制浓度(IC50)。IC50定义为抑制ACE酶活力50%时抑制剂的浓度,卡托普利的IC50值经过测定为5.2nmol/L。
1.3.4.3 分子排阻色谱分析
参照文献[18]并略作修改,使用AKTA explorer蛋白质快速层析系统、Superdex-7510/300GL(10mm×300mm)色谱柱分析,最大压力设定为1.80MPa,流速为0.5mL/min,检测波长为280nm。开机后,分别用2个柱体积的超纯水和洗脱液清洗色谱柱至电导率稳定。样品溶于0.1mol/L Na2HPO4-0.1mol/L NaOH缓冲液(pH12),蛋白质质量浓度为2.25mg/mL;样品过0.22μm水膜后进样量为0.5mL,并用该缓冲液进行洗脱。
1.3.5 数据的统计分析
采用Excel 2003软件和Design Expert 7.0软件对数据进行处理和分析。
2 结果与分析
2.1 大豆蛋白水解物的制备
碱性蛋白酶对大豆分离蛋白进行水解,水解产物因水解时间不同其肽分子组成不同,导致其ACE抑制活性不同。不同水解时间的大豆蛋白水解物的水解度与相应的ACE抑制活性见图1。

图1 水解时间对大豆分离蛋白水解物水解度和ACE抑制活性的影响Fig.1 Effects of hydrolysis time on degree of hydrolysis and ACE inhibitory activity of soybean protein hydrolysates
水解反应中大豆蛋白水解物的ACE抑制活性随水解度的增大而增大,4h之后水解物的水解度增加,但是其ACE抑制活性却降低。数据表明,水解反应4h时,大豆蛋白水解物中含有ACE抑制活性较高的肽段,水解物的水解度为16.6%、IC50值为1.45mg/mL;随着水解反应进一步进行,ACE抑制活性较高的肽段被水解,且生成的新肽段ACE抑制活性降低,所以整体上大豆蛋白水解物的ACE抑制活性降低。故此,以制备水解时间为4h的大豆蛋白水解物(SPH)作为Plastein反应的底物。
Lee等[19]利用4种蛋白酶在一定条件下制备水解度为6%~15%的大豆蛋白水解物,不论使用何种蛋白酶,水解度为15%的水解物其ACE抑制活性均为最高。Tovar-Pérez等[20]用碱性蛋白酶水解一种谷物球蛋白,发现水解度为13%的水解物其ACE抑制活性最高,IC50值为0.6mg/mL。本研究结果与上述结果相似。
2.2 Plastein反应条件的优化
2.2.1 回归方程的建立与分析
按照中心组合试验设计要求进行20组试验。酶添加量、底物质量分数和反应时间分别用X1、X2、和X3表示,以修饰产物的游离氨基减少量为响应值Y,试验结果表2。
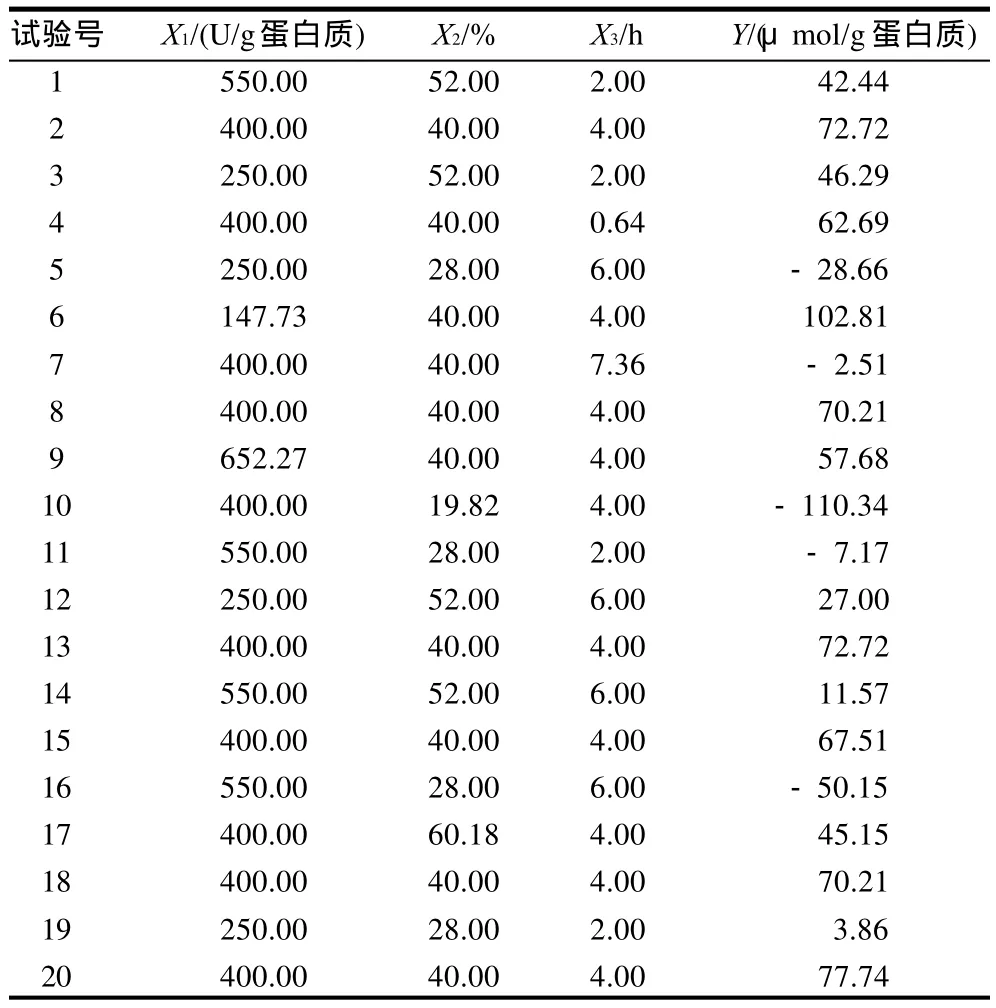
表2 中心组合设计及试验结果Table 2 Central composite design matrix and experimental results
利用Design Expert 7.0软件对试验数据进行二次多项回归拟合,剔除不显著因子(X1)后,得到的回归方程(模型)见式(3),方差分析结果见表3。

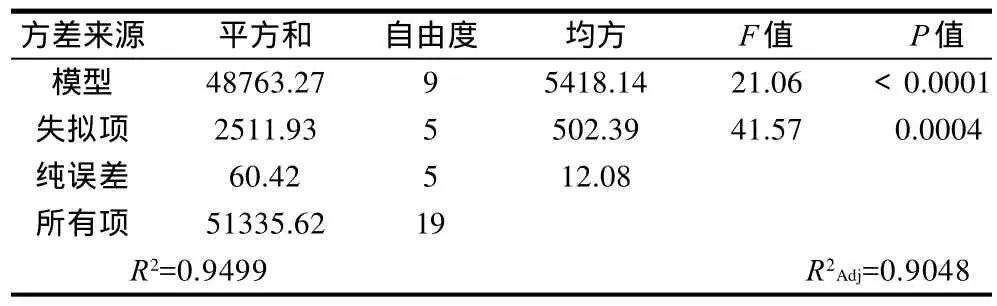
表3 回归方程方差分析表Table 3 Analysis of variance for the established regression equation
方差分析结果表明所得模型显著(P<0.0001),校正确定系数R2Adj=0.9048表明模型能很好的反映修饰反应过程中游离氨基含量的变化,与实际情况拟合较好。另外,通过软件分析,表明影响响应值的各因素主次顺序为底物质量分数、反应时间、酶添加量。
2.2.2 响应面分析与最优反应条件确定
应用Design Expert 7.0软件中Model Graphs程序作响应面曲面图见图2~4所示。
底物质量分数和酶添加量对反应体系游离氨基减少量的影响见图2,二者之间相互作用比较小(P>0.05),酶添加量对游离氨基减少量的影响也比较小(P>0.05)。酶添加量一定时,反应体系中游离氨基减少量随底物质量分数的增加而逐渐增大,底物质量分数约45%时达到最大,然后逐渐减小。

图2 底物质量分数和酶添加量对反应体系中游离氨基减少量的响应面(X3=4.00)Fig.2 Response surface plot showing the effects of substrate concentration and enzyme loading on decrease of free amino groups in plastein reaction mixture (X3=4.00)
底物质量分数和反应时间对反应体系游离氨基减少量的影响见图3,二者之间的相互作用较小(P>0.05)。随着底物质量分数增加、反应时间延长,游离氨基减少量先逐渐增加,然后逐渐减少。

图3 底物质量分数和反应时间对反应体系中游离氨基减少量的响应面(X1=400)Fig.3 Response surface plot showing the effects of substrate concentration and reaction time on decrease of free amino groups in plastein reaction mixture (X1=400)
反应时间和酶添加量对反应体系游离氨基减少量的影响见图4,二者之间相互作用比较小(P>0.05),酶添加量对游离氨基减少量的影响也比较小(P>0.05)。随着酶添加量增加,游离氨基减少量呈现减小趋势,但变化不是很大;随着反应时间延长,游离氨基减少量先逐渐增加,反应时间为3~4h之间达到最大,然后逐渐减小。

图4 反应时间和酶添加量对反应体系中游离氨基减少量的响应面(X2=40)Fig.4 Response surface plot showing the effects of reaction time and enzyme loading on decrease of free amino groups in plastein reaction mixture (X2=40)
综合分析得到大豆蛋白水解物Plastein反应修饰的适宜条件:底物质量分数45%、反应时间3~4h,因酶添加量的影响不显著,选择275U/g蛋白质。
底物质量分数对大豆蛋白水解物的Plastein反应修饰的影响最显著(P<0.0001)。水解物质量分数较低,会导致水解反应过多;水解物质量分数过高,体系的黏度过大不利于Plastein反应进行。Sukan等[21]研究发现,底物质量分数在20%~40%之间时,Plastein的产量最大。反应时间对大豆蛋白水解物Plastein反应修饰也有显著影响(P<0.01),游离氨基减少量随反应时间增加而增大,在3~4h时达到最大,然后开始降低,表明过长反应时间导致水解反应发生。Williams等[22]在利用胃蛋白酶催化菌蛋白水解物的Plastein反应时发现,65℃反应3h时,Plastein产量最大,本研究结果与之相似。
2.3 修饰产物的ACE抑制活性与肽组成分析
在底物质量分数45%、酶添加量275U/g蛋白质,采用不同反应时间制备出9个反应程度不同的修饰产物(MPP),它们的游离氨基减少量及ACE抑制活性(IC50值)列于表4。

表4 大豆蛋白水解物(SPH)以及9个修饰产物(MPP)的ACE抑制活性Table 4 ACE inhibitory activities of SPHs and nine modified products derived from plastein reaction
数据表明,在反应初始阶段(1~4h)反应体系中游离氨基减少量逐渐增加,说明发生缩合反应;随后(反应时间4~10h),游离氨基减少量开始降低,说明反应体系中有水解反应发生;当反应延长至24h,则发生显著的水解反应,修饰产物的游离氨基比大豆蛋白水解物还高(增加了73.56μmol/g蛋白质)。不过,与大豆蛋白水解物的IC50值(1.45mg/mL)相比,所有修饰产物的IC50值(0.64~1.30mg/mL)均更小。结果表明,在修饰反应过程中无论是发生缩合反应还是水解反应,修饰产物的ACE抑制活性均提高,幅度可达到10%~120%。数据还显示,ACE抑制活性最高的修饰产物MPP5,其游离氨基减少量不是最大,所以Plastein反应程度与ACE抑制活性之间的关系还需要进一步的研究。
为了进一步说明Plastein反应修饰对修饰产物中肽组成的影响,利用排阻色谱对大豆蛋白水解物及1个修饰产物(MPP5)进行分析,结果见图5。对比分析看出,修饰产物的肽组成明显不同于底物,有更多的大分子质量肽段存在(即有Plastein生成),同时伴随着小分子质量肽段的减少。这意味着Plastein的生成可能是修饰产物ACE抑制活性提高的重要原因。所以,Plastein反应修饰提高大豆蛋白水解物ACE抑制活性的一个根本原因可能在于:碱性蛋白酶Alcalase对疏水性氨基酸、芳香族氨基酸所形成的肽键具有专一性[23],因此在大豆蛋白水解物的Plastein反应修饰时,肽段之间的缩合反应将导致所生成的大分子质量肽段富含这些氨基酸;由于富含疏水性氨基酸的蛋白质水解物具有较高的ACE抑制活性[24],因此修饰产物的ACE抑制活性得到提高。
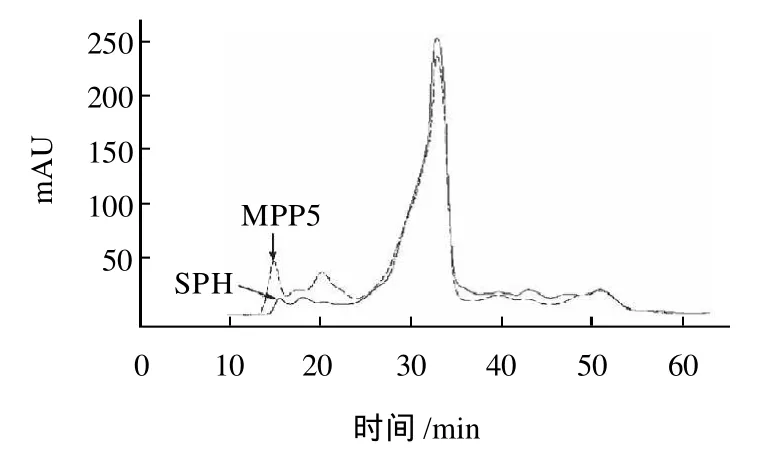
图5 大豆蛋白水解物(SPH)及其1个修饰产物(MPP5)的排阻色谱分析结果Fig.5 Size exclusion chromatographic profile for SPHs and nine modified products derived from plastein reaction
利用木瓜蛋白酶催化酪蛋白水解物发生Plastein反应,发现修饰产物的DPPH清除活性提高约6~8倍,ABTS+自由基清除活性提高约1倍[7]。Zhao等[8]利用碱性蛋白酶催化酪蛋白水解物发生Plastein反应,酪蛋白水解物的IC50值为47μg/mL,而修饰产物的IC50值则降低至0.5~0.6μg/mL。这些结果和本研究结果均显示,Plastein反应修饰可以有效地提高蛋白质水解物的生物活性。所以,酶水解大豆分离蛋白以后再耦合Plastein反应修饰,是一种制备高ACE抑制活性大豆蛋白降压肽的新技术。
3 结 论
3.1 利用碱溶解、酸沉淀的方法从脱脂豆粉制备大豆分离蛋白,并用碱性蛋白酶水解大豆分离蛋白。在55℃、底物质量浓度10g/100mL、pH8.5、酶添加量550U/g蛋白质条件下水解4h,大豆蛋白水解物的水解度为16.6%且具有最高ACE抑制活性,IC50值为1.45mg/mL。
3.2 以反应体系游离氨基减少量为响应值、通过响应面分析法,对大豆蛋白水解物的Plastein反应修饰条件优化。在30℃时,适宜反应条件:酶添加量275U/g蛋白质、底物质量分数45%、反应时间3~4h,它们对修饰反应的影响主次顺序为底物质量分数>反应时间>酶添加量。
3.3 对修饰产物ACE抑制活性评价结果表明,与大豆蛋白水解物相比,所有的修饰产物的IC50值均更小(0.64~1.30mg/mL),表明Plastein反应修饰可提高其ACE抑制活性。而排阻色谱分析表明,修饰产物中有更多的大分子质量肽段存在,推断Plastein的生成是修饰产物ACE抑制活性提高的重要原因。
3.4 大豆蛋白酶解以及耦合Plastein反应修饰,是一种制备高ACE抑制活性大豆蛋白降压肽的新技术。
[1] BARBOSA-FILHO J M, MARTINS V K M, RABELO L A, et al.Natural products inhibitors of the angiotensin converting enzyme (ACE).A review between 1980-2000[J]. Revista Brasileira de Farmacognosia,2006, 16(3):421-446.
[2] ATKINSON A B, ROBERTSON J I S. Captopril in the treatment of clinical hypertension and cardiac failure[J]. Lancet, 1979, 314(8147):836-839.
[3] YAMASHITA M, ARAI S, TSAI S J, et al. Plastein reaction as a method for enhancing the sulfur-containing amino acid level of soybean protein[J]. Journal of Agricultural and Food Chemistry, 1971, 19(6):1151-1154.
[4] FUJIMAKI M, KATO H, ARAI S, et al. Application of microbial proteinases to soybean and other materials to improve accept-ability,especially through the formation of plastein[J]. Journal of Applied Microbiology, 1971, 34(1):119-131.
[5] LOZANO P, COMBES D. alpha-Chymotrypsin in plastein synthesis:influence of substrate concentration on enzyme activity[J]. Biotechnology and Applied Biochemistry, 1991, 14(2):212-221.
[6] ANDREWS A T, ALICHANIDIS E. The plastein reaction revisited:evidence for a purely aggregation reaction mechanism[J]. Food Chemistry,1990, 35(4):243-261.
[7] 吴丹, 李铁晶, 赵新淮. 酪蛋白水解物的酶法修饰优化与抗氧化活性改善[J]. 农业机械学报, 2010, 41(1):139-145.
[8] ZHAO Xinhuai, LI Yayun. An approach to improve ACE inhibitory activity of casein hydrolysates with plastein reaction catalyzed by Alcalase[J]. European Food Research and Technology, 2009, 229(5):795-805.
[9] CHIANG W D, TSOU M J, TSAI Z Y, et al. Angiotensin I-conberting enzyme inhibitor derived from soy protein hydrolysate and produced by using membrane reactor[J]. Food Chemistry, 2006, 98(4):725-732.
[10] WANG Xiansheng, TANG Chuanhe, LI Biansheng, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4):560-567.
[11] SB/T 10317—1999 蛋白酶活力测定[S].
[12] GB/T 5009.5—2003 食品中蛋白质的测定[S].
[13] CHURCH F C, SWAISGOOD H E, PORTER D H, et al. Spectrophotometric assay usingo-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J]. Journal of Dairy Science, 1983, 66(6):1219-1227.
[14] SPELLMAN D, MCEVOY E, O’CUINN G, et al. Proteinase and exopeptidase hydrolysis of whey protein:Comparison of the TNBS,OPA and pH stat methods for quantification of degree of hydrolysis[J].International Dairy Journal, 2003, 13(6):447-453.
[15] 赵新淮, 冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学, 1994,15(11):65-67.
[16] MURRAY B A, WALSH D J, FITZGERALD R J. Modification of the furanacryloyl-L-phenylalanyl-glycylglycine assay for determination of angiotensin-I-converting enzyme inhibitory activity[J]. Journal of Biochemical and Biophysical Methods, 2004, 59(2):127-137.
[17] OTTE J, SHALABY S M A, ZAKORA M, et al. Fractionation and identification of ACE-inhibitory peptides fromα-lactalbumin andβcasein produced by thermolysin-catalysed hydrolysis[J]. International Dairy Journal, 2007, 17(12):1460-1472.
[18] CHU K T, NG T B. First report of a glutamine-rich antifungal peptide with immunomodulatory and antiproliferative activities from family Amaryllidaceae[J]. Biochemical and Biophysical Research Communications, 2004, 325(1):167-173.
[19] LEE J S, YOO M , KOO S H, et al. Antioxidant and ACE inhibitory activities of soybean hydrolysates:effect of enzyme and degree of hydrolysis[J]. Food Science and Biotechnology, 2008, 17(4):873-877.
[21] SUKAN G, ANDREWS A T. Application of the plastein reaction to caseins and to skim milk powder I. Protein hydrolysis and plastein formation[J]. Journal of Dairy Research, 1982, 49(2):265-278.
[22] WILLIAMS R J H, BROWNSELL V L, ANDREWS A T. Application of the plastein reaction to mycoprotein. I. Plastein synthesis[J]. Food Chemistry, 2001, 72(3):329-335.
[23] DOUCET D, GAUTHIER S F, OTTER D E, et al. Enzyme-induced gelation of extensively hydrolyzed whey proteins by alcalase:comparison with the plastein reaction and characterization of interactions[J].Journal of Agricultural and Food Chemistry, 2003, 51(20):6036-6042.
[24] LPEZ-FANDIO R, OTTE J, van CAMP J. Physiological, chemical and technological aspects of milk-protein -derived peptides with antihypertensive and ACE-inhibitory activity[J]. International Dairy Journal, 2006,16(11):1277-1293.
Preparation of ACE Inhibitory Peptides from Soybean Protein Isolate by Enzymatic Hydrolysis Coupled with Optimized Plastein Reaction
GAO Bo,ZHAO Xin-huai*
(Key Laboratory of Dairy Science, Ministry of Education, Northeast Agricultural University, Harbin 150030, China)
TS201.1
A
1002-6630(2010)22-0025-06
2010-02-07
国家自然科学基金项目(30972132)
高博(1983—),女,硕士研究生,研究方向为食品化学。E-mail:anglebbcgb@126.com
*通信作者:赵新淮(1963—),男,教授,博士,研究方向为食品科学。E-mail:zhaoxh@mail.neau.edu.cn

