肽链释放因子和核糖体蛋白L11在八肋游仆虫细胞中的定位
柴宝峰,李娜,王景涛,申泉,张志云,梁爱华
山西大学生物技术研究所 化学生物学与分子工程教育部重点实验室,太原 030006
肽链释放因子和核糖体蛋白L11在八肋游仆虫细胞中的定位
柴宝峰,李娜,王景涛,申泉,张志云,梁爱华
山西大学生物技术研究所 化学生物学与分子工程教育部重点实验室,太原 030006
原生动物纤毛虫是一类单细胞真核生物,其蛋白质合成终止过程中密码子使用的特殊性使其成为研究蛋白质合成终止机制的一个经典模型。为了能够有效地分析生物大分子在该细胞中的功能作用位点,本研究根据该生物染色体结构的特征,构建了含有红色荧光蛋白基因的大核人工染色体EoMAC_R,并与之前构建的含绿色荧光蛋白基因的大核染色体EoMAC_G一起,对蛋白质合成终止有关的3个重要因子核糖体大亚基蛋白L11、多肽链释放因子eRF1和eRF3在八肋游仆虫细胞中进行了荧光共定位分析。结果显示,在八肋游仆虫细胞中,蛋白质翻译过程主要位于“C”形大核内侧区域。构建的人工染色体能够作为一种有效的工具,对目的蛋白质在八肋游仆虫细胞中进行定位分析。
人工染色体,纤毛虫,细胞定位,肽链释放因子
Abstract:Protozoan ciliates are a group of unicellular eukaryotes.The special characteristics of stop codons usage in termination of protein biosynthesis in ciliates cells makes them an ideal model to study the mechanism of stop codon recognition of polypeptides release factors.To localize the functional positions of biomolecules in ciliates cell, we constructed a macronuclear artificial chromosome containing a gene encoding red fluorescence protein(EoMAC_R)based on the structural characteristics of ciliates chromosome.Three factors, L11, eRF1a, and eRF3 that are involved in termination process of protein synthesis were colocalized in Euplotes octocarinatus cells by using novel EoMAC_R and the previously constructed EoMAC_G.The results indicated that protein synthesis mainly occurred inside the “C” shape macronucleus, suggesting that EoMAC could be a useful tool for localizing biomolecules in ciliates cell.
Keywords:macronuclear artificial chromosome, ciliates, cellular localization, polypeptides release factors
原生动物纤毛虫是一类单细胞真核生物,其蛋白质合成终止过程中密码子使用的特殊性[1-2]使其成为研究蛋白质合成终止机制的一个经典模型。四膜虫Tetrahymena和草履虫Paramecium细胞中UAA和UAG编码谷氨酰胺,仅UGA作为终止密码子;在八肋游仆虫Euplotes octocarinatus细胞中UAA或UAG作为终止密码子,而 UGA编码半胱氨酸[3]。说明纤毛虫第一类肽链释放因子在识别终止密码子的机制上与高等真核生物具有一定的差异,这为研究真核生物蛋白质合成终止机制提供了参照工具,并成为分子细胞生物学研究的热点之一[4-9]。
纤毛虫有两种细胞核,小核负责遗传物质的传递,大核是营养核,具有转录活性。在大核中的染色体结构具有一定的特殊性,即一个染色体中只有一个基因[10]。每条染色体均以不同的高拷贝数决定其在细胞中的表达水平[11]。在纤毛虫细胞中有大量“C4A4C4A4C4A4C4”结构的端粒,维持了细胞分裂过程中大核染色体结构的稳定性[10]。基于此,本研究构建了八肋游仆虫含荧光蛋白的大核人工染色体,对蛋白质合成终止有关的一些因子,诸如核糖体大亚基蛋白L11[12]、肽链释放因子eRF1和eRF3[13]在细胞中进行了定位分析。
1 材料与方法
1.1 材料
八肋游仆虫E.octocarinatus由德国明斯特大学K.Heckmann教授惠赠,用绿梭藻虫 Chlorogoium elongatum喂食培养[14]。如无特殊说明,本研究所用的酶和试剂均购自TaKaRa公司(大连)。pEGFP-N1绿色荧光和 pDsRed1-N1红色荧光蛋白表达质粒购自Clontech公司。含绿色荧光蛋白基因的八肋游仆虫大核人工染色体(EoMAC_G)载体系本实验室构建[15],用于八肋游仆虫细胞定位分析。
1.2 引物
本研究中基因克隆和重组质粒构建过程中所用引物见表1,这些引物均由TaKaRa(大连)公司合成。
1.3 方法
1.3.1 八肋游仆虫含红色荧光蛋白基因人工大核染色体的构建
pDsRed1-N1是能够在哺乳动物细胞中高效表达红色荧光蛋白的表达载体,大小为 4.7 kb,以该质粒为原始载体,在其红色荧光蛋白基因的上下游分别插入八肋游仆虫 β2-tubulin基因端粒及 5′-和3′-UTR序列,使表达载体 pDsRed1-N1中 DsRed基因的两侧带有八肋游仆虫 β2-tubulin微管蛋白基因的上下游调控序列,确保其在八肋游仆虫细胞中稳定遗传和高效表达。从本实验室之前构建的含绿色荧光基因的八肋游仆虫大核人工染色体 EoMAC_G的 pBTub-Tel载体[15]中用 SnaBⅠ和 BamH Ⅰ双酶切,得到 β2-tubulin基因的表达调控序列和端粒序列,然后克隆到pDsRed1-N1质粒相应的酶切位点,即在红色荧光蛋白基因的上游加上了 β2-tubulin基因的表达调控序列和端粒结构;设计引物(表 1中PBeta2F 和PBeta2R),从 EoMAC_G的 pBTub-Tel载体上扩增 β2-tubulin基因的下游表达调控序列和端粒序列,用Not I 单酶切后连接到红色荧光蛋白基因的下游。最终得到含有β2-tubulin基因上下游基因表达调控序列和端粒结构的红色荧光蛋白基因的大核人工染色体(EoMAC_R)的重组质粒(pDsRed1-N1-Tel),多克隆位点位于红色荧光蛋白基因和5′-UTR之间。

表1 本研究所用引物Table 1 Primers used in this study
1.3.2 含L11、eRF1a和eRF3基因的荧光表达重组质粒的构建
设计引物(表1中 PL11F和PL11R),以本实验室之前构建的重组质粒 pGEX-6p1-L11为模板[12],扩增L11基因。用BamHⅠ和Hind Ⅲ双酶切连接到pDsRed1-N1-Tel载体中,构建成L11与红色荧光蛋白融合表达的重组载体 pDsRed1-N1-Tel-L11。设计引物(表 1,PeRF3F/PeRF3R;PeRF1aF/PeRF1aR),分别从 pGADT7-eRF3和 pGBKT7-eRF1a[6]中克隆eRF1a基因和eRF3基因,产物经BamH Ⅰ和Hind Ⅲ双酶切,分别克隆至载体 pBTub-Tel和 pDsRed1-N1-Tel相应酶切位点,构建成绿色荧光和红色荧光蛋白基因分别与两类肽链释放因子基因融合表达的重组载体pBTub-Tel-eRF1a、pDsRed1-N1-Tel-eRF1a和pBTub-Tel-eRF3,用于转化八肋游仆虫细胞。
1.3.3 八肋游仆虫细胞的处理及目的基因的转染与观察
八肋游仆虫细胞的处理、富集及外源DNA转染见文献[15]。转染后 16~24 h,Leica TCS SP5激光共聚焦显微镜观察定位结果。
1.3.4 融合蛋白基因表达的Western blotting鉴定
绿色荧光和红色荧光蛋白基因及其与相应的融合蛋白基因 EGFP-eRF1a、EGFP-eRF3在八肋游仆虫细胞中的表达用Western blotting进行鉴定,GFP作为标签,其单克隆抗体作为一抗,确认融合蛋白的表达。操作步骤与李娜等所用的方法[15]完全一致。
2 结果与讨论
2.1 八肋游仆虫含红色荧光蛋白基因人工大核染色体的构建
在构建了含绿色荧光蛋白基因的八肋游仆虫大核人工染色体(EoMAC_G)的基础上[15],为了便于在原生动物纤毛虫细胞中进行蛋白质共定位的研究,又构建了含红色荧光蛋白基因的八肋游仆虫大核人工染色体(EoMAC_R)。该染色体的5′和3′端分别带有一个八肋游仆虫 β2-tubulin基因的端粒结构C4A4C4A4C4A4C4;其内侧分别为β2-tubulin基因表达的上下游调控序列(49 bp和121 bp)[16];中部含一个多克隆位点和一个编码红色荧光蛋白的基因。EoMAC_R克隆在pDsRed-N1载体中,形成重组质粒 pDsRed1-N1-Tel。重组质粒经酶切和 PCR鉴定(图1),基因片段大小符合预期,最终经过测序确认正确。
将带有人工染色体的质粒 pBTub-Tel和pDsRed1-N1-Tel分别转染经过饥饿处理的八肋游仆虫细胞。48 h后观察荧光的表达水平(图2)。大核人工染色体所携带的绿色荧光蛋白和红色荧光蛋白基因在八肋游仆虫细胞中得到高效表达,而且在细胞中呈均匀分布(图2A、2B)。而没有转化的细胞中无明显的荧光信号(图2C)。
2.2 含L11、eRF1a和eRF3基因的荧光表达重组质粒的构建
用表1中PL11F和PL11R为引物,以pGEX-6p1-L11为模板[12],扩增编码八肋游仆虫核糖体大亚基蛋白 L11的全长基因(531 bp)。用 BamHⅠ和Hind Ⅲ双酶切,连接到pDsRed1-N1-Tel载体的多克隆位点中,构建成L11与红色荧光蛋白融合表达的重组载体pDsRed1-N1-Tel-L11。酶切和PCR鉴定正确(图3A)。用表1中的PeRF3F/PeRF3R和PeRF1aF/PeRF1aR为引物,分别从重组质粒 pGADT7-eRF3和pGBKT7-eRF1a[6]中克隆eRF1a(1338 bp)基因和eRF3(2400 bp)基因,产物经BamH Ⅰ和Hind Ⅲ双酶切,分别克隆至载体pBTub-Tel和pDsRed1-N1-Tel相应酶切位点,构建成含有绿色荧光和红色荧光蛋白分别与肽链释放因子融合表达的重组质粒 pBTub-TeleRF1a、pDsRed1-N1-Tel-eRF1a和 pBTub-Tel-eRF3,3个重组质粒分别经酶切和PCR鉴定后(图3B和图4),测序确认正确,用于下一步的八肋游仆虫细胞转化。
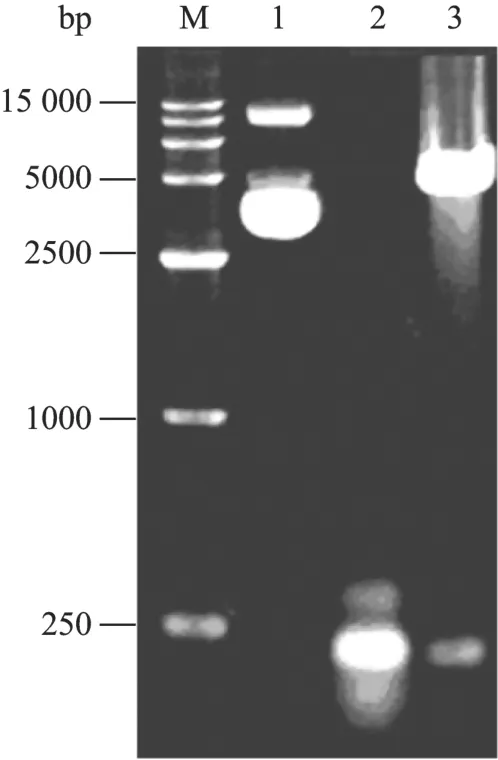
图1 重组载体pDsRed1-N1-Tel的PCR及酶切鉴定Fig.1 Analysis of recombinant vector pDsRed1-N1-Tel by PCR and enzyme digestion.M: DNA ladder; 1: pDsRed1-N1-Tel containing EoMAC_R; 2: PCR product of the 3′ untranslating region and telomere of β2-tubulin from pDsRed1-N1-Tel; 3:pDsRed1-N1-Tel digested with NotⅠ.
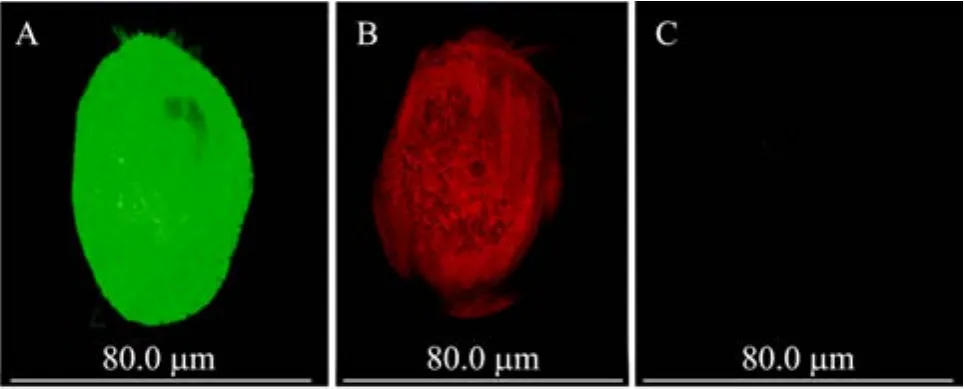
图2 绿色荧光和红色荧光蛋白基因在八肋游仆虫细胞中的表达Fig.2 Expression of GFP and RFP gene in E.octocarinatus cells.(A)EGFP gene in EoMAC-G was expressed in Euplotes cell.(B)RFP gene in EoMAC-R was expressed in Euplotes cell.(C)Euplotes cell without transfection.
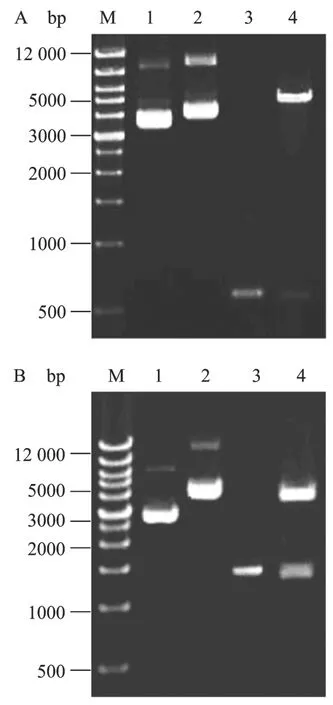
图3 重组质粒 pDsRed1-N1-Tel-L11(A)和 pBTub-TeleRF1a(B)的鉴定Fig.3 Identification of the recombinant plasmid pDsRed1-N1-Tel-L11(A)and pBTub-Tel-eRF1a(B).M: DNA marker; 1:plasmid pDsRed1-N1-Tel and pBTub-Tel, respectively; 2:recombinant vectors; 3: PCR product of L11 and eRF1a gene from the recombinant vectors; 4: the recombinant vectors digested with Hind Ⅲ and BamH I, respectively.

图4 重组质粒pDsRed1-N1-Tel-eRF1a(A)和pBTub-TeleRF3(B)的鉴定Fig.4 Identification of the recombinant plasmid pBTub-TeleRF1a(A)and pBTub-Tel-eRF3(B).M: DNA marker; 1: the plasmid pDsRed1-N1-Tel and pBTub-Tel; 2: the recombinant plasmid pDsRed1-N1-Tel-eRF1a and pBTub-Tel-eRF3; 3: the recombinant plasmid digested with Hind Ⅲ a nd BamHⅠ; 4:PCR product of eRF1a and eRF3 from the recombinant plasmid,respectively.
2.3 肽链释放因子eRF1a与L11蛋白在八肋游仆虫中的共定位
将构建的重组质粒 pDsRed1-N1-Tel-L11与pBTub-Tel-eRF1a转化经过饥饿处理的八肋游仆虫细胞,16~24 h后观察细胞内荧光蛋白的表达量和分布。如图5所示,第一类肽链释放因子和核糖体大亚基L11蛋白主要定位在细胞质中的大核附近。尤其 eRF1a的分布(绿色荧光)沿核膜周围形成一个大核(DAPI染色)的轮廓。在“C”形大核的内侧,在一个圆形区域中,二者的分布比较集中,该区域是内质网分布比较集中的部位,蛋白质翻译活动比较强烈。另外,在细胞膜(皮层)附近,也有较强的荧光定位信号,这些部位是纤毛虫细胞线粒体集中的部位[17],线粒体有独立的基因组和蛋白质翻译机器,其中有活跃的蛋白质翻译活动。图中还可以看到,在大核内有明显的绿色荧光分布,说明其中有第一类肽链因子的存在。关于肽链释放因子在细胞核中的功能多有报道,与细胞核内微管的组装有一定的关系[18],从而影响细胞的有丝分裂过程。有研究表明,在真核细胞的核中有蛋白质翻译过程的存在[19],即与原核生物一样,在细胞核中基因的转录和翻译耦联在一起,尽管这一结论有待进一步的证实,肽链释放因子在核中的定位也给予该结论一定的支持。
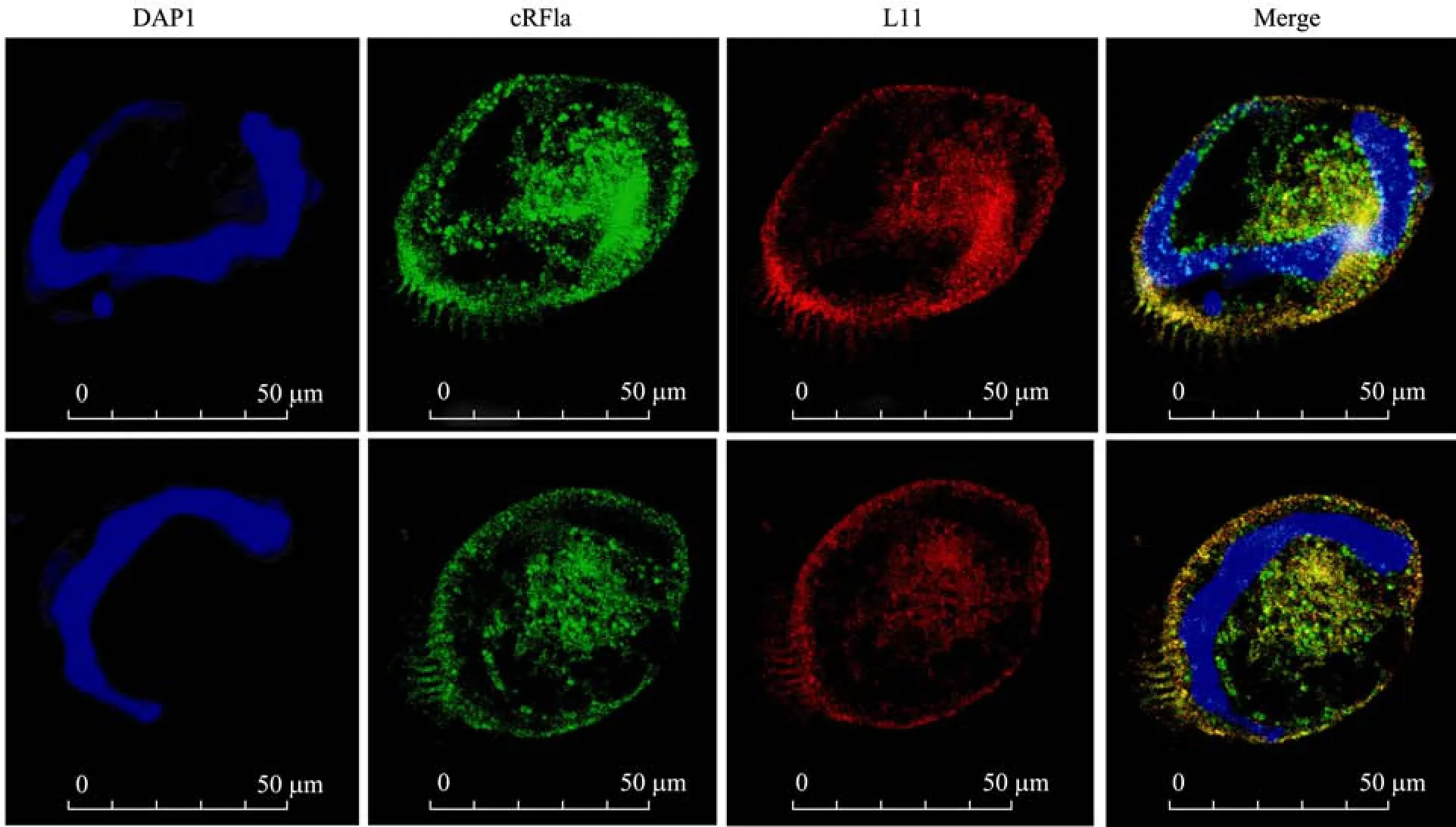
图5 eRF1a与L11在八肋游仆虫细胞中的共定位Fig.5 Co-localization of eRF1a and L11 in E.octocarinatus.Observed by using laser scanning confocal microscope, Leica TCS SP5.
由于eRF1a 和eRF3均克隆自八肋游仆虫细胞,故以 GFP作为标签,利用 GFP的单克隆抗体(Chemicon,USA)进行Western blotting分析,根据目的蛋白的预期大小和Western blotting结果(图6),进一步证实了外源目的基因eRF1a和eRF3在八肋游仆虫细胞中得到了高效表达。

图6 荧光蛋白及其融合蛋白在细胞中表达的 Western blotting鉴定Fig.6 Western blotting analysis of expression of fluorescence protein and fusion proteins in Euplotes cells.M: wide range protein marker; 1: GFP; 2: fusion protein GFP-eRF1a; 3: fusion protein GFP-eRF3.
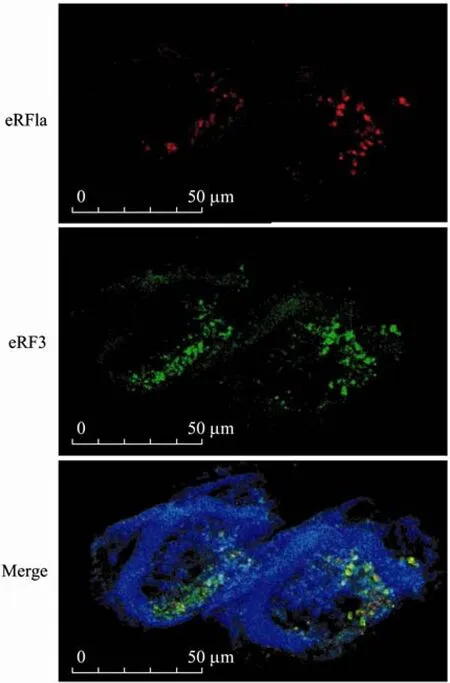
图7 肽链释放因子eRF1a与eRF3在八肋游仆虫中的共定位Fig.7 Co-localization of polypeptide release factors eRF1a and eRF3 in E.octocarinatus cell.
2.4 肽链释放因子eRF3与eRF1a在八肋游仆虫细胞中的共定位
将构建的重组质粒 pDsRed1-N1-Tel-eRF1a与pBTub-Tel-eRF3转化经过饥饿处理的八肋游仆虫细胞,16~24 h后观察细胞内荧光蛋白的表达量和分布。如图7所示,两类肽链释放因子在细胞中也有共定位,而且集中在“C”形大核的内侧。该区域的DAPI染色较深,说明有核酸物质分布,是蛋白质翻译的主要场所。
细胞内蛋白质翻译过程和场所分布在原核生物和高等真核生物细胞中的研究比较深入,尽管在机制上还有诸多不清楚的地方,但在许多方面取得了一致的意见。粗面型内质网是核糖体附着的主要场所,其与核膜联结,核孔中运出的mRNA直接参与“核糖体与 mRNA”翻译起始复合体的形成,减少mRNA运输过程中的损耗。在原生动物纤毛虫细胞中,有大核和小核,小核负责遗传物质的传递,大核是营养核,具有转录活性,蛋白质翻译过程主要集中在大核附近。关于该类生物蛋白质翻译的过程和机制的研究才刚开始,尤其是该类生物细胞内蛋白质合成新生肽链释放过程中终止密码子识别的特殊性,使其成为肽链释放因子识别终止密码子机制研究的一个经典模型,蛋白质翻译的终止机制是近年来分子细胞生物学研究的一个热点课题[4,9,20-22]。本研究构建的八肋游仆虫大核人工染色体为研究原生动物纤毛虫细胞内的大分子的功能作用位点提供了有效的工具。
REFERENCES
[1]Kim OT, Sakurai A, Saito K, et al.Ciliates use both variant and universal genetic codes: evidence of omnipotent eRF1s in the class Litostomatea.Gene, 2008,417(1/2): 51−58.
[2]Inagaki Y, Doolittle WF.Class I release factors in ciliates with variant genetic codes.Nucleic Acids Res, 2001,29(4): 921−927.
[3]Meyer F, Schmidt HJ, Plumper E, et al.UGA is translated as cysteine in pheromone 3 of Euplotes octocarinatus.Proc Natl Acad Sci USA, 1991, 88(9): 3758−3761.
[4]Lekomtsev S, Kolosov P, Bidou L, et al.Different modes of stop codon restriction by the Stylonychia and Paramecium eRF1 translation termination factors.Proc Natl Acad Sci USA, 2007, 104(26): 10824−10829.
[5]Kim OT, Yura K, Go N, et al.Newly sequenced eRF1s from ciliates: the diversity of stop codon usage and the molecular surfaces that are important for stop codon interactions.Gene, 2005, 346: 277−286.
[6]Chai BF, Song L, Fu YJ, et al.Interaction of two classes of release factors from Euplotes octocarinatus.J Genet Genomics, 2004, 31(5): 460−467.
[7]Seit-Nebi A, Frolova L, Kisselev L.Conversion of omnipotent translation termination factor eRF1 into ciliate-like UGA-only unipotent eRF1.EMBO Rep, 2002,3(9): 881−886.
[8]Muramatsu T, Heckmann K, Kitanaka C, et al.Molecular mechanism of stop codon recognition by eRF1: a wobble hypothesis for peptide anticodons.FEBS Lett, 2001,488(3): 105−109.
[9]Fan-Minogue H, Du M, Pisarev AV, et al.Distinct eRF3 requirements suggest alternate eRF1 conformations mediate peptide release during eukaryotic translation termination.Mol Cell, 2008, 30(5): 599−609.
[10]Prescott DM.The DNA of ciliated protozoa.Microbiol Rev, 1994, 58(2): 233−267.
[11]La Terza A, Miceli C, Luporini P.Differential amplification of pheromone genes of the ciliate Euplotes raikovi.Dev Genet, 1995, 17(3): 272−279.
[12]Wang YY, Zhang ZY, Chai BF, et al.Ribosome protein L11 from Euplotes interacts with polypeptide release factor in vitro.Chin J Biochem Mol Biol, 2008, 24(4):348−351.王玉瑶, 张志云, 柴宝峰, 等.游仆虫重组核糖体蛋白Lll与肽链释放因子的体外相互作用分析.中国生物化学与分子生物学, 2008, 24(4): 348−351.
[13]Sun QH, Chai BF, Liang AH.Cloning and sequence of eRF3 gene from Euplotes octocarinatus.Chin J Biochem Mol Biol, 2002, 18(3): 347−351.孙泉红, 柴宝峰, 梁爱华.八肋游仆虫第二类肽链释放因子基因的克隆与序列分析.中国生物化学与分子生物学报, 2002, 18(3): 347−351.
[14]Schulze Dieckhoff H, Freiburg M, Heckmann K.The isolation of gamones 3 and 4 of Euplotes octocarinatus.Eur J Biochem, 1987, 168(1): 89−94.
[15]Li N, Chai BF, Wang JT, et al.Construction of an Euplotes octocarinatus macronuclear artificial chromosome harboring codon-optimized EGFP gene.Chin J BiochemMol Biol, 2009, 25(5): 436−441.李娜, 柴宝峰, 王景涛, 等.八肋游仆虫含绿色荧光蛋白基因的大核人工染色体的构建.中国生物化学与分子生物学报, 2009, 25(5): 436−441.
[16]Chai BF, Wang JT, Liang AH.Cloning and sequence analysis of a novel beta-tubulin gene from Euplotes octocarinatus.J Shanxi Univ: Nat Sci Ed, 2007, 30(2):261−264.柴宝峰, 王景涛, 梁爱华.八肋游仆虫一个新 beta-微管蛋白基因的克隆与序列分析.山西大学学报: 自然科学版, 2007, 30(2): 261−264.
[17]Ji DD, Song WB.On the ultrastructure of four Peritrichous Ciliates(Ciliphora, Peritrichida).J Ocean Univ China,2005, 35(2): 199−205.季道德, 宋微波.四种缘毛目纤毛虫的超微结构观察.中国海洋大学学报, 2005, 35(2): 199−205.
[18]Valouev IA, Kushnirov VV, Ter-Avanesyan MD.Yeast polypeptide chain release factors eRF1 and eRF3 are involved in cytoskeleton organization and cell cycle regulation.Cell Motil Cytoskeleton, 2002, 52(3): 161−173.[19]Iborra FJ, Jackson DA, Cook PR.Coupled transcription and translation within nuclei of mammalian cells.Science,2001, 293(5532): 1139−1142.
[20]Kervestin S, Frolova L, Kisselev L, et al.Stop codon recognition in ciliates: Euplotes release factor does not respond to reassigned UGA codon.EMBO Rep, 2001,2(8): 680−684.
[21]Hatin I, Fabret C, Rousset JP, et al.Molecular dissection of translation termination mechanism identifies two new critical regions in eRF1.Nucleic Acids Res, 2009, 37(6):1789−1798.
[22]Cheng Z, Saito K, Pisarev AV, et al.Structural insights into eRF3 and stop codon recognition by eRF1.Genes Dev, 2009, 23(9): 1106−1118.
Localization of polypeptides release factors and ribosome protein L11 in Euplotes octocarinatus
Baofeng Chai, Na Li, Jingtao Wang, Quan Shen, Zhiyun Zhang, and Aihua Liang
Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Institute of Biotechnology, Shanxi University, Taiyuan 030006, China
Received:October 9, 2009;Accepted:December 17, 2009
Supported by:National Natural Science Foundation of China(Nos.30770294, 30940043, 30670282), Natural Science Foundation of Shanxi Province(No.2009011040-1).
Corresponding author:Baofeng Chai.Tel: +86-351-7019083; E-mail: bfchai@sxu.edu.cn国家自然科学基金(Nos.30770294, 30940043, 30670282),山西省自然科学基金(No.2009011040-1)资助。

