表达TNFR-Fc融合蛋白的GS-CHO细胞动态流加培养过程的设计
范里,赵亮,孙亚婷,寇天赐,谭文松
华东理工大学 生物反应器工程国家重点实验室,上海 200237
表达TNFR-Fc融合蛋白的GS-CHO细胞动态流加培养过程的设计
范里,赵亮,孙亚婷,寇天赐,谭文松
华东理工大学 生物反应器工程国家重点实验室,上海 200237
人肿瘤坏死因子受体Ⅱ-Fc融合蛋白在治疗风湿性、类风湿性关节炎方面拥有广阔的市场前景和巨大的经济价值。本实验以表达TNFR-Fc融合蛋白的GS-CHO细胞为研究对象,结合细胞生长代谢特性和动力学参数分析,以葡萄糖为关键控制参数,通过测定培养上清的葡萄糖浓度对培养过程中的葡萄糖消耗进行及时的预测,调整流加速率,形成了以满足细胞生长代谢需要为基本原则的动态流加培养过程设计模型。在此控制模型指导下,建立了高效的流加培养过程。使最大活细胞密度和最大融合蛋白浓度分别达9.4×106cells/mL和207 mg/L,较批次培养分别提高了3.4倍和3倍。本研究所采用的研究方法和控制策略为优化GS-CHO细胞培养过程和TNFR-Fc融合蛋白成功迈向产业化奠定了基础。
GS-CHO细胞,流加培养,TNFR-Fc融合蛋白,葡萄糖,动力学
Abstract:TNFR-Fc is an important fusion protein that has great potential in therapeutic and diagnostic applications.We developed an efficient fed-batch process for GS-CHO cells to produce TNFR-Fc.The rationale of this fed-batch process relies on the supply of sufficient nutrients to meet the requirements of cell metabolism.The optimal feed medium was designed through ration design.A metabolically responsive feeding strategy was designed and dynamically adjusted based on the residual glucose concentration determined off-line.In this process, the maximal viable cell density and antibody concentration reached above 9.4×106cells/mL and 207 mg/L, respectively.Compared with the batch process, the newly developed fed-batch process increased the cell yield by 3.4 fold and the final antibody concentration by 3 fold.This fed-batch process would therefore facilitate the production of therapeutic antibody by GS-CHO cells.
Keywords:GS-CHO cell, fed-batch, TNFR-Fc, glucose, dynamic model
随着嵌合化、人源化和全人源化抗体融合蛋白药物的设计技术的突破,抗体类药物成为生物医药产业发展的主要方向。与微生物宿主相比,动物细胞具有更完备的蛋白质后期修饰及加工能力,因此利用哺乳动物细胞生产抗体类药物得到越来越广泛的应用。中国仓鼠卵巢细胞(CHO)表达的蛋白在分子结构和生物学功能方面最接近天然蛋白分子,因此成为生产抗体类药物的首选宿主细胞[1]。
人肿瘤坏死因子受体Ⅱ-Fc抗体融合蛋白(TNFR-Fc)是利用受体免疫球蛋白融合技术,将受体的细胞外区与人免疫球蛋白的 Fc段基因融合得到的重组蛋白。TNFR-Fc能够特异性地与体内肿瘤坏死因子结合,从而抑制关节的炎症反应。这类药物在治疗风湿性、类风湿性关节炎方面具有明显的疗效,但是临床使用剂量大和动物细胞表达抗体融合蛋白能力低的矛盾限制了其在临床上的应用。
流加培养由于其操作简便、可重复性强,有利于产品批次间的稳定性和过程成本的控制,因此广泛用于动物细胞表达产品的生产,成为动物细胞培养的主流工艺[2]。然而流加培养过程中营养物限制或抑制和有毒代谢物累积是限制细胞生长和影响产物合成的主要因素[3-5]。已有许多文献对特定细胞的流加培养过程有所阐述[6-8],但是一般只局限于恒速流加培养过程,其缺点是营养物补加不平衡,利用率低。此外,针对表达TNFR-Fc的CHO细胞动态流加培养过程也未见报道。因此针对 GS-CHO细胞代谢动力学研究及在此基础上流加培养过程的设计,是其成功迈向产业化过程中一项必不可少的工作。
本研究通过测定分析细胞对营养物质(葡萄糖、丙酮酸、氨基酸和磷酸根)的需求,根据代谢动力学分析,设计营养均衡的流加培养基,提高培养基中营养物的综合利用效率;以葡萄糖为关键控制参数,通过离线测定培养上清中葡萄糖的浓度,对培养过程中的葡萄糖消耗进行及时地预测,通过控制流加速率来补充细胞消耗的营养物质,维持培养环境相对稳定;同时控制乳酸和渗透压的累积,减缓对细胞的毒害。该流加培养过程有效地提高了细胞密度,延长了培养周期,增加了融合蛋白的产量,为GS-CHO细胞培养和TNFR-Fc融合蛋白的工业化生产过程优化和放大奠定基础。同时也将对其他动物细胞培养过程和重组蛋白药物等产品工业化生产提供重要的科学依据。
1 材料与方法
1.1 细胞株
实验所用细胞株为GS-CHO细胞,分泌人肿瘤坏死因子受体Ⅱ-Fc抗体融合蛋白。
1.2 培养基
基础培养基为Excell302 商业培养基(24324C,JRH公司)。流加培养基为葡萄糖、氨基酸、磷酸根、Pluronic F68等营养成分的浓缩液,化学成分明确。各营养物组分的浓度采用理性设计方法(Rational design)进行设计[9-10](表1)。上述培养基均经Millipore公司0.1 μm微孔滤膜过滤除菌。所有培养基配制所用试剂均购自Sigma-Aldrich公司。

表1 流加培养基组成及添加物浓度Table 1 Supplementations made to the feed solution used in feed medium
1.3 细胞培养系统和培养方法
1.3.1 种子细胞培养
从细胞库中复苏GS-CHO种子细胞,以2×105~3×105cells/mL活细胞密度接种于摇瓶,置于36.8℃、5% CO2饱和湿度的培养箱中培养,转速为50 r/min,作为实验用的种子细胞。
1.3.2 反应器中的批次培养
取对数生长期的GS-CHO细胞,经800 r/min离心5 min,弃去上清,用新鲜的基础培养基悬浮细胞。以约2×105cells/mL的活细胞密度接种至反应器(2 L BIOSTAT B,德国 B.Braun公司,在线监控软件MFCS/win1.1),培养体积为1.5 L。反应器操作条件:pH(7.0±0.1),DO为50%空气饱和度,温度为36.8℃,搅拌转速为80 r/min。培养过程中每隔约12 h取样。培养液经10 000 r/min离心10 min后取上清作生化分析。
1.3.3 反应器中的流加培养
取对数生长期的 GS-CHO细胞,经 800 r/min离心5 min,弃去上清,用新鲜的基础培养基悬浮细胞。以约 1×105~2×105cells/mL 的活细胞密度接种至反应器(2 L BIOSTAT B,德国B.Braun公司,在线监控软件MFCS/win1.1),培养体积为1.0 L。反应器操作条件:pH(7.0±0.1),DO为50%空气饱和度,温度为36.8℃,搅拌转速为80 r/min。培养过程中每隔约12 h取样,测定葡萄糖浓度。通过葡萄糖控制模型对其进行反馈控制。
1.4 葡萄糖控制模型
在一定条件下,特定的工程细胞株对各个营养物质的消耗速率基本不变,并且相互之间存在一定关系[11]。因此可以选择某一种营养物的比消耗速率为基准,指导其余营养物的添加。
葡萄糖浓度检测具有方便快捷且相对误差小的特点,而且还可以通过调整培养基中葡萄糖的浓度控制乳酸的生成。因此选择葡萄糖为关键控制参数,通过测定葡萄糖在一段时间内的消耗速率确定下一阶段葡萄糖的消耗量(公式 1),从而确定流加培养基体积(公式 2),并采用连续添加的方式补充细胞消耗的营养物质。

其中∆gluc为下一阶段葡萄糖的消耗量;qgAluvce为葡萄糖的平均比消耗速率,可以通过营养物累积消耗回归方法计算而得;为下一阶段活细胞对时间的积分值(IVC);Vfeed为从tn到tn+1这个时间段内添加得流加培养基的量;Cgluc为葡萄糖在流加培养基的浓度,一般为200 mmol/L。
1.5 测定和分析方法
用血球计数板点样计数细胞,并用台盼蓝染色法确定细胞的存活率,每样计数 2次,取平均值;葡萄糖和氨分别采用葡萄糖试剂盒和 Berthlet比色法氨试剂盒(上海生物制品所)测定;乳酸浓度采用乳酸脱氢酶法测定(南京建成生物工程研究所);磷酸浓度采用磷铋钼蓝分光光度法测定[12];氨基酸采用反相高效液相色谱系统 ACCQ-TAG柱前衍生方法测定,其分离条件详见ACCQ-TAG测试试剂包说明;TNFR-Fc浓度采用高效亲和色谱检测。
2 结果与讨论
2.1 批次培养中的营养物消耗和副产物与融合蛋白生成
2.1.1 细胞生长与产物表达
图1A所示为GS-CHO细胞在生物反应器中的批次培养细胞生长及产物合成曲线。以 0.24×106cells/mL的活细胞密度接种至新鲜的 Excell302商业培养基,基本未观察到延迟期,细胞直接进入对数生长期。当培养至106 h时活细胞密度达到最大,为2.81×106cells/mL。随后细胞进入衰亡期,活细胞密度迅速下降。细胞在对数生长期的最大比生长速率为 0.80 day−1,平均比生长速率为 0.66 day−1。融合蛋白浓度随着批次培养的进行不断增加,至批次培养结束时融合蛋白浓度达到70.1 mg/L。
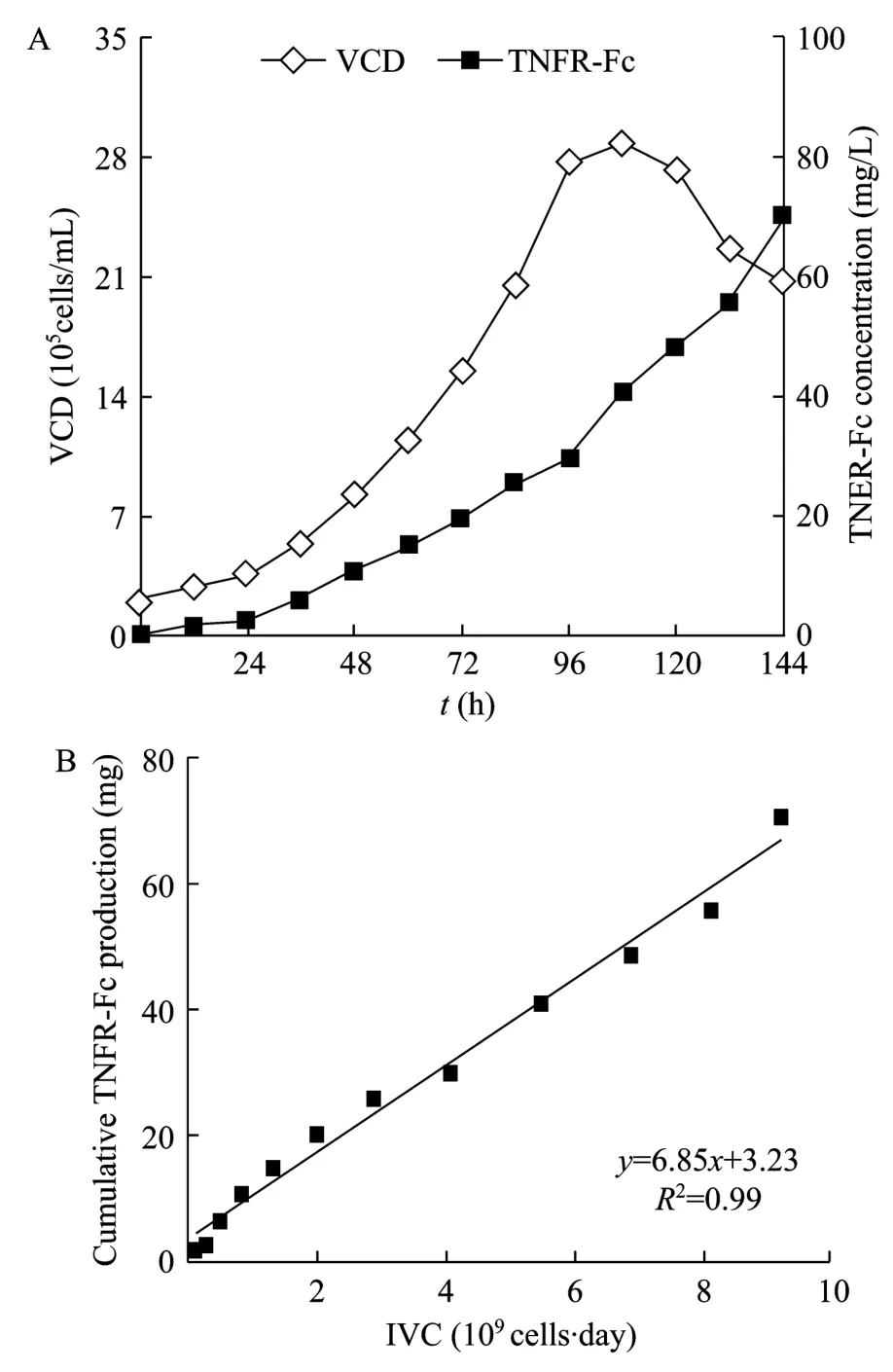
图1 GS-CHO细胞批培养的生长与融合蛋白表达曲线Fig.1 Cell growth and antibody production curves of GS-CHO cells in batch culture.
以融合蛋白累积生成量为纵坐标,IVC为横坐标作图(图1B),进行线性拟合,发现具有良好的线性(R2>0.95),斜率即为融合蛋白的比生成速率,约为6.85 mg/(109cells·day)。说明此GS-CHO细胞表达TNFR-Fc融合蛋白与细胞生长不相关,具有恒定的融合蛋白比生成速率。在融合蛋白比生成速率不变的前提下,融合蛋白的最终浓度与IVC成正比,因此提高活细胞密度和延长培养时间均会对最终的融合蛋白浓度起到积极的作用。
2.1.2 葡萄糖与丙酮酸的代谢
葡萄糖和丙酮酸是细胞生长代谢的主要能源和碳源物质。在批次培养过程中,培养环境中的葡萄糖、丙酮酸浓度变化如图2所示。在对数生长期内,葡萄糖消耗较快,其平均比消耗速率约为 4.32 mmol/(109cells·day)。此时,通过糖酵途径生成的丙酮酸速率超过了TCA循环对其的需求,因此丙酮酸溢出,培养上清中的丙酮酸浓度缓慢增加。当细胞进入平台期(94 h以后),由于葡萄糖浓度很低,细胞的生长受到影响,比生长速率迅速下降。此外,培养环境中葡萄糖的耗竭还导致细胞本身代谢发生迁移,代谢副产物乳酸通过乳酸脱氢酶的作用生成丙酮酸重新进入TCA循环。另外丙酮酸也重新被细胞利用供细胞维持所需。此现象表明:1)葡萄糖是细胞培养过程中重要的碳源和能源物质,当葡萄糖和丙酮酸在培养基中均富裕时,细胞优先利用葡萄糖;2)当葡萄糖耗竭时,细胞本身的代谢迁移所提供的能量不能满足细胞生长和产物合成所需;3)流加培养过程中,当培养环境中葡萄糖浓度相对富裕时,丙酮酸无需额外添加。
2.1.3 谷氨酸、谷氨酰胺及其他氨基酸的代谢
对于 GS系统的细胞而言,培养环境中的谷氨酸是细胞重要的氮源和能源物质。谷氨酸可在谷氨酰胺合成酶作用下合成细胞生长和产物合成所必需的谷氨酰胺。图3为培养过程中谷氨酸和谷氨酰胺的浓度变化。在培养初期,虽然培养环境中有大量的谷氨酸,但是GS-CHO细胞优先利用谷氨酰胺。培养至 72 h后,培养基中的谷氨酰胺维持低浓度(约0.4 mmol/L),与此同时培养上清中的谷氨酸和氨的浓度下降。这说明,只有当谷氨酰胺浓度耗竭或处于低浓度时,细胞才利用谷氨酰胺合成酶将谷氨酸和氨合成谷氨酰胺供细胞生长和产物合成所需。
在参与GS-CHO细胞生长、代谢的氮源底物中,除了谷氨酸和谷氨酰胺以外,还包括必需氨基酸,如酪氨酸(Tyr)、胱氨酸(Cys)、组氨酸(His)、甲硫氨酸(Met)、苯丙氨酸(Phe)、赖氨酸(Lys)、色氨酸(Trp)、缬氨酸(Val)、苏氨酸(Thr)、精氨酸(Arg)、亮氨酸(Leu)、异亮氨酸(Ile)、脯氨酸(Pro),以及可自主合成的非必需氨基酸,如丙氨酸(Ala)、甘氨酸(Gly)、天冬氨酸(Asp)、天冬酰胺(Asn)、丝氨酸(Ser)。对批次培养每24 h的培养上清进行氨基酸含量检测分析,并采用营养物累积消耗回归方法计算氨基酸的比消耗速率(表 2)。结果显示工程细胞株对不同氨基酸的消耗速率差异较大。精氨酸、亮氨酸、异亮氨酸、赖氨酸、脯氨酸、苏氨酸和缬氨酸比消耗速率较大。而Excell302培养基中初始的氨基酸对于特定的工程细胞株来说是不平衡的,需要在流加培养过程中对一些氨基酸进行补偿,以平衡营养供应,提高氨基酸的综合利用效率。

图2 GS-CHO细胞批培养中的葡萄糖与丙酮酸代谢Fig.2 Metabolism of glucose and pyruvate in batch culture of GS-CHO.

图3 GS-CHO细胞批培养中的谷氨酰胺与谷氨酸代谢Fig.3 Metabolism of glutamine and glutamate in batch culture of GS-CHO cells.
2.1.4 磷酸根的代谢
磷是磷脂双分子层的重要组成,而且也是各种酶反应的底物或中间物。磷酸根在工程细胞株发酵过程中消耗较大,比消耗速率约为 0.267 mmol/(109cell·day),而在高密度培养后期,商业培养基中初始的磷酸根浓度(≈6.5 mmol/L)显然不能满足细胞对磷酸根的需求(图4)。因此需要在流加培养过程中添加适量的磷酸根,避免磷酸根的耗竭。

表 2 批培养过程中氨基酸的比消耗速率及商业培养基中氨基酸的浓度Table 2 Specific rates of amino acids in batch culture and the concentration of those in Excell302
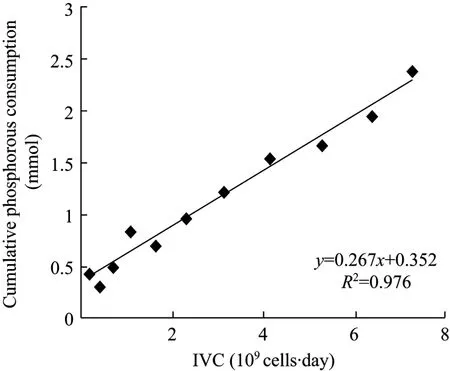
图4 批培养过程中磷酸根离子浓度变化Fig.4 Concentrations of phosphorous in batch culture.
2.1.5 乳酸与氨的生成
乳酸和氨是动物细胞培养过程中两个最主要的有毒副产物。然而对于GS-CHO来说,细胞能够利用谷胺酰氨合成酶将谷氨酸和氨合成谷胺酰氨。因此在整个培养过程中氨浓度的变化并不显著,氨的最大浓度为4.2 mmol/L,并且随着谷胺酰氨耗竭,氨浓度缓慢降低。而乳酸在葡萄糖富裕时大量生成,比生成速率约为6.03 mmol/(109cells·day),乳酸平均产率Ylac/Glu约为1.4 mmol/mmol(图5)。说明此阶段约有60%的葡萄糖经过糖酵解途径生成丙酮酸后,在乳酸脱氢酶的作用下生成了代谢副产物乳酸。
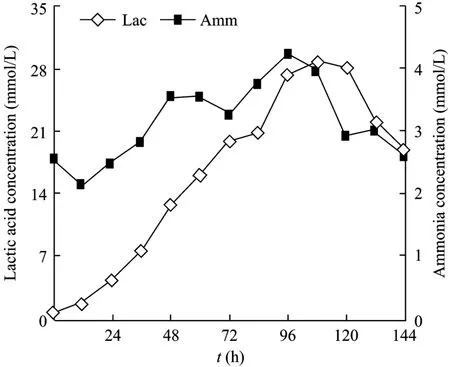
图5 乳酸和氨的生成Fig.5 Production of lactic acid and ammonia in batch culture.
从以上对营养物质和代谢副产物的分析可知,利用流加培养技术提高重组 CHO细胞表达TNFR-Fc融合蛋白的重点应集中于优化各营养物质的供给,并且减少乳酸的生成和控制渗透压的累积。
2.2 流加过程中葡萄糖的控制
葡萄糖检测简便快速,且是细胞生长主要的能量供体。另外细胞在高浓度葡萄糖存在的情况下会生成大量的乳酸,对细胞产生毒害作用。因此选择葡萄糖作为流加培养过程中反馈控制参数,指导其余营养物的添加。
在2 L反应器中进行了营养富裕的批次培养实验,考察葡萄糖浓度对细胞生长和代谢的影响。初始葡萄糖浓度为50 mmol/L,培养基中氨基酸、磷酸根、金属离子、维生素均充足,在批次培养结束时上述营养物均未构成限制。因此葡萄糖成为细胞生长、代谢和产物合成差异的主要影响因素。图6表示培养过程中葡萄糖浓度与细胞比生长速率和乳酸比生成速率之间的关系。当葡萄糖浓度大于5 mmol/L时,GS-CHO细胞的比生长速率基本保持稳定,约为0.60~0.80 day−1。而当其浓度低于5 mmol/L时,细胞的比生长速率明显下降(图6A)。另外,批培养初期,由于葡萄糖充分富裕,乳酸的平均比生成速率最大,大于10 mmol/(109cells·day),且乳酸产率大于 2。说明除大量的葡萄糖通过乳酸脱氢酶转化为乳酸外,由其他氨基酸生成的中间代谢物丙酮酸也未进行完全氧化,一部分从生成乳酸途径溢出。随着葡萄糖的消耗,乳酸的比生成速率也随之降低。当葡萄糖浓度小于10 mmol/L时,乳酸的比生成速率小于 5.0 mmol/(109cells·day)(图6B)。综上所述,当葡萄糖在5~10 mmol/L范围内,细胞的生长没有受到限制且有效地控制了乳酸的生成。

图6 培养过程中葡萄糖浓度与细胞比生长速率、乳酸生成速率之间的关系Fig.6 Relationship of glucose concentration, cell growth rate, and lactic acid production rate.
2.3 工程细胞株在流加培养中生长和产物表达情况
在重组肿瘤因子受体融合蛋白的流加培养生产过程研究中,依据理性设计方法确定营养均衡的流加培养基。培养过程中通过葡萄糖控制模型对其进行反馈控制,维持葡萄糖浓度5~10 mmol/L。经过9.5 d流加培养,最大细胞密度和最终蛋白产量比批次培养分别提高了3.3倍和3倍,达到9.4×106cells/mL和207 mg/L(表3)。流加培养过程中融合蛋白的比生成速率比批次培养略有降低,因此最终融合蛋白浓度增加的主要原因是细胞密度的提高和培养时间的延长。另外培养环境中各营养物质浓度波动不大(±20%),仅有几个生成氨基酸如甘氨酸、谷氨酸、天冬氨酸有明显增加。结果说明此动态流加培养过程不仅显著提高细胞密度和TNFR-Fc的产量,而且保持培养环境的稳定。
3 结论
在动物细胞培养过程中,营养物限制和代谢副产物积累是一对主要矛盾,是限制细胞生长和过程产率的关键因素。而对于 GS系统的细胞,由于谷胺酰氨合成酶的引入,代谢副产物氨的累积将不再是导致培养结束的主要抑制因素[13]。因此通过有效的培养基组分设计和培养控制策略,合理地向细胞持续提供所需的营养物质,减缓乳酸和渗透压的累积,维持培养环境的稳定,是实现高密度、高表达流加培养过程的核心。

表3 流加培养与批培养参数的比较Table 3 Comparison of batch and fed-batch data for GS-CHO
本实验根据GS-CHO细胞的代谢特性,以动力学参数分析为基础,定量添加特定的营养物质作为营养补偿,提高培养基中营养物的综合利用效率。另外以葡萄糖为关键控制参数,通过离线测定培养上清葡萄糖的浓度反馈控制流加培养过程。在流加培养过程中,乳酸比生成速率比批次培养降低40%,活细胞密度相应提高且延长了生产周期,最终产量也得到了相应地提高。
单位体积培养液的抗体产量与宿主细胞的抗体表达水平、培养过程中活细胞密度和培养周期有着密切的关系。此流加培养过程中最终产物浓度的增加主要是因为培养过程中活细胞密度增加和培养周期延长,而细胞本身的蛋白表达水平略有下降。因此,通过改变培养参数(温度、溶氧水平、pH和渗透压)和添加一些刺激细胞蛋白表达的化学物质(DMSO、丁酸钠)等方法提高重组蛋白在宿主细胞内的表达水平,可望进一步提高最终融合蛋白浓度[14-15]。
REFERENCES
[1]Birch JR, Racher AJ.Antibody production.Adv Drug Deliv Rev, 2006, 58: 671−685.
[2]Bibila TA, Robinson DK.In pursuit of the optimal fed-batch process for monoclonal antibody production.Biotechnol Prog, 1995, 11: 1−13.
[3]Ryll T, Valley U, Wagner R.Biochemistry of growth inhibition by ammonium ions in mammalian cells.Biotechnol Bioeng, 1994, 44: 184−193.
[4]Hansen HA, Emborg C.Influence of ammonium on growth, metabolism, and productivity of a continuous suspension Chinese hamster ovary cell culture.Biotechnol Prog, 1994, 10: 121−124.
[5]Chen KQ, Xie L, Wang DIC, et al.Engineering of a mammalian cell line for reduction of lactate formation and high monoclonal antibody production.Biotechnol Bioeng,2001, 72: 55−61.
[6]Sauer PW, Burky JE, Qu LM, et al.A high-yielding,generic fed-batch cell culture process for production of recombinant antibody.Biotechnol Bioeng, 2001, 67:585−597.
[7]Dempsey J, Ruddock S, Osborne M, et al.Improved fermentation processes for NS0 cell lines expressing human antibodies and glutamine synthetase.Biotechnol Prog, 2003, 19: 175−178.
[8]Stansfield SH, Dinnis DM, Allen EE, et al.Dynamic analysis of GS-NS0 cells producing a recombinant monoclonal antibody during fed-batch culture.Biotechnol Bioeng, 2007, 97: 410−424.
[9]Zhou WC, Rehm J, Europa A, et al.Alteration of mammalian cell metabolism by dynamic nutrient feeding.Cytotechnolngy, 1997, 24: 99−108.
[10]Zhou WC, Chen CC, Buckland B, et al.Fed-batch culture of recombinant NS0 myeloma cells with high monoclonal antibody production.Biotechnol Bioeng, 1997, 55:783−792.
[11]Wlaschin KF, Hu WS.Fedbatch culture and dynamic nutrient feeding.Adv Biochem Engin/Biotechnol, 2006,101: 43−74.
[12]Murphy J, Riley JP.A modified single solution method for the determination of phosphate in natural waters.Anal Chim Acta, 1962, 27: 31−36.
[13]Barnes LM, Bentley CM, Dickson AJ.Advances in animal cell recombinant protein production: GS-NS0 expression system.Cytotechnology, 2000, 32: 109−123.
[14]Kimurat R, Miller WM.Effects of elevated pCO2and/or osmolality on the growth and recombinant tPA production of CHO cells.Biotechnol Bioeng, 1996, 52: 152−160.
[15]Ma ZY, Yi XP, Zhang YX.Enhanced intracellular accumulation of recombinant HBsAg in CHO cells by dimethyl sulfoxide.Process Biochem, 2008, 43: 690−695.
Development of a fed-batch process for TNFR-Fc producing GS-CHO cells
Li Fan, Liang Zhao, Yating Sun, Tianci Kou, and Wensong Tan
State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China
Received:September 16, 2009;Accepted:November 11, 2009
Corresponding author:Wensong Tan.Tel: +86-21-64250948; Fax: +86-21-64252250; E-mail: wstan@ecust.edu.cn

