聚乙烯亚胺包裹小环DNA形成的纳米颗粒传输外源基因的性质表征
张超,刘鹤,高诗娟,黄文林,3,王宗烨
1 中国科学院微生物研究所 中国科学院病原微生物与免疫学重点实验室,北京 100101 2 解放军第306医院放疗中心,北京 100101 3 中山大学附属肿瘤医院,广州 510060
聚乙烯亚胺包裹小环DNA形成的纳米颗粒传输外源基因的性质表征
张超1,刘鹤1,高诗娟1,黄文林1,3,王宗烨2
1 中国科学院微生物研究所 中国科学院病原微生物与免疫学重点实验室,北京 100101 2 解放军第306医院放疗中心,北京 100101 3 中山大学附属肿瘤医院,广州 510060
聚乙烯亚胺(PEI)是一种具有良好生物安全性和生物相容性的非病毒载体,能高效转染肿瘤细胞。小环DNA是一种去除质粒细菌骨架,只含有目的基因表达框的环状DNA分子。与普通质粒相比,小环DNA具有表达效率高、持续时间长的优势。使用PEI包裹携带报告基因gfp和抑癌基因pten小环DNA载体,并利用各种技术手段分析了该传输系统的理化性质和生物学效应。凝胶阻滞实验、电镜实验及MTT实验分析结果表明利用PEI包裹小环DNA和质粒DNA体系性质无显著的差别,并且2种复合物对细胞毒性亦无明显差别;但是动态光散射实验结果显示由于PEI可以包裹更多数量的小环DNA,所以PEI包裹小环DNA形成的复合物粒径要略大于包裹质粒DNA形成的复合物粒径。荧光显微镜实验、real-time PCR分析和Western blotting 分析结果表明,PEI包裹小环DNA形成的复合物对细胞的转染效率要远远高于PEI包裹质粒DNA所形成的复合物,并且小环所携带的外源基因的表达效率要远远高于质粒DNA所携带的外源基因的表达效率。实验结果表明,PEI包裹小环DNA形成的纳米颗粒在细胞转染过程中具有很高的表达效率,这一研究结果为PEI包裹小环DNA的非病毒载体系统在传输外源基因过程中的应用提供理论基础和技术支持。
聚乙烯亚胺,小环DNA,gfp基因,pten基因,纳米颗粒,基因传输
Abstract:Polyethylenimine(PEI)is one of the most characterized non-viral vectors.It can condense DNA in a good manner and achieve high transfection efficiency.Minicircle DNA(mc-DNA)is a novel kind of supercoiled DNA which is devoid of bacterial backbone.mc-DNA is superior to conventional DNA for its higher transfection effciciency and longer time-span.In this study, we combined PEI and mc-DNA in gene delivery system.We investigated the physicochemical and biochemical effects of this non-viral system and further explore its potential in tumor gene therapy.mc-DNA was obtained by recombination of parentalplasmid in the presence of L-arabinose, and complexed with PEI.The results of transmission electron microscopy and scanning electron microscopy showed that the particles were spherical and homogeneous.Through gel retardation assay and MTT assay, we found that there were no obvious differences in binding capability of PEI to mc-DNA and plasmid DNA, as well as in cytotoxicity.The results of dynamic light scattering showed that the size of PEI/mc-DNA was about 68 nm, a slight larger than that of PEI/plasmid DNA.Furthermore, the tumor cells transfected with mc-GFP showed higher GFP expression level than that of conventional plasmid.The same results were achieved in the cells treated with tumor-suppressor gene pten, assayed by RT-PCR and Western blot.It indicates that the system of PEI/minicircle DNA is promising in gene transfer.
Keywords:polyethylenimine, minicircle DNA,gfp,pten, nanoparticle, gene delivery
基因传输系统是当前研究的一个热点。目前用于基因传输的载体可分为病毒载体和非病毒载体 2种。与病毒载体相比,非病毒载体具有安全性高、容易制备和修饰、基因容量大的优势[1-2]。其中,聚阳离子化合物聚乙烯亚胺(PEI)是研究最多和最有效的非病毒载体之一。PEI具有“质子海绵效应”,因此能够很好地复合带负电荷的DNA分子,并且能够将复合的 DNA 运送到细胞核内,实现有效的基因转染[3-5]。小环 DNA是一种去除了细菌骨架,而只含有目的基因表达框的新型环状DNA,它是由母环质粒DNA在ΦC31重组酶的诱导下重组产生的。研究表明,与普通质粒相比,小环DNA具有表达效率高、表达时间长的优势[6-9]。除此之外,小环DNA因为缺乏质粒 DNA 中的抗性基因,因此更为安全[10]。Park等利用PEI包裹携带脂联素基因的小环DNA治疗II型肥胖糖尿病小鼠,取得了比使用普通质粒系统更好的治疗效果[11]。但是关于PEI包裹小环DNA这一传输体系的理化性质,以及它在肿瘤细胞中的生物学效应等方面的研究尚未见报道。因此,本研究用PEI包裹携带报告基因gfp和抑癌基因pten的小环DNA,并利用各种技术手段比较该体系相对质粒DNA体系的理化和生化性质的差别,探讨PEI包裹小环 DNA的非病毒载体系统在基因传输中应用的可行性,并为探索该系统在肿瘤基因治疗中的应用提供前期的理论基础和技术支持。
1 材料与方法
1.1 质粒、菌种和细胞
p2ΦC31质粒由美国斯坦福大学陈志英教授惠赠;pEGFPN1质粒购自美国Clontech公司;pBS-T载体和大肠杆菌TOP10购自中国TIANGEN生物科技有限公司;pShuttle和pCDNA3.1-PTEN由本实验室保存。人转化肾上皮细胞系293T、人乳腺癌细胞系 MCF-7、人宫颈癌细胞系HeLa和人肝癌细胞系HepG2购自美国ATCC。
1.2 主要试剂和材料
L-阿拉伯糖、树枝状聚乙烯亚胺(Polyethylenimine,PEI,MW 25 kDa)、噻唑蓝(MTT)、二甲基亚砜(DMSO)等购自美国Sigma-Aldrich公司;限制性内切酶和连接酶购自日本 TaKaRa公司;胎牛血清购自Hyclone公司;DMEM购自美国Gibco公司;质粒提取试剂盒和TRNzol Total RNA Reagent 购自中国TIANGEN生物科技有限公司;M-MLV逆转录酶系统购自美国Promega公司;抗PTEN鼠多克隆抗体、HRP标记羊抗鼠IgG抗体购自中山金桥公司。
1.3 质粒构建
1.3.1p2ΦC31-EGFPN1质粒的构建
用BglII 和BamH I双酶切pEGFPN 1质粒,将得到的载体片段进行自连,转化大肠杆菌TOP10,挑取氨苄抗性克隆,酶切鉴定,获得pEGFPN1-2。以pEGFPN1-2质粒为模板扩增得到 CMV-EGFP-polyA的基因片段,上游引物:5′-GGACTAGT GTAATC AATTACGGGGTCATTAG-3′,下游引物:5′-GGACT AGT CGCCTTAAGATACATTGATGAGT-3′(下划线代表SpeI酶切位点),将得到的目的基因片段克隆到 p2ΦC31载体中,转化大肠杆菌,挑取氨苄抗性克隆,酶切鉴定,获得p2ΦC31-EGFPN1。
1.3.2 p2ΦC31-PTEN质粒的构建
以 pCDNA3.1-PTEN质粒为模板扩增得到pten的基因片段,上游引物:5′-GCTCTAGA ATGACAGC CATCATCAAAGAG-3′(下划线部分为XbaI 酶切位点),下游引物:5′-ATAAGAATGCGGCCGCTCAGACTTTTGTAATTTGTGTAT-3′(下划线部分为NotI酶切位点),将扩增的片段通过XbaI 和NotI双酶切后克隆到 pShuttle载体中,转化大肠杆菌 TOP10,挑取氨苄抗性克隆,酶切鉴定,获得pShuttle-PTEN。用SpeI和EcoR I双酶切 pShuttle-PTEN得到CMV-PTEN-BGH的基因片段,将该片段连入pBS-T载体,转化大肠杆菌 TOP10,挑取氨苄抗性克隆,酶切鉴定,获得pBS-T-PTEN。用SpeI和XhoI双酶切 pBS-T-PTEN,将得到的基因片段克隆到p2ΦC31载体中,转化大肠杆菌,挑取氨苄抗性克隆,酶切鉴定,获得p2ΦC31-PTEN。
1.3.3 小环DNA的诱导和纯化
本实验中的方法步骤是根据 Chen等所介绍的方法稍做改动[7]。将质粒转化的E.coliTOP10接种到 Tris-borate培养基中,过夜摇菌,当OD600约为2.50时离心、收菌,将菌团重悬于原液体积1/4的,含1.5%的L-阿拉伯糖的LB(Amp+)培养基中,在32℃摇床上250 r/min继续振荡培养2~4 h,接下来向菌液中加入其 1/2体积的,含 1%的 L-阿拉伯糖LB(Amp+)培养基(pH 8.0),随之将温度调至37℃,继续振荡培养2~4 h,收集菌体并用质粒提取试剂盒提取小环DNA。
1.4 复合物的理化性质表征
1.4.1 聚阳离子复合物的制备
首先,将一定量的PEI溶于150 mmol/L的NaCl溶液中,用0.22 μm的滤膜(Millipore)过滤除菌得到聚阳离子溶液;将提取的DNA溶于超纯水中。然后,将一定量的聚阳离子溶液滴加到DNA溶液中,边滴加边振荡,并将形成的复合物室温放置15~30 min,制成不同N/P比(PEI中的N原子数/DNA中的P原子数)的复合物(DNA浓度为20 mg/L)。
1.4.2 凝胶阻滞实验
将制备好的复合物在1%(W/V)的琼脂糖胶上进行电泳,电泳缓冲液为 Tris-acetate(TAE),电压为140 V,电泳时间30 min,电泳结束后将胶放在溴化乙锭(EB,0.5 mg/L)中染色5 min,用紫外灯(λ=312 nm)进行观察。
1.4.3 动态光散射法测量颗粒粒径
将制备的聚阳离子复合物以3 000 r/min 离心10 min 去除灰尘颗粒,取上清用动态光散射仪(DynaPro Tian,Wyatt Technology Inc)进行测量。每个样品重复测量3次。
1.4.4 透射电子显微镜(TEM)观察纳米颗粒形态结构
制备PEI/mc-DNA 复合物,将制备的复合物滴加到300目的铜网上,室温孵育5 min,将颗粒用醋酸铀染色5 min,用去离子水洗涤,过夜晾干,样品用透射电子显微镜(JEM-1400,Tokyo,Japan)进行观察。
1.4.5 扫描电子显微镜(SEM)观察纳米颗粒形态结构
用超滤膜收集颗粒,室温下过夜晾干,将样品用金包被,然后用两面导电的胶带裱在一个stub上,用扫描电子显微镜(Quanta 200,FEI company,Holland)进行观察。
1.5 MTT实验
细胞以 104/孔接种于 96孔板(边缘孔用无菌PBS填充),在5% CO2,37℃条件下孵育24 h,之后换为DMEM无血清培养基,并将不同N/P比的复合物加入每孔细胞中。5% CO2,37℃孵育24 h后,每孔加入10 μL MTT溶液(5 g/L),继续培养4 h,吸去孔内培养液,每孔加入100 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解,应用酶联免疫检测仪在OD570处测量各孔的吸光值,计算细胞存活率。
1.6 细胞培养和转染
细胞在含10% 胎牛血清、2 mmol/L L-谷氨酰胺、100 U/mL氨苄和100 mg/L氯霉素的DMEM培养基(37℃,5% CO2)中贴壁生长。转染前将细胞按1×104/孔接种于96孔板的孔中,用含10%胎牛血清的DMEM培养基培养,当细胞浓度达到80%~90%时,将培养基换为DMEM无血清培养基并转染特定 N/P比的复合物,每孔转入质粒的量均为0.3 μg,在 37℃,5% CO2培养箱中孵育 4~6 h,之后用含10% 血清的DMEM培养基换液,继续培养30 h,进行后续的检测。转染细胞中GFP蛋白表达用倒置荧光显微镜(Axiovert200,ZEISS,Germany)检测。
1.7 半定量RT-PCR
收集 5×106的细胞,用 TRNzol Total RNA Reagent并依据其说明书提取总 RNA。取 2 μg RNA,1 μg Random Primer,DEPC 水补至 10 μL;70℃水浴变性5 min;冰上骤冷后加入2 μL dNTPs(10 nmol/L),1 μL RNAse inhibitor,8 μL 5×Reaction Buffer,1 μL M-MLV 逆转录酶,DEPC 水补至 40 μL,37℃水浴1 h。然后进行PCR,PCR的反应条件为:94℃ 5 min,1 个循环;95℃ 30 s,55℃ 30 s,72℃30 s,30个循环;72℃ 终延伸5 min。pten的上游引物:5′-GAACTGGTGTAATGATATGTGCATATT T-3′,下游引物:5′-ATTTTTTGTTAAAGTAAGTAC TAGATAT-3′;β-actin 的上游引物 5′-CTACAATG AGCTGCGTGTGGC-3′,下游引物:5′-CAGGTCCAG ACGCAGGATGGC-3′。
1.8 Western blotting检测蛋白表达
收集处理和未处理的293T细胞,用IP细胞裂解液提取总蛋白,用Bradford法测量蛋白浓度,各取40 μg蛋白进行12%的 SDS-PAGE凝胶电泳,然后在冰上300 mA条件下转膜1 h。5%脱脂奶粉室温封闭2 h,加入一定稀释比例的一抗4℃反应过夜,用TBST洗涤3次,再加连接有辣根过氧化物酶的二抗室温孵育1 h,然后用凝胶成像仪检测。
2 结果
2.1 重组母环质粒和小环DNA的酶切鉴定
小环 DNA的诱导过程如图1所示。p2ΦC31-EGFPN1 用SpeI单酶切得到约大于10 kb的片段,与预期结果一致(图2A)。p2ΦC31-PTEN用插入位点SpeI和XhoI双酶切得到约9.7 kb的载体片段和约2.3 kb的pten基因片段,与预期结果一致(图2C)。pShuttle-PTEN用插入位点XbaI和NotI双酶切得到约4.0 kb的载体片段和约1.2 kb的pten基因片段,与预期一致(图2E)。小环DNA 的电泳和酶切电泳结果显示(图2B,D),诱导产生得到的minicircle-GFP(mc-GFP)和minicircle-PTEN(mc-PTEN)的电泳条带很亮,相比较而言,残余的母环和细菌骨架条带比较弱。信号强度分析显示mc-GFP和mc-PTEN的得率均占总DNA的95%以上,说明实验中小环的诱导比较完全。
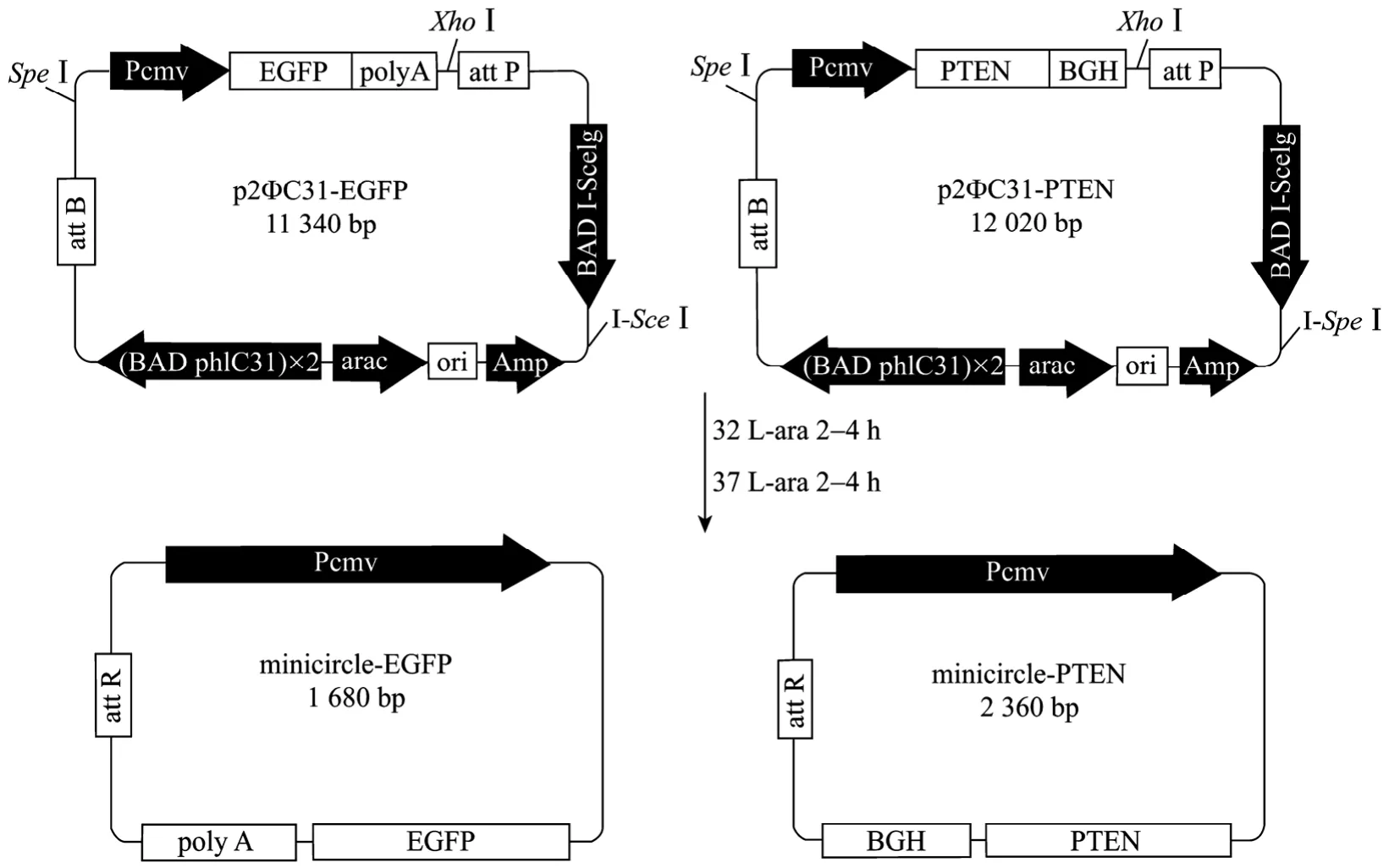
图1 p2ΦC31-EGFPN1和p2ΦC31-PTEN质粒诱导产生小环DNA的示意图Fig.1 Diagrams of p2ΦC31-EGFPN1or p2ΦC31-PTEN and production of mc-GFP or mc-PTEN.Flow chart of ΦC31 integrase-mediated intramolecular recombination of p2ΦC31-EGFPN1 and p2ΦC31-PTEN.The resulting products are mc-GFP and mc-PTEN, respectively.BAD: araBAD promoter; araC: araC repressor; attB: bacterial attachment site; attP: phage attachment site;attR: right hybrid sequence; Amp: ampicillin resistance gene.

图2 p2ΦC31-EGFPN1、p2ΦC31-PTEN和pShuttle-PTEN质粒及小环mc-GFP和mc-PTEN的酶切鉴定Fig.2 Identification of DNA with(+)or without(-)enzyme digestion.(A)p2ΦC31-EGFPN1 and(B)mc-GFP digested with or withoutXhoI.(C)p2ΦC31-PTEN and(D)mc-PTEN digested with or withoutSpeI andXhoI.(E)pShuttle-PTEN digested with or withoutXbaI andNotI.M: DNA marker.
2.2 DNA迁移实验比较PEI复合DNA的能力
小环DNA因为去除了细菌骨架,所以比普通质粒DNA要小(图1)。由于之前的研究表明,聚阳离子在复合大小存在差异的质粒和siRNA 的能力上存在明显区别[12-13],所以在本实验中,凝胶阻滞实验被用来评价小环DNA与质粒DNA大小的差别是否影响 PEI复合两者的能力。结果显示(图3),聚合物PEI在复合两种DNA的能力上没有明显区别。在N/P比为4或大于4时,未观测到有质粒DNA和小环DNA的条带,说明当N/P值为4时,PEI能够完全复合这2种DNA。

图3 凝胶阻滞实验比较PEI复合质粒DNA和小环DNA的能力Fig.3 Agarose gel electrophoresis of(A)pEGFPN1 and(B)mc-GFP complexed by PEI at different N/P ratios.Complete retardation of PEI/pEGFPN1 and PEI/mc-GFP were achieved at N/P ratio of 4.
2.3 动态光散射实验考察颗粒粒径
通过动态光散射法测量PEI复合质粒DNA和小环DNA后形成的纳米颗粒的粒径,结果显示复合物PEI/pEGFPN1的粒径为(62.4±0.8)nm,复合物PEI/mc-GFP的粒径为(68.4±1.8)nm。PEI复合小环DNA形成的颗粒的粒径大于复合质粒DNA形成的颗粒粒径,结果与之前Park等的报道相符合[11]。这可能是由于颗粒内小环 DNA的拷贝数多于质粒DNA的拷贝数引起的。
2.4 电镜观察纳米颗粒形态结构
通过透射电镜(TEM)和扫描电镜(SEM)观察PEI复合小环DNA形成的纳米颗粒的形态结构,从图中可以看出复合物 PEI/mc-DNA能够形成大小均一、形态规则的纳米颗粒(图4)。

图4 透射电子显微镜和扫描电子显微镜观察颗粒的形态Fig.4 Transmission electron microscopy and Scanning electron microscopy of PEI/mc-DNA polyplexes.The polyplexes were formed in 150 mmol/L NaCl solution with a DNA concentration of 20 mg/L and observed by(A)TEM and(B)SEM.The polyplexes were pointed by arrow.
2.5 MTT法检测复合物对细胞的毒性
我们用MTT法考察小环DNA和质粒DNA形成复合物对细胞毒性的影响,从图5中可以发现,2种复合物对细胞的毒性随着N/P比的增加而增加,PEI复合小环DNA及复合质粒DNA形成的纳米颗粒对细胞毒性的影响没有明显的区别。
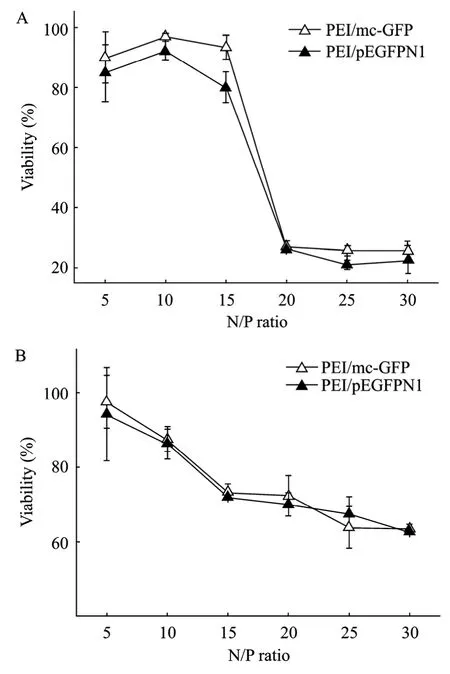
图5 MTT法检测复合物的细胞毒性Fig.5 Cytotoxicity evaluated with the MTT assay in HepG2(A)and HeLa(B)cells.Results are presented as±s.
2.6 携带gfp基因的小环DNA和质粒DNA的表达量的比较
荧光显微镜观察 293T、MCF-7、HeLa 细胞中GFP的表达,结果显示(图6)2种复合物在不同细胞中均有较高的转染效率,并且复合物PEI/mc-GFP的转染效率在不同细胞中均高于复合物 PEI/pEGFPN1的转染效率。表明转染小环DNA形成的复合物具有比普通质粒系统更高的表达效率。
2.7 RT-PCR比较携带pten基因的小环DNA和质粒DNA的表达量
为进一步探索PEI复合小环DNA的载体系统应用到肿瘤基因治疗中的可行性,从RNA水平和蛋白水平比较携带抑癌基因pten的小环 DNA和质粒DNA系统的表达量。
RT-PCR的结果显示(图7),转染了复合物PEI/mc-PTEN的293T、MCF-7、HeLa细胞中PTEN的表达量明显高于转染了复合物PEI/p2ΦC31-PTEN细胞中的水平,表明比起普通质粒系统,携带pten基因的小环DNA系统具有更高的mRNA转录水平。
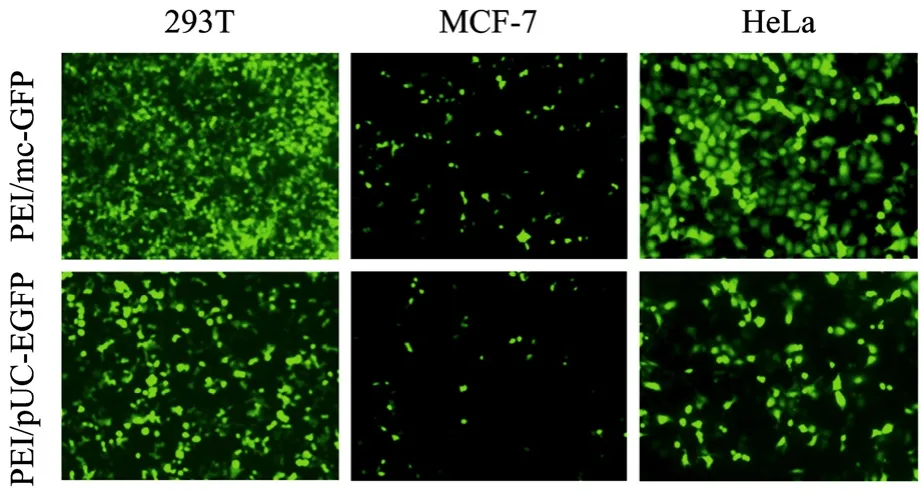
图6 PEI复合质粒DNA和小环DNA形成的纳米颗粒转染细胞后GFP表达量的比较(100×)Fig.6 Gene transfection efficiency examined by GFP expression in varied cells at N/P ratio of 15(100×).

图7 RT-PCR比较小环DNA体系和普通质粒DNA体系转染的细胞中mRNA水平Fig.7 Analysis of PTEN expression by RT-PCR.Total RNA was extracted, reverse transcribed, and amplified.RT-PCR was carried.1: pCDNA; 2: mc-PTEN; 3: p2ΦC31-PTEN.
2.8 Western blotting比较携带 pten基因的小环DNA和质粒DNA在细胞中的表达效率
Western blotting 实验结果表明(图8),mc-PTEN转染的 293T细胞中 PTEN的表达量显著高于p2ΦC31-PTEN转染的细胞中PTEN的表达量,进一步从蛋白表达水平说明小环 DNA系统比普通质粒DNA系统具有更高的表达效率。而mc-PTEN 转染的MCF-7细胞中这种差别不是很明显,这可能是由于MCF-7的转染效率比较低造成的。

图8 Western blotting比较小环DNA体系和质粒DNA体系转染的细胞中PTEN基因的蛋白表达效率Fig.8 Protein expression of PTEN in human 293T cells and MCF-7 cells by Western blotting assay.1: pCDNA; 2:mc-PTEN; 3: p2ΦC31-PTEN.
3 讨论
在过去的研究报道中,小环DNA在细胞水平的转染主要是通过脂质体介导的,而用 PEI运载小环DNA的研究仅有 Park等组成的研究小组进行过相关报道[11]。他们利用PEI运载携带脂联素基因的小环DNA治疗 II型肥胖小鼠,动物实验结果显示使用小环 DNA系统携带的脂联素基因的表达量显著高于使用普通质粒系统的表达量。除此之外,关于PEI包裹小环DNA这一传输体系的理化性质,以及它在肿瘤细胞中的生物学效应等方面的研究还没有相关报道。本研究用 PEI包裹携带报告基因gfp和抑癌基因pten的小环DNA,并利用各种技术手段比较该体系相对质粒 DNA体系的理化和生化性质的差别,探讨PEI包裹小环DNA的非病毒载体系统在肿瘤细胞基因传输中的可行性。
研究结果表明PEI能够很好的复合小环DNA,并且形成均一规则的纳米颗粒,颗粒的粒径大小为(68.4±1.8)nm。研究表明100 nm左右的纳米颗粒,通过血液循环后能够很好地富集到肿瘤部位,这主要是由于肿瘤血管存在着200~400 nm的空隙,小于这个尺寸的纳米颗粒能够通过并到达肿瘤组织,这种性质被称为 enhanced permeability and retention effect(EPR)效应[2,14]。因此,将PEI复合小环DNA的纳米颗粒应用于肿瘤基因治疗中,可能能够实现被动靶向肿瘤组织,从而减少毒副作用。
通过对理化性质的研究发现,PEI复合小环DNA和复合质粒DNA差别并不是很明显,但是比较两者转染肿瘤细胞后GFP的表达发现,相比较质粒DNA系统来说,小环DNA系统能够实现更为高效的表达。由于理化性质无明显差别,因此这种差别主要是由于小环DNA自身的优势引起的。研究表明,质粒DNA中的细菌骨架能够在空间上顺式抑制基因的转录,小环DNA由于去除了细菌骨架而去除了这种抑制作用,因此能够实现更为高效的表达[15]。
为了进一步探讨PEI运载小环DNA的基因传输系统在肿瘤治疗中的潜在价值,本研究将抑癌基因pten引入到这一系统中,结果进一步表明小环DNA系统比普通质粒DNA系统具有更高的表达优势,因此能够发挥更强的抑癌效果。之前有研究应用小环DNA携带 IFNγ治疗鼻咽癌的荷瘤小鼠,并且取得良好的效果,小环DNA在IFNγ的表达量和治疗效果方面都有明显的优势[16]。本研究的结果为小环 DNA在肿瘤基因治疗方面的可行性提供了理论基础和技术支持。
然而,PEI复合小环DNA的载体系统和普通质粒系统类似[17],能够导致较大的细胞毒性,因此以后的研究仍需要进一步对该系统进行修饰和改良,减少对细胞的毒性和机体的损伤。
综上所述,PEI复合小环DNA能够形成均一规则的纳米颗粒,而且形成的复合物在肿瘤细胞转染中具有比普通质粒系统更高的表达优势。研究表明PEI复合小环DNA的载体系统在基因传输中具有比较显著的优势。
REFERENCES
[1]Niidome T, Huang L.Gene therapy progress and prospects:nonviral vectors.Gene Ther, 2002, 9(24): 1647−1652.
[2]Davis ME, Chen ZG, Shin DM.Nanoparticle therapeutics:an emerging treatment modality for cancer.Nat Rev Drug Discov, 2008, 7(9): 771−782.
[3]Godbey WT, Wu KK, Mikos AG.Poly(ethylenimine)and its role in gene delivery.J Control Release, 1999, 60(2/3):149−160.
[4]Godbey WT, Wu KK, Mikos AG.Tracking the intracellular path of poly(ethylenimine)/DNA complexes for gene delivery.Proc Natl Acad Sci USA, 1999, 96(9): 5177−5181.
[5]Sonawane ND, Szoka FC, Verkman, AS.Chloride accumulation and swelling in endosomes enhances DNA transfer by polyamine-DNA polyplexes.J Biol Chem,2003, 278(45): 44826−44831.
[6]Chen ZY, He CY, Ehrhardt A,et al.Minicircle DNA vectors devoid of bacterial DNA result in persistent and high-level transgene expressionin vivo.Mol Ther, 2003,8(3): 495−500.
[7]Chen ZY, He CY, Kay MA.Improved production and purification of minicircle DNA vector free of plasmid bacterial sequences and capable of persistent transgene expressionin vivo.Hum Gene Ther, 2005, 16(1): 126−131.
[8]Darquet AM, Cameron B, Wils P,et al.A new DNA vehicle for nonviral gene delivery: supercoiled minicircle.Gene Ther, 1997, 4(12): 1341−1349.
[9]Darquet AM, Rangara R, Kreiss P,et al.Minicircle: an improved DNA molecule forin vitroandin vivogene transfer.Gene Ther, 1999, 6(2): 209−218.
[10]Jia F, Wilson KD, Sun N,et al.A nonviral minicircle vector for deriving human iPS cells.Nature methods, 2010,7(3): 197−199.
[11]Park JH, Lee M, Kim SW.Non-viral adiponectin gene therapy into obese type 2 diabetic mice ameliorates insulin resistance.J Control Release, 2006, 114(1): 118−125.
[12]Shim MS, Kwon YJ.Controlled cytoplasmic and nuclear localization of plasmid DNA and siRNA by differentially tailored polyethylenimine.J Control Release, 2009,133(3): 206−213.
[13]Stevenson M, Ramos-Perez V, Singh S,et al.Delivery of siRNA mediated by histidine-containing reducible polycations.J Control Release, 2008, 130(1): 46−56.
[14]Shchors K, Evan G.Tumor angiogenesis: cause or consequence of cancer?Cancer Res, 2007, 67(15):7059−7061.
[15]Chen ZY, Riu E, He CY,et al.Silencing of episomal transgene expression in liver by plasmid bacterial backbone DNA is independent of CpG methylation.Mol Ther, 2008, 16(3): 548−556.
[16]Wu J, Xiao X, Zhao P,et al.Minicircle-IFNgamma induces antiproliferative and antitumoral effects in human nasopharyngeal carcinoma.Clin Cancer Res, 2006, 12(15):4702−4713.
[17]Kunath K, von Harpe A, Fischer D,et al.Low-molecularweight polyethylenimine as a non-viral vector for DNA delivery: comparison of physicochemical properties,transfection efficiency andin vivodistribution with high-molecular-weight polyethylenimine.JControl Release, 2003, 89(1): 113−125.
Polyethylenimine and minicircle DNA based gene transfer
Chao Zhang1, He Liu1, Shijuan Gao1, Wenlin Huang1,3, and Zongye Wang2
1 CAS Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China 2 Radiotherapy Center, the 306thHospital of P.L.A, Beijing 100101, China 3 State Key Laboratory of Oncology in South China, Cancer Center, Sun Yat-sen University, Guangzhou 510060, China
Received:March 9, 2010;Accepted:April 7, 2010
Supported by:Knowledge Innovation Program in Chinese Academy of Sciences(No.KSCX1-YW-R-10), National Natural Science Foundation of China(Nos.30901751, 30973448), National Basic Research Program of China(973 Program)(No.2010CB529904).
Corresponding author:Zongye Wang.Tel: +86-10-64872016; E-mail: wangzye@163.com中国科学院知识创新工程基金项目(No.KSCX1-YW-R-10),国家自然科学基金(Nos.30901751, 30973448),国家重点基础研究发展计划项目(973计划)(No.2010CB529904)资助。

