抗坏血酸、表皮生长因子和促卵泡素对绵羊卵巢皮质体外培养的影响
彭夏雨,汪立芹,杨梅,陈童,郭志勤
1 石河子大学动物科技学院,石河子 832000 2 新疆畜牧科学院中国-澳大利亚绵羊育种研究中心 中国农业部草食家畜繁育生物技术重点开放实验室 动物生物技术重点开放实验室,乌鲁木齐 830000 3 大连市金州区动物卫生防疫监督管理局,大连 116037
抗坏血酸、表皮生长因子和促卵泡素对绵羊卵巢皮质体外培养的影响
彭夏雨1,2,汪立芹2,杨梅3,陈童2,郭志勤2
1 石河子大学动物科技学院,石河子 832000 2 新疆畜牧科学院中国-澳大利亚绵羊育种研究中心 中国农业部草食家畜繁育生物技术重点开放实验室 动物生物技术重点开放实验室,乌鲁木齐 830000 3 大连市金州区动物卫生防疫监督管理局,大连 116037
本研究旨在评估抗坏血酸(VC)、表皮生长因子(EGF)、促卵泡素(FSH)对绵羊原始卵泡体外培养的影响以及它们之间的相互关系。实验按照 2×2×2因子试验设计分为 8组,分别为:MEM(对照组),MEM+VC(50 μg/mL),MEM+EGF(100 ng/mL),MEM+FSH(50 ng/mL),MEM+VC+EGF,MEM+VC+FSH,MEM+EGF+FSH,MEM+VC+EGF+FSH。在培养0(未培养对照组)、2、6、12 d后,对培养的卵巢皮质薄片进行组织学和增殖细胞核抗原(PCNA)检测以及透射电镜(TEM)观察。结果表明,与未培养组(发育卵泡比例 15.4%±1.9%,正常卵泡比例 88.2%±4.6%)比较,所有培养组中发育卵泡比例显著增加(P<0.05),正常卵泡比例下降(P<0.05)。培养12 d后,与对照组(卵泡直径(34.5±3.3)μm,卵泡存活比例(38.9%±3.9%))比较,MEM+VC+FSH 和 MEM+EGF+FSH 组中卵泡直径(分别为(39.7±3.4)μm 和(42.5±5.1)μm)和卵泡存活比例(分别为 58.5%±4.3%和 59.3%±3.7%)都显著提高(P<0.05);各处理组中,培养12 d后,MEM+VC+EGF组中发育卵泡比例(49.3%±3.2%)和卵泡直径((32.3±2.3)μm)最低,颗粒细胞PCNA阳性卵泡比例(26.4%±1.2%)也最少,而MEM+VC+EGF+FSH组中卵泡存活率(59.7%±6.1%)和卵泡直径((42.5±5.1)μm)都显著增加(P<0.05),颗粒细胞 PCNA(43.5%±4.1%,P<0.05)表达增加。电镜结果表明,VC+EGF+FSH组能够维持与正常卵泡类似的超微结构,而在MEM 和MEM+VC+EGF组却显示不同程度的退化特征。本研究结果提示在培养中联合添加VC与EGF抑制卵泡的发育和生长,而联合添加VC、EGF和FSH可能是促进绵羊原始卵泡体外激活和生长,维持卵泡存活以及结构完整的最有效的处理手段之一。
绵羊,原始卵泡培养,抗坏血酸,促卵泡素,表皮生长因子
Abstract:In this study, we evaluated the effects of ascorbic acid(VC), epidermal growth factor(EGF)and follicle stimulating hormone(FSH)onin vitroculture of sheep ovarian cortical tissue.Using 2×2×2 factor experimental design, we cultured sheep ovarian cortex fragments in 8 media with MEM(control), MEM+VC(50 μg/mL), MEM +EGF(100 ng/mL),MEM+FSH(50 ng/mL), MEM+VC+EGF, MEM+VC+FSH, MEM+EGF+FSH, MEM+VC+EGF+FSH.After 0(non-cultured control), 2, 6, 12 days of culture, the pieces of ovarian cortex were proceed to histological and proliferating cell nuclear antigen(PCNA)examination, or observed by transmission electron microscopy(TEM).The percentages of developing follicles were increased(P<0.05)and the percentages of healthy follicles were reduced(P<0.05).When compared to the MEM group, the addition of FSH with VC or EGF promoted a significant increase of follicles diameter and follicles survival rate(P<0.05), and stimulated the proliferation of granulosa cells.After 12 days of culture, medium supplemented with MEM+VC+EGF resulted the lowest proportion of developing follicles(49.3%±3.2%), follicles diameter((32.3±2.3)μm), follicles survival rate(41.6%±3.1%)and the proportion of PCNA stained follicles(26.4%±1.2%,P<0.05).In contrast, MEM+VC+EGF+FSH resulted the highest follicles diameter((42.5±5.1)μm), follicles survival rate(59.7%±6.1%)and proportion of PCNA stained follicles(43.5%±4.1%,P<0.05).Ultrastructural analysis confirmed the integrity of follicles cultured in VC+EGF+FSH group, while follicles cultured in MEM+VC+EGF groups showed more degeneration characters.In conclusion, the addition of VC and EGF to culture medium inhibited follicular development, VC+EGF+FSH was the most effective treatment to maintain follicular integrity and promote sheep primordial follicular activation and growth during in vitro culture.
Keywords:sheep, ovarian tissue, ascorbic acid, follicle stimulating hormone, epidermal growth factor
哺乳动物卵巢皮质内含有大量的原始卵泡,它们代表着雌性的繁殖潜力。而在生理条件下,这些卵泡只有少部分能被激活并发育至成熟排卵阶段,其余在机体发育过程中发生闭锁而退化[1]。研究原始卵泡在体外模式下的激活和发育可以为体外胚胎的生产提供大量潜在的同种卵母细胞来源,对于提高遗传和经济价值动物的繁殖潜力,以及濒危物种的保存具有十分重要的意义。
促性腺激素和生长因子在卵巢功能调节中起着十分重要的作用。促卵泡素(FSH)是一种调节卵巢功能的关键激素,能够刺激颗粒细胞增殖,内固醇激素的合成以及EGF和LH受体的表达,在窦腔形成和卵泡成熟排卵过程中起着关键的作用[2]。在羊卵巢皮质体外培养中发现,添加FSH可以促进卵泡和卵母细胞直径的增长[3],维持卵泡超微结构完整和促进原始卵泡的激活和生长[4]。表皮生长因子(EGF)也参与卵巢发育过程的调节,包括颗粒细胞增殖、分化和类固醇激素的生成[5],其受体在人和仓鼠的原始卵泡到初级卵泡的卵母细胞中均有表达[6-8],而在次级阶段主要在颗粒细胞上表达,具有促进初级卵泡向次级卵泡发育时颗粒细胞有丝分裂的作用[9-10]。最近研究表明,EGF能够与FSH协同作用,促进卵泡和卵母细胞直径的增大,以及卵泡的发育[3,11]。抗坏血酸(VC)是一种抗氧化剂,在生理条件下行使多种细胞保护功能[12]。在卵巢的颗粒细胞、内膜细胞、黄体细胞和卵母细胞中均有蓄积,可以促进卵泡发育进程中胶原的合成,维持卵泡基底膜完整,参与类固醇激素的分泌[13]。卵泡体外培养中添加 VC可以降低卵泡细胞的凋亡[14-15]。最近Rossetto等报道VC可与FSH在体外培养中协同作用维持羊卵泡超微结构完整和促进原始卵泡的激活和生长[2]。但是VC与EGF,以及VC、EGF与FSH是否能同样促进绵羊原始卵泡在体外的生长和发育还未见报道。本研究的目的是通过在体外培养中单独或联合添加 VC、EGF和 FSH,研究它们在绵羊卵巢原始卵泡体外发育中的相互关系。
1 材料与方法
1.1 卵巢的采集与处理及试剂来源
成年绵羊卵巢组织取自当地屠宰场(n=5),采集的卵巢组织保存于 27℃~32℃添加有 100 μg/mL青霉素、100 μg/mL链霉素的PBS缓冲液中,1 h内运回实验室。去除卵巢附属物如脂肪、筋膜等,经洗涤后,从中间对分卵巢,在体视显微镜下分离皮质和髓质,去除可见大卵泡。把分离的皮质切割成1~2 mm3大小,每个样本随即选取2~3块组织用4%多聚甲醛-PBS液或2.5%戊二醛固定,作为新鲜组织未培养对照进行组织学和电镜观察,其余组织进入体外培养实验。在本实验中如无特殊标注,所有化学试剂均购自Sigma公司。
1.2 组织培养及分组
对照组培养基为MEM,添加 0.23 mmol/L丙酮酸钠、2 mmol/L谷氨酰胺、2 mmol/L次黄嘌呤、3 mg/mL BSA、ITS(胰岛素-转铁蛋白-硒:胰岛素10 μg/mL,转铁蛋白 5 μg/mL,亚硒酸钠 6.25 ng/mL),100 μg/mL青霉素、100 μg/mL链霉素。在对照组基础上单独或联合添加 100 ng/mL EGF,50 ng/mL FSH,50 μg/mL抗坏血酸,分为7个实验组,分别为 MEM+VC、MEM+EGF、MEM+FSH、MEM+VC+EGF、MEM+VC+FSH、MEM+EGF+FSH、MEM+VC+EGF+FSH。
处理过的卵巢皮质薄片随机放入预先制好和消毒调平的金属格栅培养体系中,此体系由不锈钢网格支架(25 mm×25 mm×4 mm)和3 mg/mL胶原蛋白预涂层的微孔滤膜(孔径 0.45 μm,Millipoll)以及35 mm培养皿组成。培养时组织块置于微孔滤膜上,间隔5 mm,每个膜上放6块;然后在培养皿中加入培养液至与组织块下端齐平,每个组织块上滴50 μL培养液。放入5% CO2、38.6℃增湿培养箱内培养,每2天换液1次。在培养的第2、6、12天随机取同等数量(n=2)的组织块进行固定,共培养12 d。所有试验重复5次。
1.3 组织学检查
培养前和培养2、6、12 d后的卵巢组织薄片用4%多聚甲醛-PBS液固定,梯度酒精脱水,石蜡包埋,7 μm连续切片,HE染色后光镜观察、计数。卵泡分类标准参考文献[16],分为原始卵泡(卵母细胞外包绕单层扁平状颗粒细胞)和发育卵泡包括过渡卵泡(单层扁平和立方形颗粒细胞混杂的卵泡),初级卵泡(1层立方形或柱状颗粒细胞),次级卵泡(2层以上立方形颗粒细胞)。形态正常卵泡具有完整的卵母细胞,颗粒细胞排列规则,无固缩细胞核,异常卵泡卵母细胞皱褶或颗粒细胞分布杂乱与基底膜分离,核固缩。每个样本切片中每10张计数一次,分别记录各种卵泡数量,每个处理计数 150个卵泡(每次计数30个,作5次重复)。用与Nikon光学显微镜配套的图像处理软件(Nikon DP2-BSW)测量正常卵泡直径(卵母细胞两端颗粒细胞膜之间最大距离,垂直交叉测量2次,平均值为所测卵泡直径)。为避免重复计数,每次记录由相邻切片确定。
1.4 细胞增殖PCNA检测
石蜡切片经常规脱蜡复水后,用0.1%柠檬酸抗体修复液进行抗体热修复,PBS清洗后,按照免疫组化染色试剂盒(中杉金桥,SP9002)说明在每个样本上滴50 μL 3%双氧水室温孵育8 min,以消除内源性过氧化物酶活性;PBS漂洗后,用正常羊血清封闭 10 min,滴加 1∶50稀释的鼠抗羊单克隆PCNA抗体(武汉博士德),4℃过夜;样本常温复温后,用PBS漂洗3次,滴加生物素标记羊抗小鼠IgG,室温孵育12 min后用PBS洗3遍,每次3 min;然后再加入辣根酶标记链酶卵白素室温孵育15 min,PBS洗后DAB染色5~7 min(光镜下观察细胞核呈棕黄色时终止),自来水冲洗,经苏木素复染后,梯度酒精脱水,二甲苯透明,中性树脂封片,光镜下观察。颗粒细胞棕黄判定为PCNA阳性卵泡。
1.5 卵泡超微结构的评估
绵羊卵巢组织小块在 2%多聚甲醛+2.5%戊二醛的0.1 mol/L PBS缓冲液中固定3~4 h经PBS洗后,在1%四氧化锇溶液中固定1 h,PBS漂洗3次,梯度丙酮脱水后,用环氧树脂浸透包埋,3 μm切片,甲苯胺蓝染色光镜下定位形态正常卵泡,经柠檬酸三钴和醋酸双氧铀电子染色后在透射电镜(JEOL TEM-1230)下观察卵泡超微结构变化,如胞质电子密度和完整性、颗粒细胞细胞器、空泡化、基底膜和核膜的完整性等。
1.6 数据分析
为了评估卵泡激活和生长的情况,只有健康卵泡统计卵泡大小和比例。分别用发育卵泡比例,正常卵泡比例和卵泡直径来评估各组中原始卵泡激活、存活和生长情况。颗粒细胞的增殖活性通过统计 PCNA阳性数量来评定。除各处理组培养不同天数后组织中颗粒细胞 PCNA阳性卵泡比例用χ2检验比较外,其他各数据之间的比较均用方差分析和Fisher′s检验来计算。所有计算均用SPSS 13.0完成,所有数据表示为平均值±标准差(±s),P<0.05标记为差异显著。
2 结果
2.1 组织分析结果
2.1.1 原始卵泡的激活和生长
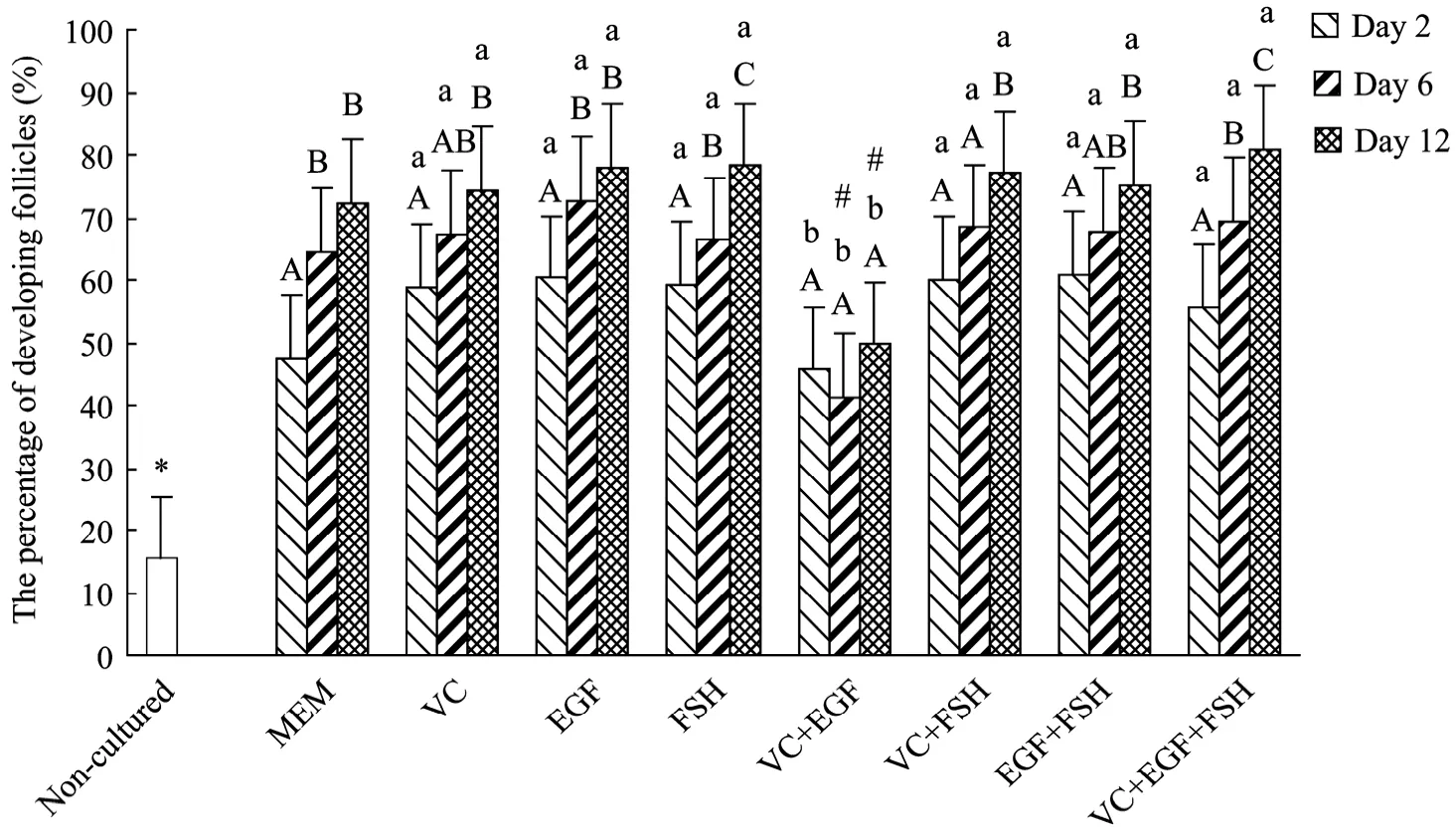
通过试验发现,在未培养组织中原始卵泡比例为 84.6%,发育卵泡的比例为 15.4%。各试验组培养不同天数后组织中发育卵泡比例如图1所示。与未培养对照组比较,所有培养组中发育卵泡比例显著增加(P<0.05)。VC+EGF组除培养2 d后发育卵泡比例(45.1%)与 MEM 对照组(47.5%)之间差异不显著外(P>0.05),在整个培养期内其发育卵泡比例均显著低于 MEM对照组和其他试验组(P<0.05);其他试验组中发育卵泡比例与 MEM 对照组比较,差异不显著(P>0.05)。在 FSH和VC+EGF+FSH组培养2、6、12 d后,发育卵泡比例分别为 59.3%、66.4%、78.2%,55.7%、69.5%、81.0%,各天数之间比较,差异显著(P<0.05);MEM组和EGF组培养6 d和12 d后发育卵泡比例分别为64.6%、69.2%、72.7%、77.5%,显著高于培养2 d后发育卵泡比例(分别为47.5%、60.4%,P<0.05),而在6 d和12 d之间差异不显著(P>0.05);在VC和VC+FSH以及EGF+FSH组内培养12 d后发育卵泡比例分别为74.3%、77.0%、81.0%,显著高于培养2 d后发育卵泡比例(分别为58.9%、60.1%、55.7%,P<0.05),其他天数之间差异不显著;而在VC+EGF组内在培养2、6、12 d后,发育卵泡比例分别为45.6%、41.6%、49.3%,随着培养天数的增加,卵泡发育变化不显著(P>0.05)。
2.1.2 卵泡活力的评估
新鲜组织和培养后组织中正常卵泡比例结果见图2。形态正常卵泡(图3A、3B)具有完整的卵母细胞,颗粒细胞排列规则,无固缩细胞核,异常卵泡(图3C)卵母细胞皱褶或颗粒细胞分布杂乱与基底膜分离,核固缩。与未培养对照组比较(88.2%),只有VC+FSH组(81.9%)和VC+EGF+FSH(76.6%)在培养2 d后正常卵泡比例没有显著下降(P>0.05),其余试验组中正常卵泡比例均显著下降(P<0.05)。培养2 d后,各试验组与MEM对照组(71.8%)比较没有显著差异(P>0.05)。培养 6 d后 VC、VC+FSH、EGF+FSH、VC+EGF+FSH组中正常卵泡比例分别为64.4%、67.1%、63.5%、65.2%,显著高于 MEM 对照组 51.7%(P<0.05),而培养 12 d后,除 VC+EGF组(41.6%)外,其余试验组都显著高于MEM对照组(38.9%)(P<0.05)。在各处理组之间比较,培养12 d后,VC+EGF(41.6%)组显著低于其他处理组(P<0.05)。在同一试验组内,与培养2 d后比较,培养6 d和12 d后所有培养组中正常卵泡比例显著下降(P<0.05),其中MEM对照组(6 d:52.1%,12 d:38.9%)和 VC+EGF 组(6 d:59.3%,12 d:41.6%)在培养6 d和12 d之间差异显著(P<0.05)。
2.1.3 卵泡生长
添加不同组分培养2、6、12 d后对卵泡直径的影响见表1。与新鲜组织(30.8 μm)比较,培养2 d后各处理对卵泡直径的增长没有显著影响(P>0.05);培养 6 d后,除 VC+EGF 组(30.5 μm,P>0.05)和MEM组(31.3 μm,P>0.05)外,其他组卵泡直径都显著的增加;培养 12 d后单独添加 VC(34.2 μm,P>0.05)或与 EGF 联合添加(32.3 μm,P>0.05)试验组以及 MEM 组(34.5 μm,P>0.05)对卵泡直径的增长没有显著影响,而其他各组与未培养对照组比较差异显著(P<0.05)。在各培养组之间比较,培养2 d后各组之间差异不显著(P>0.05);培养 6 d后,在培养中单独或联合添加EGF与 FSH(EGF组:39.0 μm;FSH 组:38.3 μm;EGF+FSH 组:38.4 μm)时卵泡直径显著高于MEM对照组(33.1 μm)与 VC+EGF 组(31.2 μm,P<0.05)。同时 VC+EGF组只与 MEM 对照组之间差异不显著(P>0.05),而显著低于其他试验组(P<0.05);培养12 d后结果与培养6 d结果相似,但是单独添加 VC组(34.2 μm)与 VC+EGF组(32.3 μm)之间差异不显著(P>0.05),而显著低于除FSH组(37.8 μm,P>0.05)外的其他试验组(P<0.05)。对同一培养基内培养不同天数之间比较,VC+EGF组和MEM对照组在培养2 d、6 d和 12 d后卵泡直径分别为 30.5 μm、31.2 μm、32.3 μm 和 31.3 μm、33.1 μm、34.5 μm,各天数之间差异均不显著(P>0.05);单独添加各种因子在培养6 d和12 d后与培养2 d比较,除VC在培养12 d 后(34.2 μm)与其他天数(2 d:31.7 μm;6 d:37.2 μm)比较不显著外(P>0.05),其他处理中卵泡直径都显著增大(P<0.05);培养 12 d后EGF+FSH组卵泡直径(44.0 μm)显著高于培养 2 d和 6 d 后的卵泡直径(分别为 34.2 μm、38.4 μm,P<0.05)。VC+EGF+FSH 组(42.5 μm)培养 12 d 后显著高于培养2 d后(33.3 μm,P<0.05)直径,但与培养 6 d之间差异不显著(37.6 μm,P>0.05),VC+FSH组与此类似。

图2 新鲜组织与培养2、6、12 d后组织正常卵泡比例Fig.2 Percentages of normal follicles in non-cultured tissue and after 2, 6, 12 days of culture in various treatments.*: different significantly from non-cultured tissue(P<0.05); #: different significantly from MEM control alone in each day of culture(P<0.05); a,b: different significantly between treatments at the same day of culture(P<0.05); A, B, C: different significantly between days of culture in the same treatment(P<0.05).

图3 组织学观察未培养组织中正常原始卵泡(A)、VC+EGF+FSH组培养 12 d后发育卵泡(B)和VC+EGF组培养12 d后异常卵泡(C)Fig.3 Histological section of normal primordial follicle in non-cultured tissue(A), and growing follicle cultured 12 days in VC+EGF+FSH group(B), or un-normal follicle cultured 12 days in VC+EGF group(C).
表 1 未培养组和各处理组培养不同天数后卵泡直径的变化(平均值±标准差)Table 1 Mean follicles diameter in non-cultured tissue and in tissue cultured for 2, 6 and 12 days in various treatments(±s)
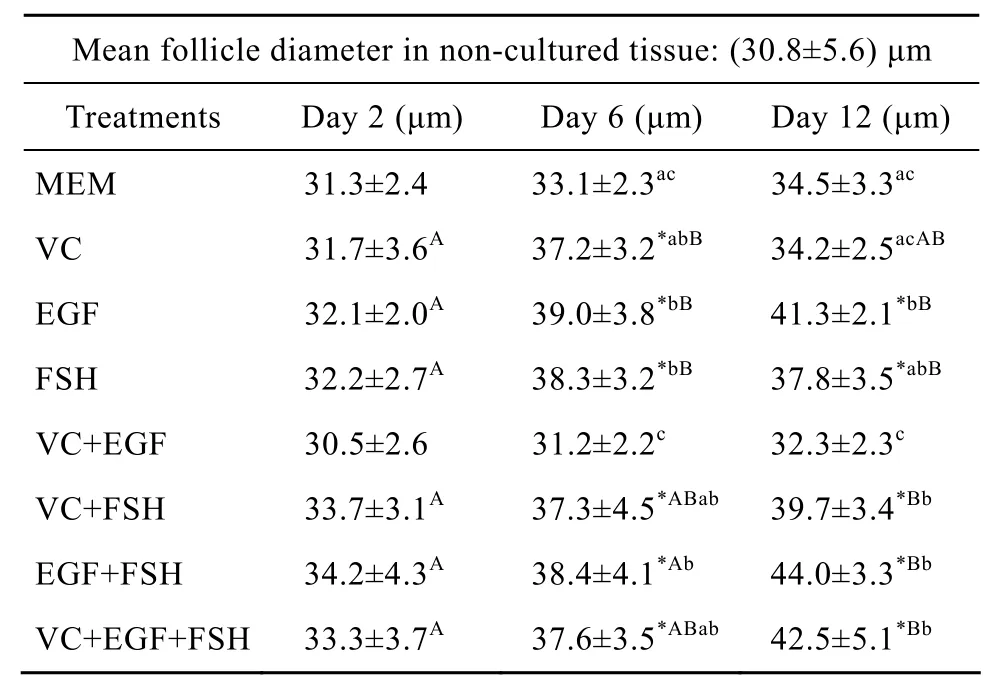
表 1 未培养组和各处理组培养不同天数后卵泡直径的变化(平均值±标准差)Table 1 Mean follicles diameter in non-cultured tissue and in tissue cultured for 2, 6 and 12 days in various treatments(±s)
Notes: *: different significantly from non-cultured tissue(P<0.05);a, b, c: different significantly between treatments at the same day of culture(P<0.05); A, B, C: different significantly between days of culture in the same treatment(P<0.05).
Mean follicle diameter in non-cultured tissue:(30.8±5.6)μm Treatments Day 2(μm) Day 6(μm) Day 12(μm)MEM 31.3±2.4 33.1±2.3ac 34.5±3.3acVC 31.7±3.6A 37.2±3.2*abB 34.2±2.5acABEGF 32.1±2.0A 39.0±3.8*bB 41.3±2.1*bBFSH 32.2±2.7A 38.3±3.2*bB 37.8±3.5*abBVC+EGF 30.5±2.6 31.2±2.2c 32.3±2.3cVC+FSH 33.7±3.1A 37.3±4.5*ABab 39.7±3.4*BbEGF+FSH 34.2±4.3A 38.4±4.1*Ab 44.0±3.3*BbVC+EGF+FSH 33.3±3.7A 37.6±3.5*ABab 42.5±5.1*Bb
2.2 PCNA检测
表 2所示为添加不同因子在培养不同天数之后PCNA检测的结果。颗粒细胞被染为棕黄色(图4A),判定为PCNA阳性卵泡。由表中数据可知,与未培养组织(22.5%)比较,在整个培养期内VC+EGF+FSH组PCNA阳性卵泡比例(培养2、6、12 d后比例分别为39.5%、44.7%、43.5%)都显著增加(P<0.05),VC+FSH组在培养6 d(40.9%)以及EGF+FSH组培养12 d后(39.5%)PCNA阳性卵泡比例也显著增加(P<0.05),其他组效果不显著(P>0.05);在各试验组内比较,VC+EGF组中阳性卵泡比例在培养12 d后(26.4%,P<0.05)显著低于 VC+EGF+FSH组(43.5%)和 EGF+FSH组(39.5%)。所有试验组与 MEM 对照组之间比较,PCNA阳性率差异不显著(P>0.05),此外培养天数对各组PCNA的表达也没有显著影响(P>0.05)。
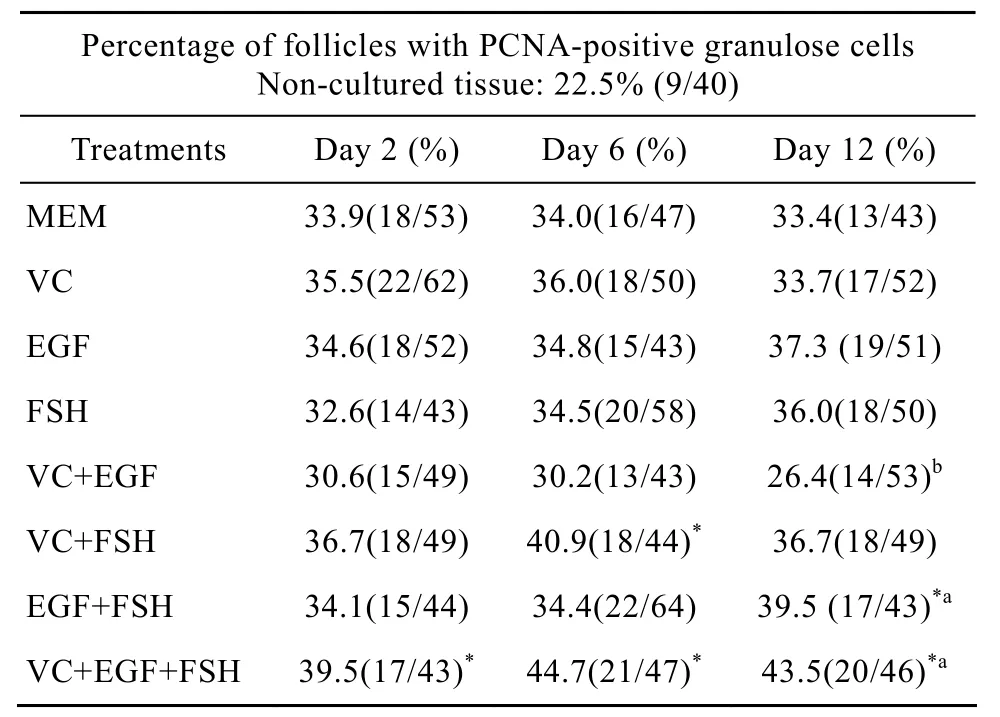
表2 各因子对卵泡颗粒细胞增殖的影响Table 2 Percentages of follicles with PCNA positive granulose cells in tissue cultured for 2, 6 and 12 days in various treatments

图4 PCNA阴性对照(A)与未培养组织(B)、VC+EGF(C)和VC+EGF+FSH(D)培养12 d后阳性卵泡(箭头所指为PCNA阳性颗粒细胞)Fig.4 PCNA-negative control with granulose cells stained blue(A)and PCNA-positive follicle with granulose cells stained Brown(arrow)in non-cultured tissue(B)or tissue cultured for 12 days in VC+EGF(C)and VC+EGF+FSH(D)group.
2.3 超微结构的观察
为了进一步探讨VC与EGF以及FSH之间对卵泡发育的影响,根据组织学分析结果,对未培养组织(图5A)和 MEM 组(图5B),VC+EGF 组(图5C)以及VC+EGF+FSH组(图5D),培养12 d后组织中光镜下显示正常的卵泡进行超微结构的观察。结果显示只有 VC+EGF+FSH组中卵泡超微结构与未培养组织中卵泡结构类似。这些卵泡具有完整的卵母细胞和核膜以及较大的卵核,圆形线粒体和内质网均匀分布在胞质中,卵质中异染色质和空泡较少;颗粒细胞结构完整具有不规则的细胞核,占胞质的很大一部分,细胞核长而大,核内染色质松弛,外部表现轻度浓染,在颗粒细胞中观察到的最多的细胞器为具有发育良好的圆形粗面内质网和线粒体。而在VC+EGF组和MEM组中光镜下形态正常的卵泡,经TEM观察显示超微结构发生变化,一些表明卵泡退化的特征出现,这些卵泡表现为卵母细胞极度空泡化,这些空泡常常聚集成团,形成很大的空白区域,细胞器随机分布在胞质中,密度低且大多数不可辨认,内质网扩张,线粒体膜和嵴被破坏,卵母细胞核畸形收缩,核膜呈波浪起伏,且异染色质成团出现,形成电子密度高的浓染区域,核仁松散呈网状结构;颗粒细胞肿胀,与基底膜及卵母细胞之间的间隙连接减少或消失。值得注意的是VC+EGF组中卵泡虽然表现退化特征,但显示与MEM组不同的特征,即卵泡内各种膜结构并未显示异常,颗粒细胞也未发现肿胀。
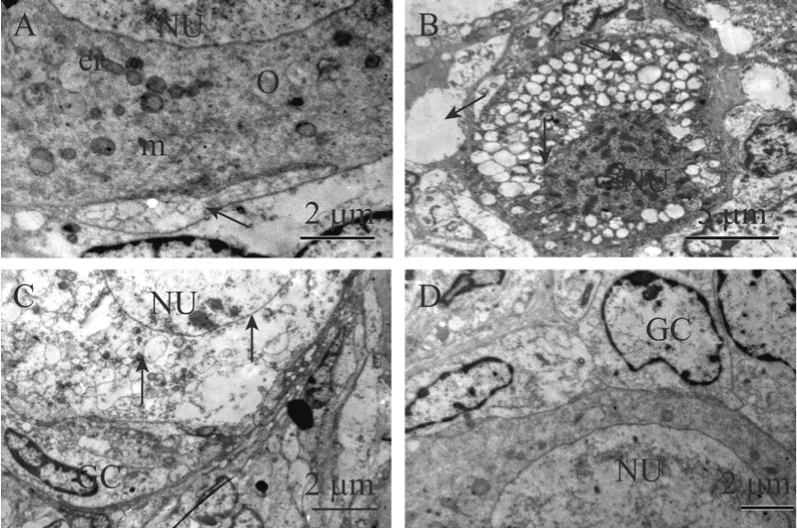
图5 未培养组织(A)与 MEM(B)、VC+EGF(C)、VC+EGF+FSH(D)组培养12 d后卵泡超微结构图Fig.5 Ultrastructural analysis of histology normal follicles from non-cultured tissue(A)and cultured for 12 days in MEM(B), VC+FSH(C)and VC+EGF+FSH(D)groups.NU-nucleus,O-oocyte, m-mitochondria, er-endoplasmic reticulum,GC-granulosa cells.(A)arrow: gap junction.(B)arrows from top to down: vacuolization oocyte and granulose cell; oocyte;oocyte nuclear with abnormity and irregular nuclear membrane,ramified oocyte nucleolus.(C)arrows from top to down: regular nuclear membrane, vacuolization oocyte, normal granulose cell.A, C, D: 6 500×, bar=2 μm; B: 3 000×, bar=5 μm.
3 讨论
本研究中,VC与FSH联合添加时不但促进卵泡的存活,同时对卵泡的发育和生长也具有促进作用,提示VC与FSH是相互促进的关系。VC是一种还原剂,在卵泡的发育过程中,参与胶原蛋白的合成,维持卵泡基底膜的完整,通过羟化作用参与内固醇激素的分泌[15]。在牛[14]和鼠[15]上的研究表明VC可以降低体外培养中卵泡的凋亡。虽然很多研究表明原始卵泡的激活对FSH是非依赖性的[17-19],但研究表明它可以通过作用于大卵泡和间质细胞释放旁分泌因子,间接参与早期卵泡发生[20]。2007年Matos等[4]报道FSH可以维持体外培养中山羊腔前卵泡形态完整,促进原始卵泡激活和生长。对于FSH与VC的关系,一方面研究表明FSH可以正向调节颗粒细胞对 VC的吸收,同时 VC也可以增加颗粒细胞上FSH受体的表达[21],另一方面在Saraiva等[22]的研究中发现 FSH与低浓度的 LH一起添加时,可以维持山羊卵泡的结构完整,而 VC可以促进LH的合成,这可能也表明FSH与VC之间可以借助第三者,影响卵泡发育。最近Rossetto等[12]报道在山羊卵巢体外培养中联合添加VC和FSH可以促进原始卵泡的激活和生长,维持卵泡结构完整。
研究发现,VC和EGF一起添加时显著地抑制原始卵泡的发育和生长,且培养12 d后组织中正常卵泡比例显著低于单独添加VC或EGF组,提示VC与EGF可能存在相互拮抗的作用。目前对于它们之间这种拮抗的机制还不清楚。可能的解释是一方面EGF只有在被离解素和金属蛋白激酶(ADAMs)分开后,与EGF受体和ERBB4结合才能发挥其对卵巢卵泡的生理作用[23]。在对人羊膜细胞培养时发现,添加 VC可以降低基质金属蛋白激酶(MMP)的活性[24],2001年Murry等也报道在鼠腔前卵泡体外培养中添加低浓度VC能够在增加MMP产量的同时显著增加卵泡中金属蛋白酶组织抑制剂 TIMP-1的产量[15],而 ADAMs和 MMP均属于蛋白激酶家族,提示 VC可能通过参与调节金属蛋白激酶的合成,降低 EGF与其受体的结合率,影响 EGF对卵泡发育的影响。另一方面在 Park等的研究中表明 EGF信号途径可以促进颗粒细胞膜上 LH受体的表达,调节 LH促有丝分裂的能力[25];而 LH可以促进颗粒细胞和间质细胞产生妊娠素,研究表明持续增加的妊娠素可以阻断颗粒细胞对 VC的摄取[26],因此EGF可能也通过旁分泌的作用间接影响VC的作用。
有趣的是VC与EGF、FSH三者一起添加时,VC与EGF之间的相互抑制作用被消除,显示对卵泡发育和生长的促进作用。其原因可能是由于 FSH能够促进卵泡颗粒细胞与膜细胞的分化增殖,在增殖过程中MMP的表达增强[24],促进EGF受体在颗粒细胞上的表达,发挥EGF的作用,促进颗粒细胞有丝分裂和卵泡发育,Silva等[3]的研究也表明联合添加EGF与FSH可以促进原始卵泡的生长。在卵泡细胞增殖和发育过程中需要大量的胶原来维持基底膜完整,VC可以促进胶原的合成[15]。而FSH与VC之间的关系在前面的讨论中已经表明它们之间是相互促进的。FSH与VC及EGF之间的这种正向调节关系,可能使得VC与EGF之间的拮抗作用被抑制,三者各自之间的作用都得到发挥,共同作用促进卵泡的发育和生长。
PCNA是一种37 kDa的蛋白,在细胞周期S期早期的细胞核中没有表达,而在S期后期主要在细胞核中表达,与细胞核中DNA的合成密切相关。在羊、人、鼠上的研究已经证实卵泡中颗粒细胞PCNA的表达可以作为颗粒细胞有丝分裂的可靠标记[3]。在本研究中,PCNA分析结果表明VC与EGF拮抗抑制卵泡发育和生长可能是通过抑制颗粒细胞增殖而起作用的,而FSH可以消除它们之间的这种抑制作用,并且能与它们共同作用显著增强颗粒细胞的增殖活性。研究表明 FSH可以通过旁分泌因子如IGF-I和激活素作用促进颗粒细胞增殖[20],而VC能够使颗粒细胞中FSH受体增多[15]。EGF具有促进细胞有丝分裂的作用,而FSH可以促进颗粒细胞EGF受体的表达,当它们与 VC一起添加时,VC加强FSH的作用,从而促进EGF对颗粒细胞的增殖作用,使得颗粒细胞增殖效果优于其他组。
利用电镜技术,可以对卵泡在体外发育中超微结构的变化进行评估,更好地评定卵泡的体外发育质量。在本研究中发现培养12 d后,参与TEM分析的试验组中,只有VC+EGF+FSH组卵泡超微结构几种重要的细胞器如线粒体、内质网、核等与正常卵泡超微结构类似。但是在VC+EGF组和MEM组中培养12 d后,虽然卵泡基本结构在形态上还保持着完整,但是表现出更多的卵泡退化特征,这种表现在 MEM 组中尤为明显。例如卵母细胞胞质中空泡化极度增多,核形状不规则,核膜呈波浪起伏,核中异染色质增加。胞质空泡化是卵母细胞、颗粒细胞退化的标志,可能表示内质网膨胀或线粒体结构的改变[4]。在羊腔前卵泡中,线粒体肿胀、嵴消失、内质网体积增大是卵泡退化的早期标志[27]。超微结构的观察表明VC+EGF可以维持卵泡膜结构的完整,但对卵泡内细胞器有损伤作用,如细胞器分布不均匀,空泡化增多,表明卵母细胞休眠或即将退化。光镜下评定卵泡的正常与否精确度较低,常常只在膜结构和基本形态上判定,不能反映卵泡内细胞器的变化,而这些变化有可能是卵泡退化的关键标志,组织学中VC+EGF组中正常卵泡比例变化明显,与电镜观察结果一致。
总之,本研究结果表明FSH与EGF或VC共同作用可以促进羊原始卵泡的激活和生长,VC与EGF一起时则抑制卵泡的发育和生长,FSH可以消除这种抑制,且增强它们对细胞增殖活性的影响。这些结果提示在培养体系中添加激素和生长因子以外的其他物质,研究它们之间的相互影响,可以为研究原始卵泡早期发生和开发支持原始卵泡发育到卵母细胞成熟和受精的体外培养体系提供更好的思路。
REFERENCES
[1]Markstrom E, Svensson E, Shao R,et al.Survival factors regulating ovarian apoptosis—dependence on follicle differentiation.Reprod, 2002, 123: 23–30.
[2]Greenwald GS, Roy SK.Follicular development and its control//Knobil E, Neil1 JD, eds.Physiology of Reproduction.New York: Raven Press, 1994: 629–725.
[3]Silva JR, Hurk R, Matos MHT,et al.Influences of FSH and EGF on primordial follicles duringin vitroculture of caprine ovarian cortical tissue.Theriogenology, 2004, 61:1691–1704.
[4]Matos MHT, Lima-Verde IB, Luque MCA,et al.Essential role of follicle stimulating hormone in the maintenance of caprine preantral follicle viabilityin vitro.Zygote, 2007,15: 173–182.
[5]Saha S, Shimizu M, Geshi M,et al.In vitroculture of bovine preantral follicles.Anim Reprod Sci, 2000, 63:27–39.
[6]Reeka N, Berg FD, Brucker C.Presence of transforming growth factor alpha and epidermal growth factor in human ovarian tissue and follicular fluid.Hum Reprod, 1998, 13:2199–2205.
[7]Qu JP, Godin PA, Nisolle M,et al.Distribution of epidermal growth factor receptor expression of primordial follicles in human ovarian tissue before and after cryopreservation.Hum Reprod, 2000, 15: 302–310.
[8]Garnett K, Wang J, Roy SK.Spatiotemporal expression of epidermal growth factor receptor messenger RNA and protein in the hamster ovary: follicle stage-specific differential modulation by follicle stimulating hormone,luteinizing hormone, estradiol, and progesterone.Biol Reprod, 2002, 67: 1593–1604.
[9]Wandji SA, Srsen V, Nathanielsz,et al.Initiation of growth of baboon primordial folliclesin vitro.Hum Reprod, 1997, 12: 1993–2001.
[10]Morbeck DE, Flowers WL, Britt JH,et al.Response of porcine granulosa cells isolated from primary and secondary follicles to FSH, 8-bromo-cAMP and epidermal growth factorin vitro.Reprod Fertil, 1993, 99: 577–584.
[11]Andrade ER, Seneda MM, Alfieri AA,et al.Interactions of indole acetic acid with EGF and FSH in the culture of ovine preantral follicles.Theriogenology, 2005, 64:1104–1113.
[12]Rossetto IB, Lima-Verde, Matos MHT,et al.Interaction between ascorbic acid and follicle-stimulating hormone maintains follicular viability after long-termin vitroculture of caprine preantral follicles.Domest Anim Endocrin, 2009, 37: 112–123.
[13]Pinnell SR.Regulation of collagen synthesis by ascorbic acid: a review.Yale J Biol Med, 1985, 58: 553–559.
[14] Thomas FH, Leask R, Srsen V,et al.Effect of ascorbic acid on health and morphology of bovine preantral follicles during long-term culture.Reprod, 2001, 122:487–495.
[15]Murray AA, Molinek MD, Baker SJ,et al.Role of ascorbic acid in promoting follicle integrity and survival in intact mouse ovarian folliclesin vitro.Reprod, 2001,121: 89–96.
[16]Hulshof SCJ, Figueiredo JR, Beckers JF,et al.Isolation and characterization of preantral follicles from fetal bovine ovaries.Vet Quart, 1994, 18: 78–80.
[17]Carr A, Frei B.Does vitamin C act as a pro-oxidant under physiological conditions?Faseb, 1999, 13: 1007–1024.
[18]Ulloa-Aguirre A, Midgley AR, Beitins JR,et al.Follicle-stimulating hormones: characterization and physiological relevance.Endocr Rev, 1995, 16: 765–787.
[19]O’Shaughnessy J, McLelland D, McBride MW.Regulation of luteinizing hormone receptor and follicle-stimulating hormone receptor messenger ribonucleic acid levels during development in the neonatal mouse ovarian.Biol Reprod, 1997, 57: 602–608.
[20]Méduri G, Charnaux N, Driancourt MA,et al.Follicle stimulating hormone receptors in oocytes?J Clin Endocr Metab, 2002, 87: 2266–2276.
[21]Jennifer LJ, Norma LH, Derek AH,et al.Growth differentiation factor 9 and bone morphogenetic protein 15 are essential for ovarian follicular development in sheep.Biol Reprod, 2002, 67: 1777–1789.
[22]Saraiva MVA, Celestino JJH, Chaves RN,et al.Influence of different concentrations of LH and FSH onin vitrocaprine primordial ovarian follicle development.Small Ruminant Res, 2008, 78: 87–95.
[23]Behrman HR, Preston SL, Aten RF,et al.Hormone induction of ascorbic acid transport immature granulose cells.Endocr J, 1996, 137: 4316–4321.
[24]Hinkle CL, Sunnarborg SW, Loiselle D,et al.Selective roles for tumor necrosis factor alpha-converting enzyme/ADAM17 in the shedding of the epidermal growth factor receptor ligand family: the juxtamembrane stalk determines cleavage efficiency.Biol Chem, 2004, 279(23):24179–24188.
[25]Pfeffer F, Casanueva E, Kamar J,et al.Modulation of 72-kilodalton type IV collagenase(matrix metalloproteinase-2)by ascorbic acid in cultured human amnion-derived cells.Biol Reprod, 1998, 59: 326–329.
[26]Park JY, Su YQ, Ariga M,et al.EGF-like growth factors as mediators of LH action in the ovulatory follicle.Science, 2004, 303: 682–684.
[27]Santos R, Rodrigues PR, Sonia HF,et al.Histological and ultrastructural analysis of cryopreserved sheep preantral follicles.Anim Reprod Sci, 2006, 91: 249–263.
Effect of ascorbic acid, epidermal growth factor and follicle stimulating hormone on in vitro culture of sheep ovarian cortical tissue
Xiayu Peng1,2, Liqin Wang2, Mei Yang3, Tong Chen2, and Zhiqin Guo2
1 Department of Animal Science, Shihezi University, Shihezi 832000, China 2 Key Laboratory of Reproduction and Breeding Biotechnology of Grass Feeding Livestock, Key Laboratory of Animal Biotechnology,China-Australia Sleep Breeding Research Center, Xinjiang Academy of Animal Science China, Urumqi 830000, China 3 Ainmal Sanitation Administration of Jinzhou District in Dalian City, Dalian 116037, China
Received:December 7, 2009;Accepted:April 6, 2010
Supported by:Projects in the National Science and Technology Pillar Program(Nos.2008BADB2B05-10, 2008ADB2B010-5).
Corresponding author:Zhiqin Guo.Tel: +86-991-4835324; Fax: +86-991-4841417; E-mail: abt.guo@vip.sina.com国家科技支撑项目(Nos.2008ADB2B05-10, 2008ADB2B010-5)资助。

