化橘红药材质量评价、监测与应用研究
林励,李向明,万建义*,陈志霞,袁旭江,黄兰珍
(1.广州中医药大学,广东 广州 510405;2.广东化州市绿色生命有限公司,广东 化州 525100)
化橘红药材质量评价、监测与应用研究
林励1,李向明2,万建义2*,陈志霞1,袁旭江1,黄兰珍1
(1.广州中医药大学,广东 广州 510405;2.广东化州市绿色生命有限公司,广东 化州 525100)
目的:评价化橘红质量,确定质量监测方法。方法:以形态分类法和显微鉴定法比较原植物及显微构造,以分光光度法比较总黄酮含量,以高效液相色谱法比较柚皮苷含量及指纹图谱,以薄层扫描法比较野漆树苷含量。结果:两类化橘红原植物存在外果皮绒毛、茎非腺毛等显著差异;化橘红总黄酮含量、柚皮苷含量均高于光橘红,野漆树苷含量为光橘红的10倍,指纹图谱也有显著差异。化州柚鲜果重量增加峰值出现在成果41d时,此时其药材质量也较优。结论:道地药材化橘红质量显著优于光橘红,化橘红采收期宜定在41d左右。
化橘红;品种;鉴别;采收期;指纹图谱
中药化橘红为芸香科植物化州柚Citrus grandis‘Tomentosa’和柚Citrus grandis(L.)Osbeck未成熟或近成熟的干燥外层果皮,具有理气宽中,燥湿化痰功能[1]。化州柚是广东省化州市特有树种,已有1 500多年的种植历史,自古以来,其未成熟果外果皮即作为化橘红入药,习称化橘红,系道地化橘红药材,品质最优,曾列为皇室专用祛痰圣药[2]。柚外果皮于1963年才被作为橘红入药,习称光橘红。化橘红富含黄酮类成分[3],有祛痰镇咳作用,其中柚皮苷、野漆树苷均为活性成分[4,5]。为科学地评价化橘红的质量,笔者进行了本项试验。
1 化橘红药材质量评价及采收期研究
1.1 仪器、试剂、样品
1.1.1 仪器 Summit680A高效液相色谱仪(德国Dioen),8453E紫外分光光度计(美国Agilent),722型分光光度计(上海分析仪器二厂),CS9000型薄层扫描仪(日本岛津)。
1.1.2 试剂 柚皮苷对照品(购自中国药品生物制品
检定所,批号722-9004),野漆树苷对照品(自制,纯度 98.13%),甲醇(色谱纯),石油醚(60~90℃)、乙醚、冰醋酸、二甲苯、甲酸、甲醇、丙酮、醋酸乙酯、硝酸铝等试剂均为分析纯。
1.1.3 样品
1.1.3.1 品种质量对比用样品 化橘红和光橘红原植物标本均采自化州市平定镇马力村,化橘红药材样品分别采或购自化州市平定镇,光橘红药材样品分别购于不同产地。
化橘红1:2000年5月采于广东省化州市平定镇,药材直径约为7.0cm;
化橘红2:2000年4月采于广东省化州市平定镇,药材直径约4.5cm;
化橘红3:2000年8月购自广东省化州市平定镇,药材直径约4cm;
光橘红1:2001年8月购于湖南,药材直径约4.0cm;
光橘红2:2001年8月购于广西,药材直径约7.0cm;
光橘红3:购自河南省郑州市医药总公司医药大厦,药材直径约10.5cm。
经广东省中药研究所丘金裕主任中药师鉴定,上述药材中化橘红原植物均为芸香科植物化州柚Citrus grandis‘Tomentosa’,光橘红原植物均为柚Citrus grandis(L.)Osbeck。
1.1.3.2 采收期考察用样品 试验样品均采于化州市平定镇天堂嶂化橘红GAP基地,选定5株2004年4月1日形成果实的化橘红树,经广东省中药研究所丘金裕主任中药师鉴定,其原植物为化州柚Citrus grandis‘Tomentosa’。20d后(2004年4月21日)开始分株采收果实和树叶,以后约一周采摘果实和树叶1次,至2004年6月30日止,共获12批果实和树叶样品,测量每个鲜果直径和重量,各批果实直径和重量均值见表1。各样品常法干燥、粉碎后置干燥器备用。
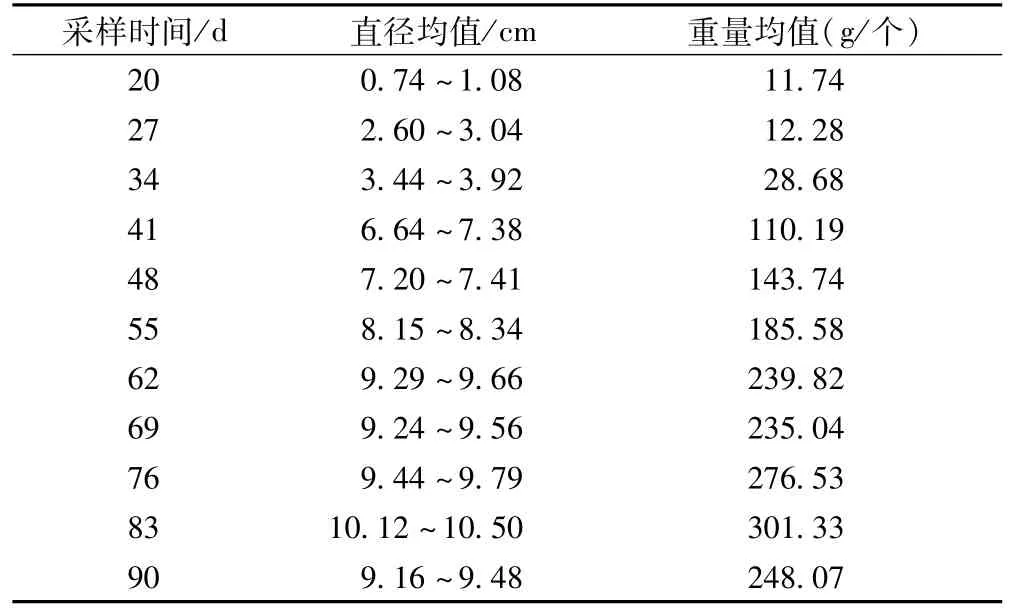
表1 化橘红鲜果直径和重量平均值
1.2 方法
1.2.1 原植物形态比较 定期采集化橘红与光橘红原植物标本,照植物形态分类法对其原植物作比较研究。
1.2.2 茎叶切片处理方法 取生长年限相同、直径相近的化州柚与柚的茎以滑走切片法切成25μm厚的薄片。将此薄片以番红和固绿进行染色后依次以低浓度到高浓度的乙醇进行脱水、低浓度到高浓度的二甲苯进行透明,最后以加拿大树脂封片。晾干,得化州柚和柚茎的永久制片。取生长年限相同、大小和厚度相近的化州柚与柚的叶片以蜡埋后滑走切片法切成30μm厚的薄片,再照茎切片处理方法,得化州柚和柚叶的永久制片,于显微镜下观察。
1.2.3 总黄酮含量测定方法(柚皮苷+铝盐-分光光度法) 分别准确吸取柚皮苷对照品溶液(6.2mg·mL-1)0,1,2,3,4,5mL于25mL量瓶内,准确加入10%硝酸铝1mL,摇匀,以缺对照品者为空白对照,分别测定其在384mn处的吸收度值,以吸取量(mL)为横坐标,吸收值为纵坐标,求得柚皮苷标准曲线的回归方程为Y=0.186 8X-0.020 8,r=0.999 96。精密称定化橘红约0.2g,分别置索氏提取器中,加入乙醚90mL,提取至无色,弃去乙醚提取液,再加甲醇90mL,提取至无色,甲醇液放冷,移至量瓶中,加甲醇定容至刻度,摇匀,即得供试品溶液。分别取定量供试品溶液与对照品溶液依法测定,在150min内稳定性均良好,加样回收率为102.95%(RSD=2.42%),重现性、精密度均良好。
1.2.4 柚皮苷含量测定方法(高效液相色谱法) 色谱柱:LiChrospher®100(RP-18e,5μm,250mm×4mm,Merck)。流动相:甲醇 -冰醋酸 -水(35∶4∶61),过0.45μm滤膜。流速:1.0mL·min-1,检测波长:283nm,柱温:40℃。准确称取柚皮苷对照品,加甲醇溶解,制成90mg·L-1的溶液,作为对照品溶液。分别准确吸取柚皮苷对照品溶液2,4,6,8,10μL注入高效液相色谱仪,按上述条件进行测定,以柚皮苷量为横坐标,峰面积积分值为纵坐标,绘制标准曲线。求得柚皮苷的回归方程为Y=1 625.669 09X+9.369 02,r=0.999 9。精密称取化橘红约0.1g,分别置索氏提取器中,加入石油醚90mL,提取至无色,弃去乙醚提取液,再加甲醇90mL,提取至无色,甲醇液放冷,移至100mL量瓶中,加甲醇定容至刻度,摇匀,即得供试品溶液。分别定量取供试品溶液与对照品溶液适量,按外标峰面积法测定柚皮苷含量。加样回收率为100.2%(RSD=2.43%),稳定性、重现性、精密度均良好。
1.2.5 野漆树苷含量测定方法(薄层扫描法) 准确称取野漆树苷对照品,加甲醇溶解,制成270mg·L-1的溶液,作为对照品溶液。取化橘红约0.5g,精密称定,置索氏提取器中,加入石油醚90mL,提取至无色,弃去醚提液,再加甲醇90mL,提取至无色,移出、浓缩、放冷,再移至10mL量瓶中,甲醇定容至刻度,摇匀,即得供试品溶液。分别定量取供试品溶液与对照品溶液适量,以定量毛细管点样于GF254预制薄层板上。展开剂a:醋酸乙酯-丙酮-水(10∶5∶9),摇匀、放置待分层后取上层液10mL+丙酮1mL+甲酸0.02mL;展开剂b:醋酸乙酯-丙酮-水(10∶5∶9),摇匀、放置待分层后取上层液10mL+丙酮1mL。先用展开剂a上行展开,展距8cm,取出晾干后,再用展开剂 b展开,展距8cm,取出,晾干,105℃烘15min,放冷,作光谱扫描,对照品色点与供试品色点均在342nm处有最大吸收峰,确定扫描波长为342nm。准确吸取对照品溶液0.5,1,2,3,4,5μL于同一薄层板上,先后用a、b展开剂二次展开,取出,晾干,扫描。扫描条件:飞点扫描,λ=342nm。以面积值为纵坐标,点样量为横坐标,得标准曲线回归方程为Y=103 099.266X+13 126.960,r=0.999 0,按外标峰面积法测定野漆树苷含量。加样回收率为95.17%(RSD=2.50%),稳定性、重现性、精密度均良好。
1.2.6 指纹图谱比较方法(高效液相色谱法) 色谱柱:MACHEREY-NAGEL(100-5C18,5μm,250mm×4.6mm)。经考察确定流动相,A:甲醇,B:水-冰醋酸(61∶4),梯度洗脱。流速:1.0mL·min-1,检测波长:283nm(345nm为辅助参考波长),柱温:25℃。以柚皮苷、野漆树苷、柚皮苷元对照品为参照物,取同一份供试品溶液,分别在0,1.5,3.5,5.5,25,27h不同时间点进行测定,考察保留时间和峰面积的一致性,柚皮苷保留时间的RSD和峰面积的RSD分别为0.279%和2.68%,稳定性良好。取同一份供试品溶液,连续进样5次,考察色谱峰保留时间和峰面积的一致性,柚皮苷保留时间的RSD和峰面积的RSD分别为0.304%和2.04%,精密度良好。
1.3 结果与分析
1.3.1 化橘红与光橘红原植物形态比较研究 依法进行原植物比较研究,两者原植物形态有显著差异,结果见表2。

表2 化橘红与光橘红原植物形态主要区别
1.3.2 化橘红与光橘红原植物显微特征比较 依法进行显微特征比较研究,两者原植物显微构造有显著差异,结果见表3。

表3 化橘红与光橘红原植物显微特征主要区别
1.3.3 化橘红与光橘红总黄酮含量比较 所测化橘红总黄酮含量均高于光橘红,结果见表4。
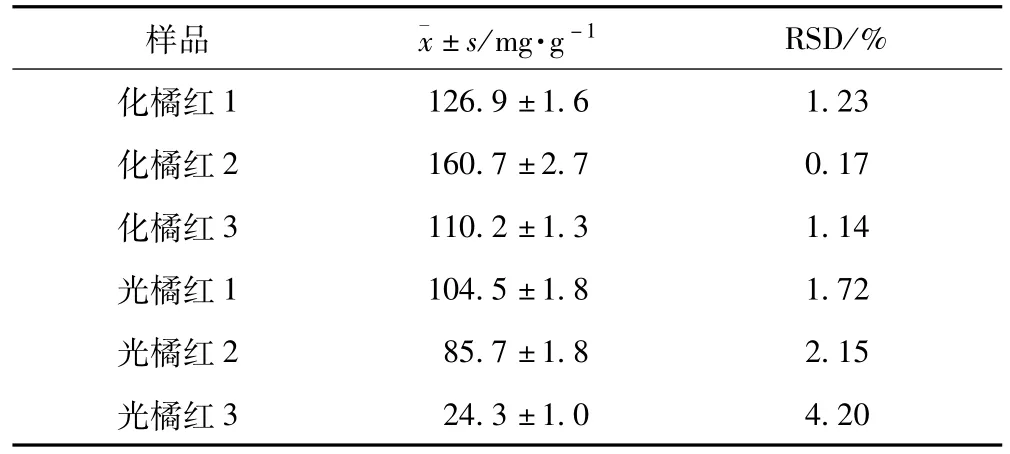
表4 化橘红与光橘红总黄酮含量
1.3.4 化橘红与光橘红柚皮苷含量比较 所测化橘红柚皮苷含量均高于光橘红,结果见表5。

表5 化橘红与光橘红柚皮苷含量
1.3.5 化橘红与光橘红野漆树苷含量比较 所测化橘红野漆树苷含量均显著高于光橘红,结果见表6。
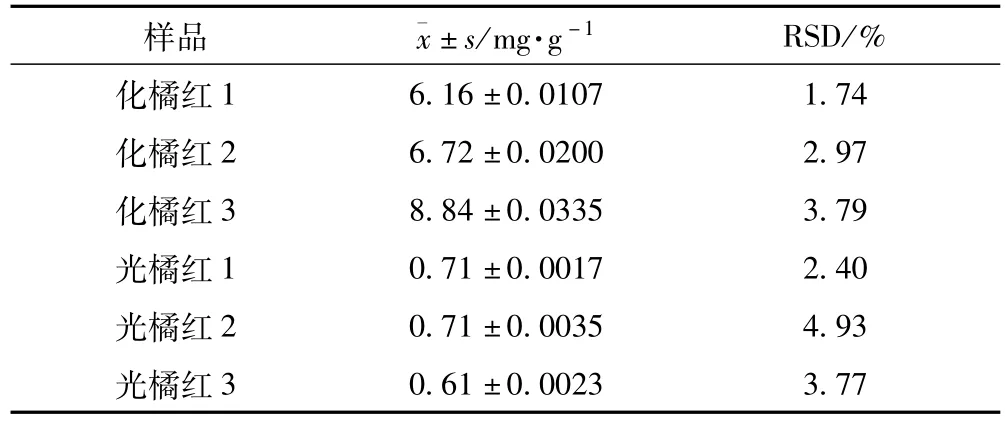
表6 化橘红与光橘红野漆树苷含量

图1 化橘红HPLC指纹图谱

图2 光橘红HPLC指纹图谱
结果显示,化橘红与光橘红HPLC指纹图谱有显著差异,易于鉴别两者。
1.3.7 不同采收时间的化州柚果皮(化橘红)及化州柚叶中总黄酮含量比较 结果见表7。
1.3.6 化橘红与光橘红指纹图谱比较 结果见图1、图2。
表7 不同采收时间的化州柚果皮及化州柚叶的总黄酮含量(x±s) /%
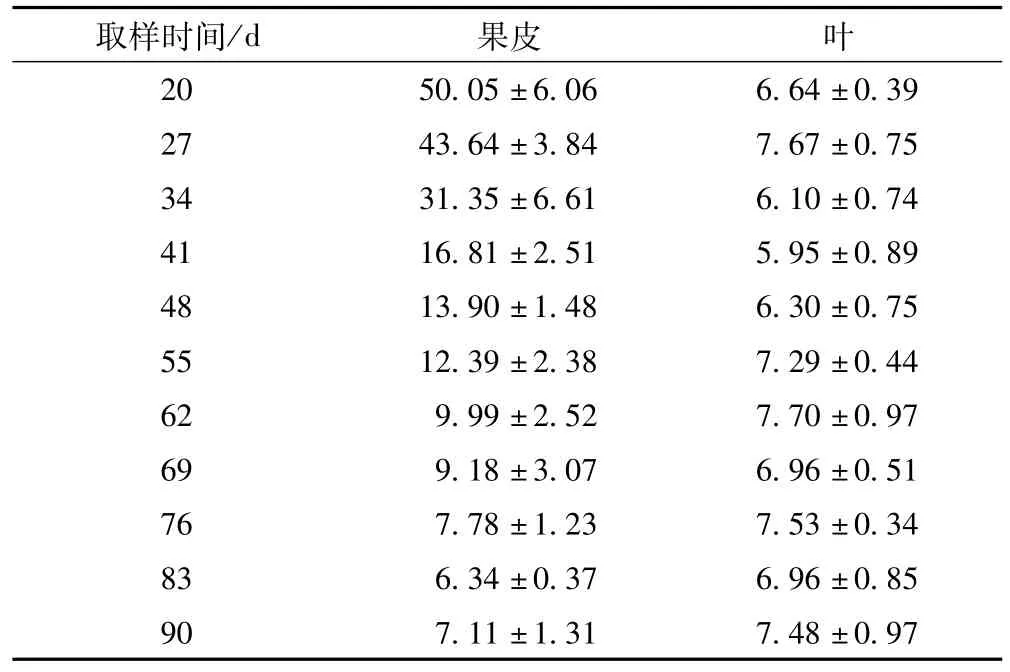
表7 不同采收时间的化州柚果皮及化州柚叶的总黄酮含量(x±s) /%
取样时间/d 果皮 叶20 50.05±6.06 6.64±0.39 27 43.64±3.84 7.67±0.75 34 31.35±6.61 6.10±0.74 41 16.81±2.51 5.95±0.89 48 13.90±1.48 6.30±0.75 55 12.39±2.38 7.29±0.44 62 9.99±2.52 7.70±0.97 69 9.18±3.07 6.96±0.51 76 7.78±1.23 7.53±0.34 83 6.34±0.37 6.96±0.85 90 7.11±1.31 7.48±0.97
1.3.8 不同采收时间的化州柚果皮(化橘红)及化州柚叶中柚皮苷含量比较 结果见表8。
表8 不同采收时间的化州柚果皮及化州柚叶的柚皮苷含量(±s)/%
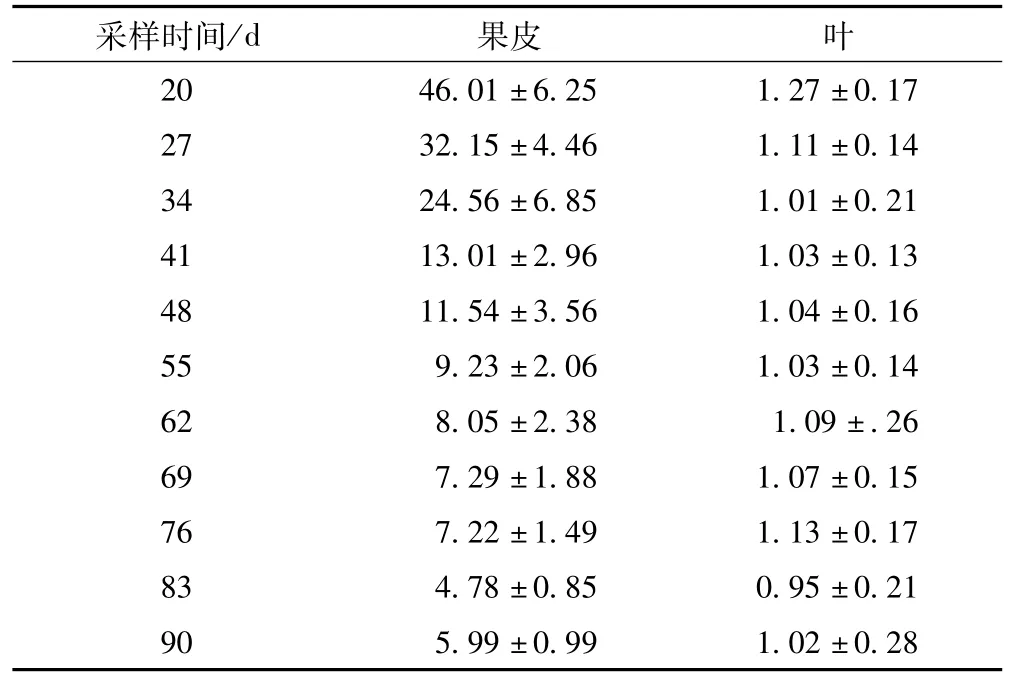
表8 不同采收时间的化州柚果皮及化州柚叶的柚皮苷含量(±s)/%
注:n=5
采样时间/d 果皮 叶20 46.01±6.25 1.27±0.17 27 32.15±4.46 1.11±0.14 34 24.56±6.85 1.01±0.21 41 13.01±2.96 1.03±0.13 48 11.54±3.56 1.04±0.16 55 9.23±2.06 1.03±0.14 62 8.05±2.38 1.09±.26 69 7.29±1.88 1.07±0.15 76 7.22±1.49 1.13±0.17 83 4.78±0.85 0.95±0.21 90 5.99±0.99 1.02±0.28
1.3.9 化州柚果皮(化橘红)及化州柚叶指纹图谱分析结果 见图3~15。注:n=5
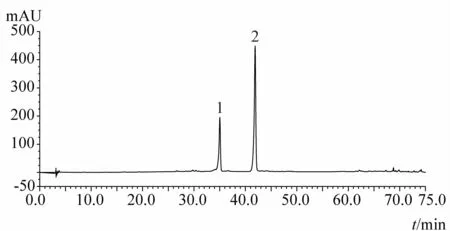
图3 柚皮苷和野漆树苷对照品HPLC图谱
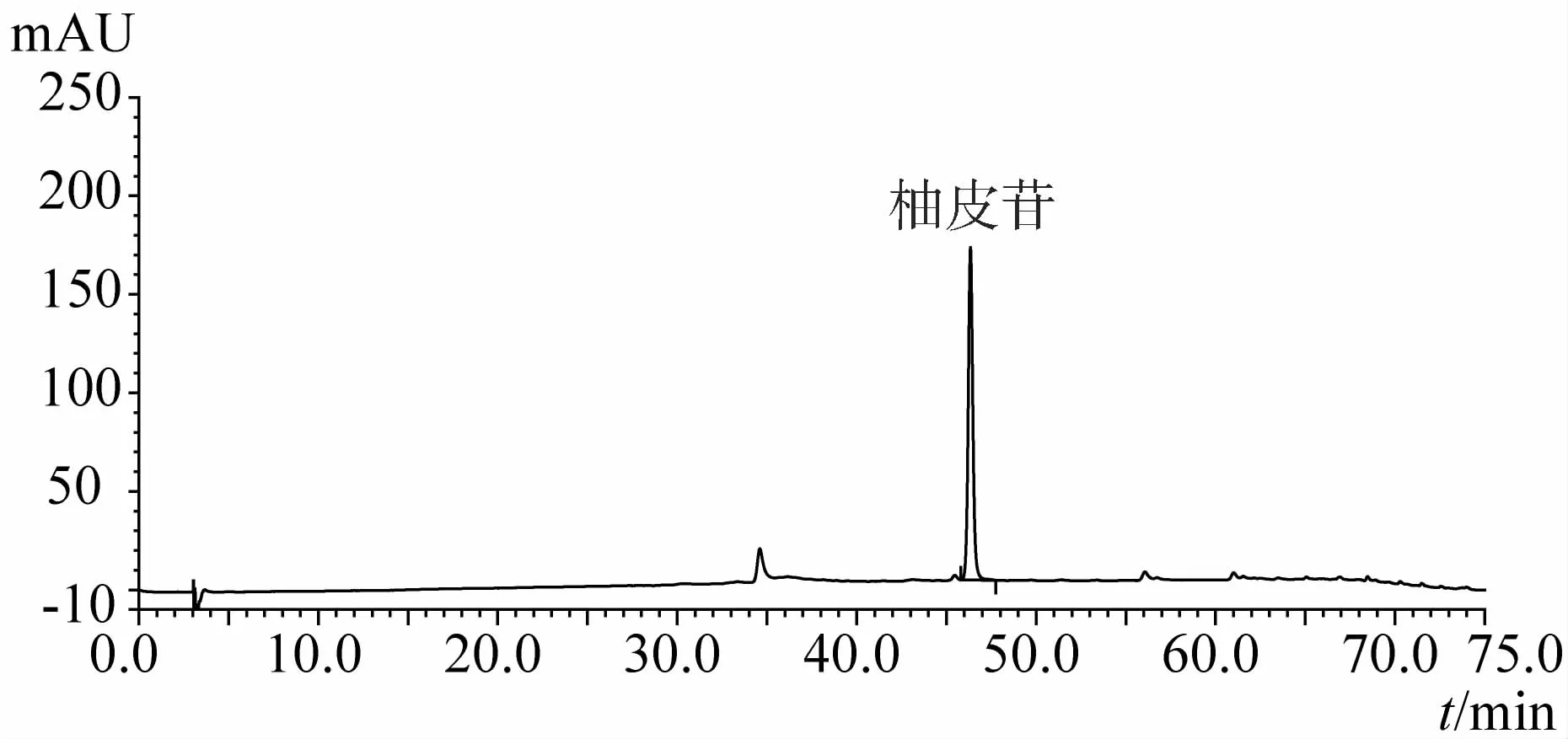
图4 柚皮苷元对照品HPLC图谱
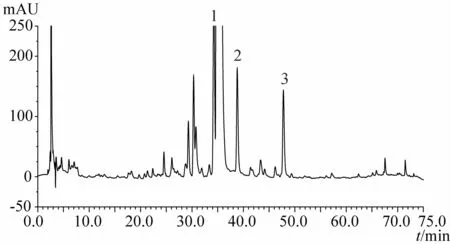
图5 20d时化州柚果皮HPLC指纹图谱
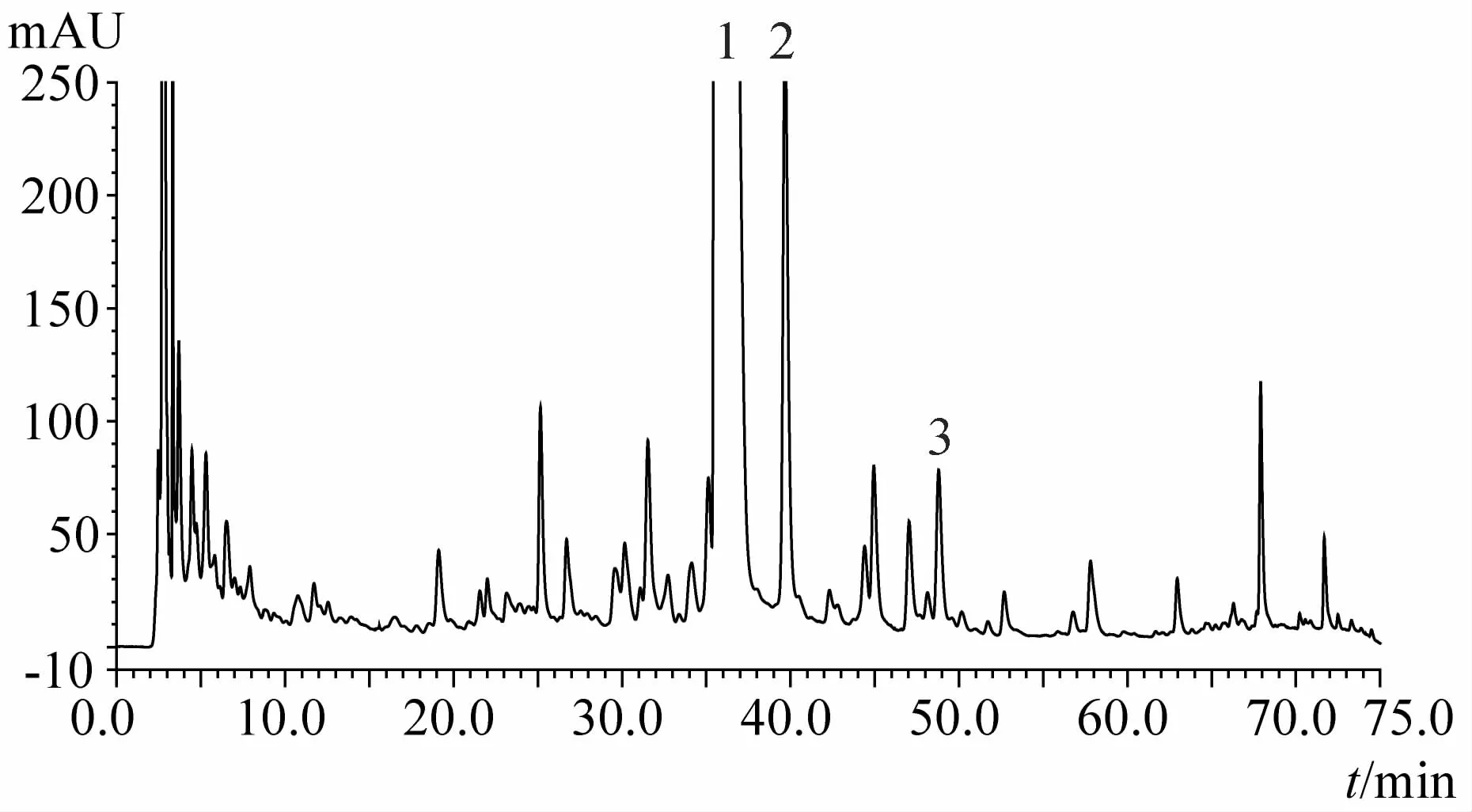
图6 27d时化州柚果皮HPLC指纹图谱
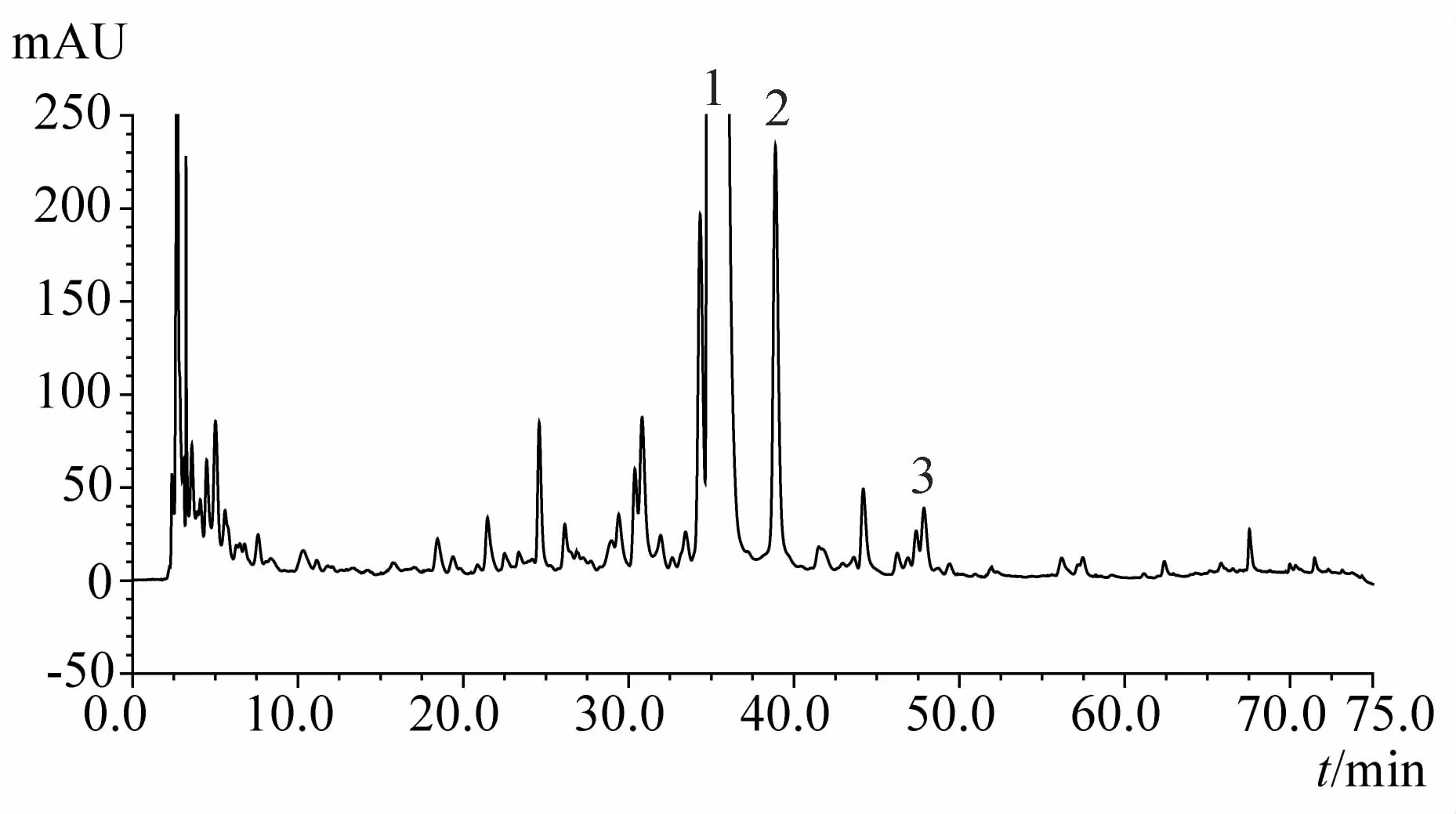
图7 34d时化州柚果皮HPLC指纹图谱
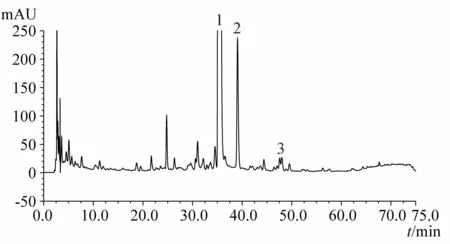
图8 41d时化州柚果皮HPLC指纹图谱
1.4 小结
1.4.1 植物形态 化橘红原植物化州柚为光橘红原植物柚的变种,两者亲缘关系虽近,但树高、果实(大小及外果皮有无毛)等原植物形态已有明显差异,其茎、叶的显微构造差异也十分明显,易于互相鉴别。
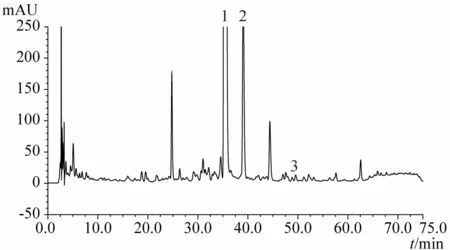
图9 48d时化州柚果皮HPLC指纹图谱

图10 55d时化州柚果皮HPLC指纹图谱
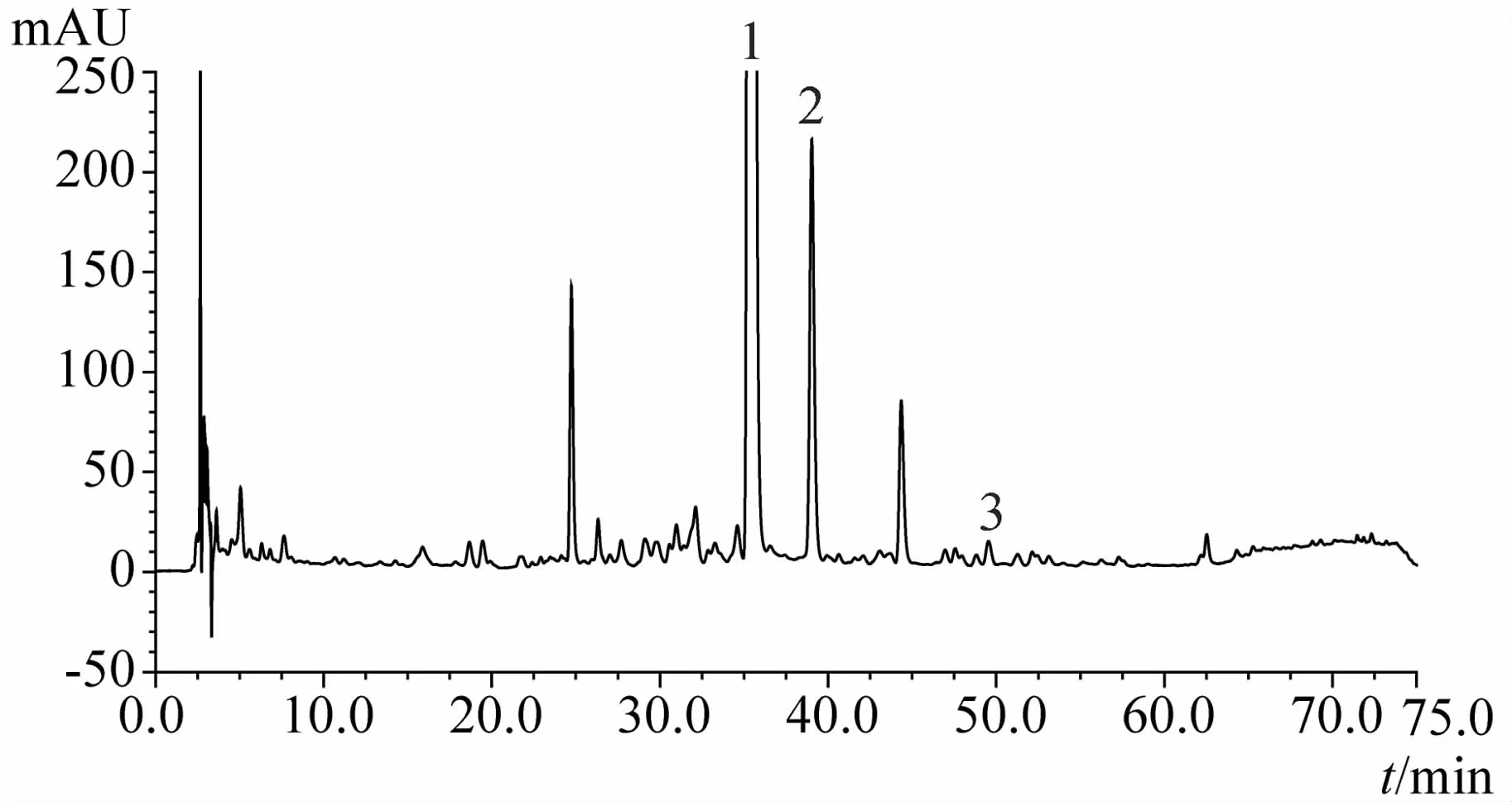
图11 62d时化州柚果皮HPLC指纹图谱

图12 69d时化州柚果皮HPLC指纹图谱
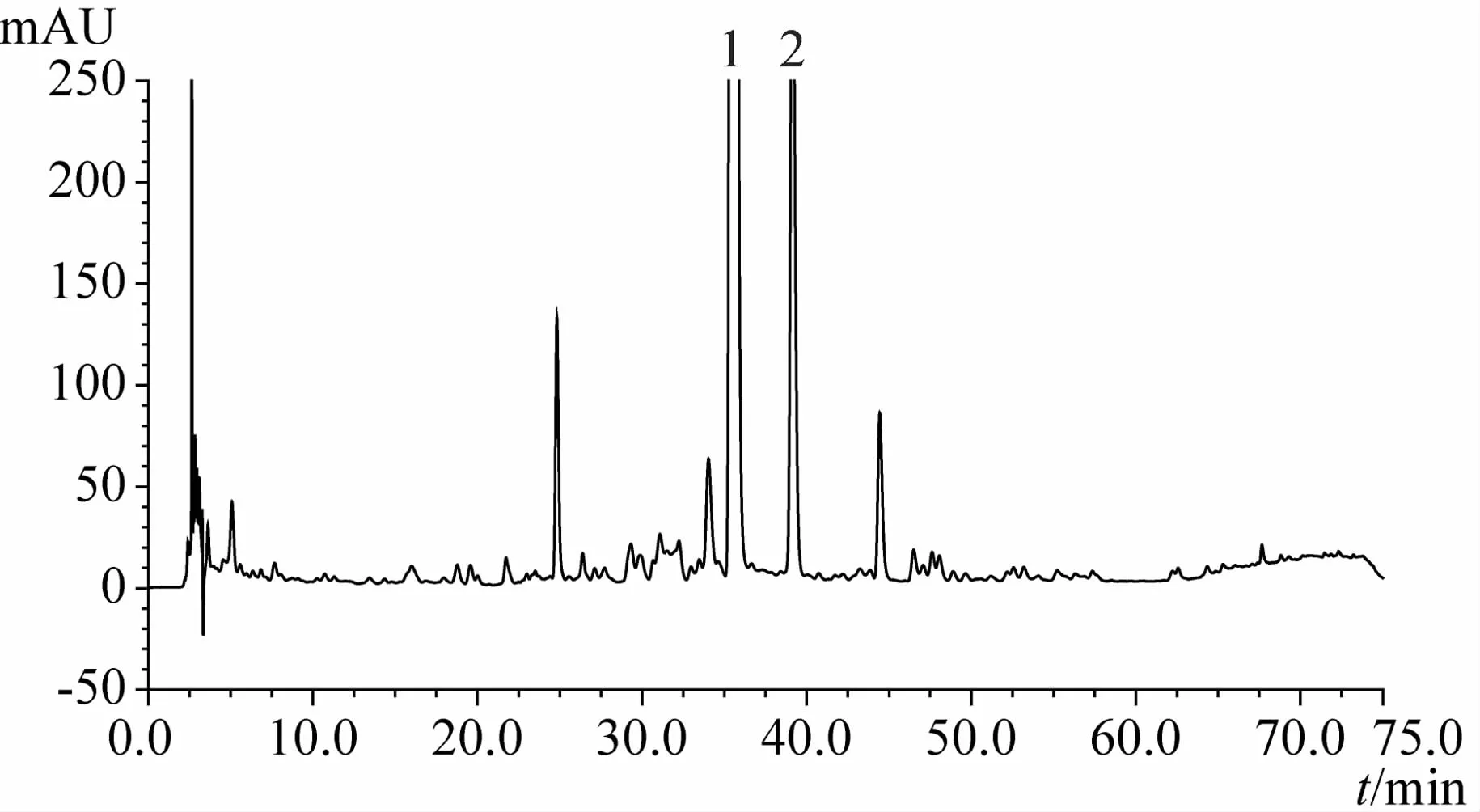
图13 76d时化州柚果皮HPLC指纹图谱
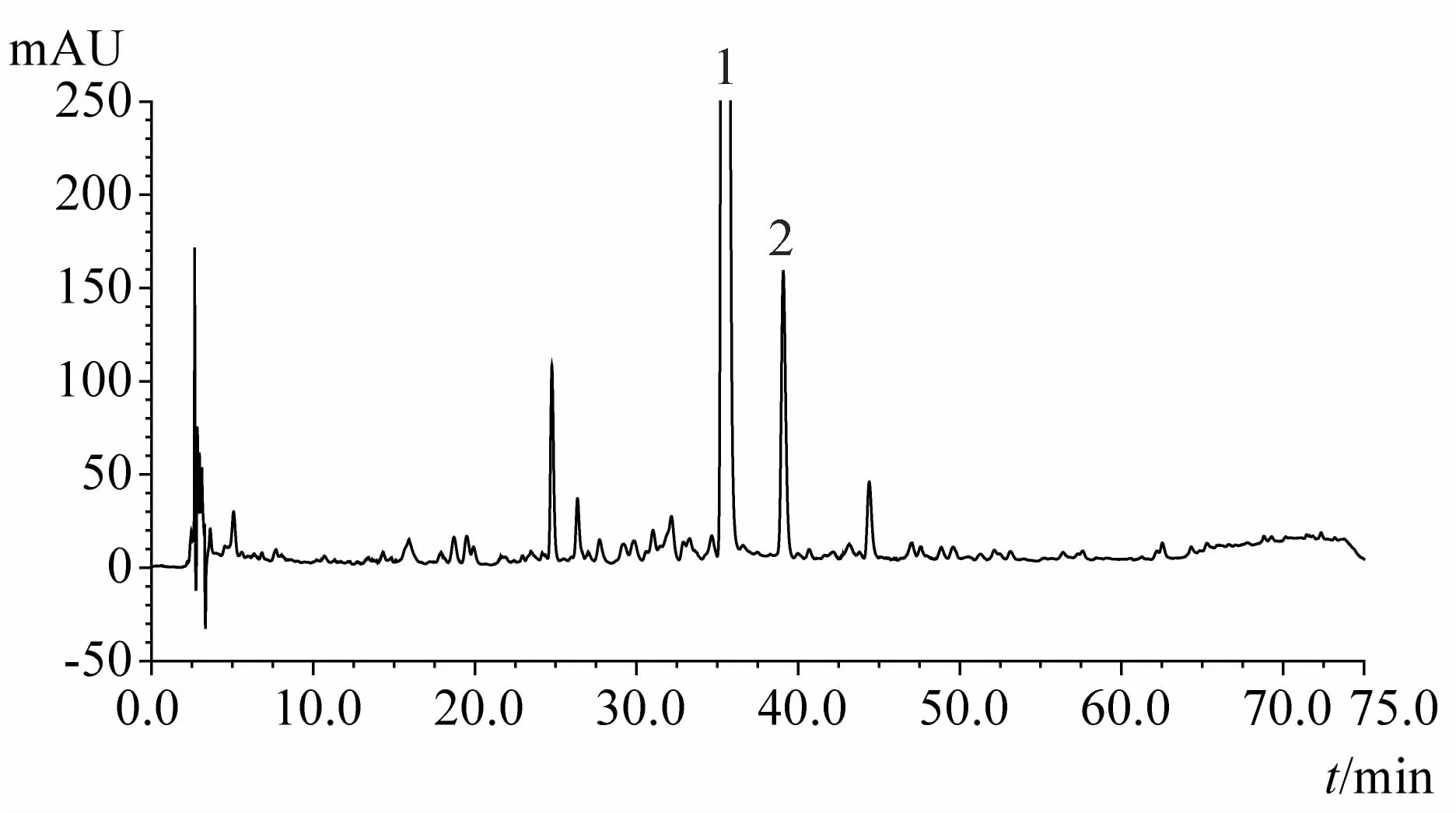
图14 83d时化州柚果皮HPLC指纹图谱

图15 90d时化州柚果皮HPLC指纹图谱
1.4.2 化橘红与光橘红有效成分含量对比 所测3批化橘红总黄酮含量均高于光橘红,其中的主要活性成分柚皮苷也高于光橘红,两品种活性成分含量的主要差异为野漆树苷,化橘红野漆树苷含量为0.62%~0.88%,而光橘红野漆树苷含量仅为前者的1/10左右,具有显著性差异;此差异也造成两者HPLC指纹图谱的各自特点,两者均以柚皮苷为第一高峰,但化橘红以野漆树苷为次高峰,而光橘红野漆树苷仅为第4或5高峰,此差异与两者图谱中的其他特征峰一起,构成了易于鉴别两者的特征指纹图谱。
1.4.3 不同采集时间的化州柚果皮及叶的有效成分含量对比 成果20~41d,化州柚果皮中柚皮苷及总黄酮含量呈急剧下降趋势,48d后下降速度减缓,至83d时达到最低值。化州柚叶总黄酮含量在成果27d时达到峰值,之后含量急剧下降,至41d时达到最低值,然后急剧增加,62d后变化减缓,维持在7.0%~7.6%的较高水平;成果20~41d,化州柚叶柚皮苷含量变化与化州柚果皮相近,呈显著下降趋势,至62~76d期间又呈增加趋势,之后再显著下降。
1.4.4 不同采收时间化州柚果皮及叶指纹图谱对比可见成果20d时化州柚果皮中柚皮苷峰面积最大,之后显著下降;成果20d时野漆树苷峰面积值很低,27d时其峰面积显著增加,至55d期间均维持在较高水平,但62d后野漆树苷峰面积显著下降,83d时峰面积降至最低;而20d时柚苷元峰面积值最高,27d时峰面积值显著下降,之后一直维持下降趋势,成果69d后其指纹图谱中已难以确定柚苷元峰。化州柚叶与果皮指纹图谱存在一定的相似性,其峰面积值最大的两个成分乃为柚皮苷和野漆树苷,柚苷元也是主要成分之一;叶中柚皮苷峰面积值基本随时间降低,野漆树苷峰面积值直至83d时均无显著变化,但90d时却急剧增加,达到峰值;叶中柚苷元峰值出现在成果35d时。
1.4.5 化橘红采收时间 化州柚果实为化橘红(毛橘红)原药材,化州市化橘红原药材采收主要分两类,一为幼果,将制成质量最优的(毛)橘红胎;二是近成熟果,将制成化橘红。本研究结果显示,成果20d时鲜果重11.74g,此时干果皮总黄酮含量50.05%,柚皮苷含量46.01%;成果27d时鲜果重12.68g,总黄酮含量43.64%,柚皮苷含量32.15%;但34d时鲜果重达28.68g,为两周前重量的2.4倍,其干果总黄酮含量31.35%,柚皮苷含量24.56%,药农多此时采收化州柚幼果,作为(毛)橘红胎入药,从经济价值和有效成分含量两方面综合考虑应是可取的。化州柚鲜果重量增加的峰值出现在成果41d时,其重量达到110.19g,几乎为一周前的4倍,此时其干果皮总黄酮含量16.81%,柚皮苷含量13.01%,此时采果作为化橘红原药材,其质量应当较优。
1.4.6 化州柚叶中有效成分的变化 柚皮苷含量基本与果皮柚皮苷含量呈正相关,但两者总黄酮含量却似乎难以找出相关性。由于叶为植物的营养器官,除为其他器官(包括果实)提供糖分等营养物质之外,黄酮类成分等次生代谢物质的形成也必须以糖代谢为前提,作为糖原形成的主要器官,叶中成分的变化应会影响果实中相应成分的变化,对此还需进行深入研究。
2 化橘红鲜果采收标准及质量初步监测方法的制订
根据上述研究结果和结论,制订出化橘红鲜果的以下采收标准。
2.1 来源鉴别
药材来源应为芸香科柑橘属植物化州柚Citrus grandis‘Tomentosa’,采收时应查明待采集者外果皮密被白色绒毛,确定为化州柚后才能采收。
2.2 鲜果直径检验
以游标卡尺判定拟采收的果实直径。
2.2.1 幼果 1.5cm≤果实直径≤3.5cm,外果皮密被绒毛,属特级品。
2.2.2 未成熟果 (1)6.5cm≤果实直径≤6.9cm,外果皮密被绒毛,属一级品。(2)6.9cm≤果实直径≤8.0cm,外果皮密被绒毛,属二级品。(3)近成熟果:果实直径超过8.0cm者,均属于等外品。
3 化橘红初加工品检验标准质量初步监测方法的制订
3.1 产品外观
成品大小均匀,坚实,香气浓郁,园柱直径不得过3cm,高不得过5cm;果皮表面青绿色,绒毛较多,手摸有细毛毡样舒适感。
3.2 水分限量
不得过13%。
3.3 黄酮类成分含量
总黄酮含量≥11.5%,柚皮苷含量≥9.0%,野漆树苷含量≥0.20%。
3.4 初加工产品外观鉴定
3.4.1 特级品 大小均匀,香气浓郁,坚实,成品园柱直径小于2cm,高小于3cm;果皮表面青绿色,密被绒毛,手摸有细毛毡样舒适感。
3.4.2 甲级品 大小均匀,坚实,香气浓郁,成品园柱直径小于3cm,高小于5cm;果皮表面青绿色,绒毛较多,手摸有细毛毡样舒适感。
3.4.3 乙级品 大小均匀,坚实,香气较浓,成品园柱直径4cm左右,高大于5cm,果皮表面褐色,绒毛较少,手感较差。
3.5 有效成分含量测定
3.5.1 特级品 总黄酮含量≥25%,柚皮苷含量≥15%,野漆树苷含量≥0.20%。
3.5.2 甲级品 总黄酮含量≥11.5%,柚皮苷含量≥8.5%,野漆树苷含量≥0.20%。
3.5.3 乙级品 总黄酮含量≥9%,柚皮苷含量≥7%,野漆树苷含量≥0.20。
[1]国家药典委员会.中国药典(一部)[S].北京:中国医药科技出版社,2010:69-70.
[2]梁文皓.化州橘红志[M].广州:广东科技出版社,1993:1-30.
[3]黄美声,沈玉刚.反相高效液相色谱法测定化橘红中柚皮苷的含量[J].中草药,1990,21(5):15-17.
[4]Hou-YC,Hsiu-SL,Yen-HF,et al.Effect of honey on naringin absorption from a decoction of the pericarps of Citrus grandis[J].Planta-Med,2000,66(5):439-43.
[5]欧明,林励,李衍文,等.简明中药成分手册[M].北京:中国医药科技出版社,2003:91-92.
Quality Evaluation,Monitoring and App lication Study of the Medicinal Material Citrus Grandis‘Tomentosa’
Lin Li1,Li Xiangming2,Wan Jianyi2,Chen Zhixia1,Yuan Xujiang1,Huang Lanzhen1
(1.Guangzhou University of Chinese Medicine,Guangzhou Guangdong510405,China;2.Guangdong Huazhou Green Life Co.,Ltd.,Huazhou Guangdong525100,China)
Objective:To evaluate the quality ofCitrus grandis‘Tomentosa’(CGT)and determine its quality monitoring method.Methods:Compare the original plants and their microstructures using phenetic classification and microscopic identification,total flavones using spectrophotometry,naringin contentand fingerprintusing high efficiency liquid chromatography,and rhoifolin content using thin layer chromatography scanning.Results:There are significant differences in exocarp hair and stem non-glandular hair,etc.between the two CGT original plants;the total flavones and naringin content of CGT are higher than those ofCitrus grandis(L.)Osbeck,the rhoifolin content of CGT is ten times that ofCitrus grandis(L.)Osbeck,and there are significant differences in fingerprint.The peak of weight gain of the fresh fruit of CGT occurs on Day 41 of fruit bearing,when its medicinal quality is better.Conclusion:The quality of the genuine medicinal material CGT is significantly better than that ofCitrus grandis(L.)Osbeck,and the harvesting time of CGT should be preferably around Day 41.
CGT;Variety;Identification;Harvesting time;Fingerprint
*万建义,E-mail:srm@greenlifegroup.com.cn

