二株禽支原体的分离与鉴定
刘 玲 管凤霞 黎 敏 宋永峰 高 恒 梁思阳 温纳相(广东温氏食品集团有限公司 新兴 527400)
鸡支原体属原核生物,无细胞壁,由细胞膜包裹[1]。迄今为止确认对鸡致病的支原体有4 种, 包括引起鸡慢性呼吸道病和火鸡传染性窦炎的禽鸡毒支原体(MG),引起鸡和火鸡亚临床或临床感染的滑液囊支原体(MS),引起火鸡气囊炎的火鸡支原体和衣阿华支原体(MI)[2]。
MG可引起家禽慢性呼吸道病(CRD),本病流行于世界各国,是当前冬春季节影响禽类生产的常见疾病之一。其特征性的症状是呼吸啰音、咳嗽、气管炎、气囊炎、流眼泪等。MG除引起呼吸道疾病症状外,还导致雏鸡成活率低,生长迟缓,增重减慢,饲料转换率降低,肉鸡屠宰率降低;MS感染主要引起家禽的滑膜炎、呼吸道症状,临床表现为:冠苍白、跛行、关节肿胀、轻度啰音、生长迟缓、产蛋下降等[1]。
本研究从广东某鸡场送检的疑似支原体感染病料中分离、培养获得了2株支原体,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 病料 来自广东新兴某鸡场的病鸡,无菌取病鸡下支气管三叉部、肺脏等。
1.1.2 试剂 改良的 Frey 氏培养基购自北京鼎国生物技术有限公司、支原体标准菌株、抗原、阳性血清,均购自中国兽药监察所。DNA提取试剂盒购自北京天根生化科技有限公司,Ex-Taq酶购于大连宝生物工程公司。
1.1.3 仪器设备 生化培养箱、二氧化碳培养箱、倒置显微镜、蒸汽灭菌器、PCR仪等。
1.2 试验方法
1.2.1 支原体的初步分离 无菌操作:将下支气管三叉部、气囊、肺等部位的组织,分别用2000IU/ml的青霉素漂洗3遍并剪碎成芝麻粒大小后,各种组织分别挑选3块加入装有1.8ml液体培养基的西林瓶中,盖好胶塞。置37℃生化培养箱中培养,每天观察液体培养基颜色变化和混浊度,有杂菌生长者弃之。每隔3d盲传一代,要求至少传三代,有颜色变化,注意及时调节pH值;若无颜色变化,继续观察15d后弃之。
1.2.2 分离物的纯化 将变色后的液体培养基接种到固体培养基中,于37℃培养8d,待菌落生长后挑选单个菌落再接种到液体培养基中,连续重复3次,以取得纯培养物。
1.2.3 分离物的形态观察 取纯培养物涂于载玻片上,姬姆萨染色,显微镜下观察菌体形态。
1.2.4 血清学诊断 平板凝集试验(SPA):取10ml纯培养物以4000rpm 离心30min,弃上清,用0.5ml生理盐水重悬菌体,作为抗原液。滴3滴抗原于载玻片上,每滴抗原依次加入等量的生理盐水、标准MG抗血清、标准MS抗血清,充分混匀后,3min内判定结果,液滴中出现明显的粗大颗粒者为阳性。并同时设标准的MG、MS阳性对照。
1.2.5 分子生物学 根据GenBank上公布的MG、MS序列,设计套式PCR引物见表1,并由上海英骏生物技术有限公司合成。套式PCR引物设计选取的基因片段及目标片段大小见表2。取纯培养物,提取DNA进行套式PCR扩增,凝胶电泳观察结果。

表1 PCR引物

表2 PCR目标片段
2 结果
2.1 初次分离及纯化结果
初次分离,2个样品接种于液体培养基中培养3d。培养基颜色变黄,盲传及纯化后,接固体平皿上增殖至第7天,在倒置显微镜下看到典型的“煎蛋”样,具有一个致密中心的突起菌落(见图1)。

图1 支原体固体平板上的“煎蛋”样菌×80
2.2 姬姆萨染色结果
姬姆萨染色后光镜下可见菌体大多呈球点状或链球状,菌体被染成紫色,说明分离到2株支原体,分别命名为GX1和GX2。
2.3 血清学结果
在血清平板凝集试验中,MG抗血清能使分离株GX1发生凝集,MS抗血清能使分离株GX2发生凝集,2min内形成明显的粗大颗粒。平板凝集结果见表3,初步说明GX1株是MG,GX2株是MS。
2.4 套式PCR结果
将PCR产物通过琼脂糖凝胶电泳进行分析,结果显示:GX1株可以扩增出约408bp的目的片段,即MG阳性,;GX2株可以扩增出688bp的目的片段,即MS阳性(见图2)。

表3 血清学结果
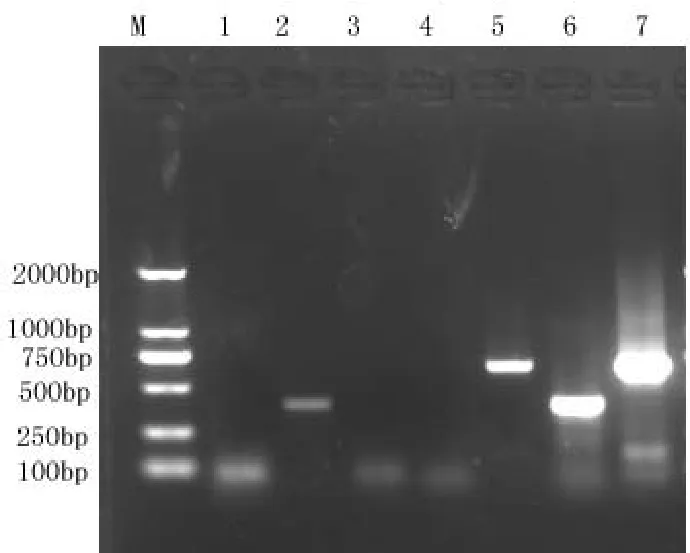
图2 MG MS扩增结果
3 讨论
此试验成功在本实验室建立支原体分离培养鉴定的方法,并根据培养特性观察、血清学试验、分子生物学试验结果判定从病料分离到2 株支原体分离物,一株为鸡毒支原体,另一株为滑液囊支原体,为以后开展该病的研究奠定了基础。
由于支原体既可通过水平传播,又可经卵垂直传播,从而导致鸡群发生感染时很难将其彻底清除。目前检测方法主要有分离培养法、电镜法、血清学方法以及分子生物学方法[3],血清学方法由于常出现非特异性的交叉反应而影响诊断的准确性[4],而分离培养由于支原体对所需条件要求苛刻,培养时间长,操作繁杂,不适应现代集约化养禽业发展的需要[1]。PCR 法方法简单快速,敏感性远高于前两种方法,可应用于该病的早期诊断和检疫,但技术条件要求较高,在检测时常由于抑制剂的干扰等因素而可能出现假阳性反应[5],因此最终确诊需要多种检测方法联合使用。
支原体所需培养条件高,生长缓慢,不易分离得到。结合本次试验,对该技术的几个关键点进行总结。据文献[6]报道新鲜支气管和肺组织中因杂菌污染少容易分离出鸡毒支原体, 因此本试验取与肺相连的三叉气管剪碎成芝麻粒放入改良的Frey氏培养基培养,分离率明显较其它器官提高。培养过程中,液体培养基颜色变黄时调pH值一般直接滴加20%氢氧化钠,但这样对处于生长期的病原应激较大,建议滴加pH值10~12的培养基进行调节。因致病性支原体在固体培养基上培养需3~10d才能形成菌落,而无致病性支原体,如鸡支原体、家禽支原体1d内就可能形成菌落,因此,2d内形成的菌落,均可判为污染物弃之。醋酸铊抑制真菌生长,在分离培养过程中发挥着关键性作用,由于支原体生长速度较慢,为防止初次分离时其它杂菌生长消耗大部分营养,影响支原体的正常增殖,所以初次分离培养时,醋酸铊、青霉素必须用量加倍。
[1]Yoder, H. W., Jr. Mycoplasma gallisepticum infection. In:Disease of Poultry, 9 th ed. B. W. Calnek, H. J. Barnes, C. W. Beard, R. W. Reid and H. W. Yoder, Jr., eds. Iowa State University Press, Ames, Iowa. In press.1991.212-231.
[2]邵国清. 我国主要动物支原体病研究述略与展望[J].畜牧与兽医,2000, 32 (2) : 37-38.
[3] 段艳华,刘畅,宋海涛等.鸡毒支原体的诊断与防治[J].上海畜牧兽医通讯,2007,2:60-61.
[4]陈凤梅,牛钟相,程光民等. 鸡毒支原体研究进展[J].动物医学进展,2004 , 25 (3) :56-59.
[5]刘利明,冯立志,胡登峰等. 鸡毒支原体研究进展[J].中国畜牧兽医,2005 , 32 (6) :61-62.
[6]林居纯,曾振灵,向荣等.鸡毒支原体的分离鉴定[J].养禽与禽病防,2007,8:21-22.

