园参根不同部位双向电泳图谱的比较分析
孙立伟,马朋涛,2,麻 锐,雷秀娟,陈雪楠,祁 超
(1.北华大学生命科学中心,吉林132013;2.华中师范大学生命科学学院,武汉替换为 430079)
园参根不同部位双向电泳图谱的比较分析
孙立伟1,马朋涛1,2,麻 锐1,雷秀娟1,陈雪楠1,祁 超2*
(1.北华大学生命科学中心,吉林132013;2.华中师范大学生命科学学院,武汉替换为 430079)
通过对经典 TCA-丙酮提取法加以优化,结合超声破碎技术,建立了园参芦头、主根、须根、表皮等4个不同部位的双向电泳图谱,采用Image Master 2D Platinum 6.0对其进行比较分析,发现了人参不同部位13个相同的蛋白点,并在主根中发现了2个特异点,在芦头和表皮中发现了1个特异点,在须根中发现了1组特异点群(3个点).另外,还发现了2个蛋白出现明显表达差异的区域,从而为建立在蛋白分子水平上人参内在质量评价和鉴定方法提供依据,丰富了其内在质量评价标准体系.
人参不同部位;双向电泳;质量标准评价
人参 (Panax ginsengC.A.Meyer)是一种传统名贵中药,主要以根部入药,其药理学活性成分以人参皂苷为主,具有抗衰老,抗辐射,抗乳癌(雌激素活性),促进血管生成,治疗心脑血管疾病等作用[1-6].据神农本草经和现代人参研究表明,人参根部各部分药效成分和含量不尽相同,具有不同的药理学效用[7-9].目前我国市场上出售的主要是种植人参,也称园参,其质量标准的评价主要以外观和人参皂苷含量为主[10-13].但仅以这些指标对其进行科学的质量评价还不够完善,尤其对这些具有同一基因型个体的不同部位还很难进行有效质量评价.所以制定一个科学、有效的人参质量标准评价体系十分必要.
蛋白质作为植物体内基因表达的最终产物能够在蛋白分子水平真实反应生物体内基因表达的变化.近年来随着植物蛋白质组学的迅速发展和植物基因组数据库的不断完善,利用蛋白质组学技术对植物体不同部位的基因动态表达情况进行研究,对于探寻不同部位科学有效的质量评价方法是十分必要的[14-16].
2002 年John等[9]首次利用双向电泳(2-DE)技术对高丽参不同部位和美国产西洋参主根蛋白表达图谱进行了比较研究.研究表明利用各2-DE图谱模式的不同,可以鉴别高丽参不同部位和美国产西洋参主根.这也为中国园参不同部位的鉴别和质量标准制定提供了参考和可行性.但由于当时提取方法和质谱灵敏度的限制,其得到的2-DE图谱仅有较少的蛋白点,并且只针对其中6个相同点进行了质谱鉴定和分析,远远达不到对园参不同部位蛋白表达差异研究的需求.为此,针对中国园参富含多糖、多酚、皂苷、核酸等干扰物质的特点[17],优化了其蛋白提取方法,得到了园参不同部位的2-DE图谱,并对其进行了系统的比较分析,为园参根不同部位的鉴别提供了科学有效的理论依据,并为其内在质量评价标准体系的完善奠定了蛋白分子水平基础.
1 实验材料和方法
1.1 实验材料
新鲜5年生园参样品产自吉林抚松地区.参考John等[9]的分部位方法,将样品分为须根、芦头、主根、表皮4部位.各部位样品用去离子水洗净晾干后,加入液氮研磨,待成粉末后,放于-80℃冰箱冻存待用.
1.2 主要试剂
Acr、Bis、Glycine、SDS、Tris、TEMED、Urea、Glycerol、β-Mercaptoethanol、SB3-10、TCEP 均购自美国 Amresco公司;AP、Thiourea、CHAPS、PMSF、CBB R-250、CBB G-250、Bromophenol blue购自美国 Sigma公司;Protein inhibitors、Agar-ose、Marker购自美国 Promega公司;DTT、IAA购自德国 Merck公司;BSA购自日本 TaKaRa公司.
1.3 实验方法
1.3.1 样品蛋白提取 称取分部位样品粉末各0.25 g,分别加入7倍体积(w/v)-20℃预冷丙酮(含体积分数为10%的TCA和体积分数为0.07%β-巯基乙醇),旋涡混匀后于 -20℃放置 2 h,15 000 r/min、4℃条件下离心15 min弃上清,取沉淀,沉淀用预冷丙酮清洗至少3次,-20℃放置待沉淀中丙酮完全挥发后,加入4倍体积裂解液(7 mol Urea,2 mol Thiourea,2%CHAPS,2%SB3-10,1%PMSF,1%蛋白酶抑制剂),旋涡混匀,100 W超声40 min后,15 000 r/min、4℃条件下离心15 min,收集蛋白上清液.
1.3.2 蛋白含量测定 本实验以BSA为标准物,参照Bradford法[18]稍做改进,进行蛋白质含量测定.
1.3.3 2-DE 取适量蛋白上清液(250μg),加入样品再水化液(5 mol Urea,2 mol Thiourea,2%CHAPS,2%SB3-10,0.65%3-10IPG buffer,0.35%4-7 IPG buffer)至终体积125μL后,加入到IPG胶条槽,进行样品再水化和等电聚焦(IEF).IPG胶条规格为7 cm p H 3~10 L(GE Healthcare),等电聚焦选用Ettan IPGPhorII(Amersham Biosciences)等电聚焦仪,聚焦程序设置如下:step 1:Step 30 V 11 h;step 2:Step 100 V 1 h;step 3:Grad 500 V 1 h;step 4:Grad 1 000 V 2 h;step 5:Grad 5 000 V 4 000 Vhr;step 6:Step 5 000 V 6 000 Vhr;二向 SDS-PAGE,选用 Hofer Mini-VE(Amersham Biosciences)电泳槽,12.5%分离胶(10×11×0.1),5 mA/gel,转移 15 min,10 mA/gel分离3 h后,考马斯亮蓝R-250染色.
1.3.4 图像扫描及对比分析 使用 Image scanner扫描仪进行图像扫描.扫描仪参数设置为256阶灰度、600 dpi分辨率,图像保存为 TIFF格式.扫描后的图像用Image Master 2D Platinum Software Version 6.0进行处理、分析,包括蛋白点的检测、匹配、数据分析和输出等,找出各部位的差异点,并对其进行初步分析.
2 结果与讨论
2.1 园参蛋白提取方法的优化
蛋白提取的质量是2-DE成功分离蛋白的前提和关键.作为一种具有广泛药理学活性的中药,园参根富含皂苷、多糖、挥发油等多种次生代谢物质,同时作为一种植物储存器官,其根细胞又含有较厚的细胞壁和大量的淀粉、多酚、核酸、色素等化学成分[17].多种次生代谢物质和化学成分的存在使得很难利用常规的蛋白提取方法制备出高纯度的样品总蛋白,严重影响了2-DE图谱的质量[19-21].为此,本实验结合上述园参的特性,对常规的 TCA/丙酮沉淀法进行了大量的条件摸索与优化(结果未显示),比较了不同的细胞破碎方法和裂解液配方之间的组合效果,最终确定了采用超声方法细胞破碎和优化的TCA/丙酮沉淀法相结合的蛋白提取方法.超声波是一种强有力的物理波,它产生的剪切力在将细胞壁彻底破碎的同时也能将核酸、多糖等大分子干扰物质剪切成小片段,优化的 TCA/丙酮沉淀法则具有进一步除糖、有效降低次生代谢物质干扰和减少蛋白降解的优点,因此,两者结合能使样品除杂更彻底,双向电泳效果更好.
2.2 园参不同部位蛋白提取量的分析比较
本实验采用Bradford法对提取得到的园参根不同部位蛋白进行浓度测定,随后对其蛋白提取量进行了比较分析,结果见表1.表1表明,4部位中须根蛋白提取量明显高于其他3部位,达到27.0±0.11 mg/g鲜重,芦头(14.7±0.09 mg/g鲜重)和表皮(12.8±0.12 mg/g鲜重)次之,主根(10.6±0.08 mg/g鲜重)最低,仅为芦头蛋白提取量的39.3%.所以,仅从蛋白提取量方面也能看出4部位存在着明显的区别,提示4部位之间药理学成分合成量与成分之间的区别,可做为4部位质量标准鉴定与评价的潜在指标.

表1 园参不同部位蛋白提取量Tab.1 Protein yield of different parts of ginseng
2.3 园参不同部位蛋白SDS-PAGE图谱的分析比较
SDS-PA GE电泳图谱如图1所示,可以看出,4部位SDS-PAGE图谱中均存在3条较高丰度的带,其灰度占总条带灰度的95%以上,这将对后续的2-DE图谱的获得带来很大困难,造成高丰度蛋白区域对低丰度蛋白的掩盖,以及低丰度蛋白由于过低丰度造成蛋白点在低丰区域无法显现,为此我们摸索了不同细胞破碎方法和裂解液配方的有效组合,确定了最佳的适合低丰度蛋白提取的方法(结果未显现).比较4部位 SDS-PAGE图谱可以看出,在20 100~31 000区域,芦头与其他3部位存在2条丰度明显不同的条带,在66 200附近存在1条丰度明显低于其他3部位的条带,且在31 000~66 200区域之间的低丰度蛋白条带数目明显多于其他3部位.表皮的66 200以上区域条带明显少于芦头和须根,但多于主根,且在31 000~66 200低丰度蛋白区域条带的丰度要稍高于其他3部位.须根在20 100~31 000区域只存在2条高丰度蛋白,且丰度明显高于芦头,稍高于表皮,并且在2条高丰度度条带下方较其他3部位明显少1条丰度明显的条带.而主根在66 200以上区域与其他3部位相比出现明显条带空白.通过以上比较分析说明,园不同部位仅从SDS-PAGE图谱看就存在较大区别,说明其蛋白组成有着较大的差异,可能会对药效成分的合成产生影响,可做为其质量标准评价与鉴定的参考.
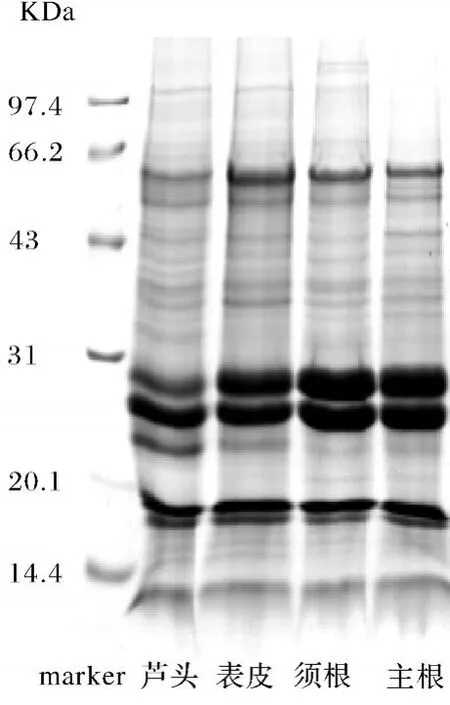
图1 园参不同部位的SDS-PAGE图谱Fig.1 SDS-PAGE pattern of different parts of ginseng root
2.4 园参不同部位2-DE图谱的比较分析
图2所示为经过3次重复实验所得的园参根不同部位蛋白2-DE图谱.据软件分析可知,园参主根蛋白点约有90%涵盖于须根蛋白点之中.文献报导称人参须根比主根功效好,是因为参须含人参皂甙的量是主根的3倍多[22].而实验结果也证明,园参主根中的蛋白点也远少于须根,仅有须根蛋白点的三分之二.因此,园参须根比主根功效好,是否不仅与人参皂甙含量有关,还与人参蛋白有关;或者由于所含的园参蛋白不同导致其皂苷含量不同,需要进一步实验证明;而园参表皮也有90%以上的蛋白点涵盖于须根蛋白点之中,这可能是由于细长的参须肉少皮多,表皮的面积占了多数所致.据《本草便读》记载,人参,须则横行支络,补而下行;芦堪呕吐虚痰,苦能上达.而现在临床实验表明人参芦头并没有呕吐之副作用,实验结果发现,园参芦头和须根在蛋白组成上仅有一些差别(如图3和图4所示,且在芦头蛋白图谱中发现了一个特殊的点 RH,其分子量在25 000~20 000之间,pI偏碱性,至于这些差异点是否与芦头呕吐功效相关,还需进行质谱鉴定.另外,文献已报导高丽参每个部位及西洋参的主根中都存在P1-P6 6个点,且这些点可以被很好地分离.其pI大约在5.1~6.1,分子量在21 000~40 000之间[9].在园参的每个部位也同样发现了这6个点.高丽参每个部位及西洋参的主根中也存在C1-C3 3个点,其pI大约在4.28~4.44,分子量约为18 000.园参中在这3个共同点的位置上发现了蛋白点团,园参不同部位还发现了一些共同的蛋白点和蛋白团,分子量在15 000~25 000之间,已标出13个点,如图中白色粗线圆圈所示.另外,在主根图谱中发现了2个特异点MR1和MR2,它们的分子量在25 000~20 000之间,pI偏酸性,大约为3.0.芦头图谱中发现了1个特异点 RH,其分子量在25 000~20 000之间,pI偏碱性,大约为8.0.表皮中发现了1个特异点RS,其分子量大小约为14 400,pI偏酸性,大约为5.5.在须根中发现了1个特异点群 RXG(包括丰度明显的1个点和丰度偏小的2个点),35 000左右,pI偏碱性,大约为8.5.以上这些蛋白点的异同可对不同参种和园参不同部位的质量评价和鉴定提供参考.
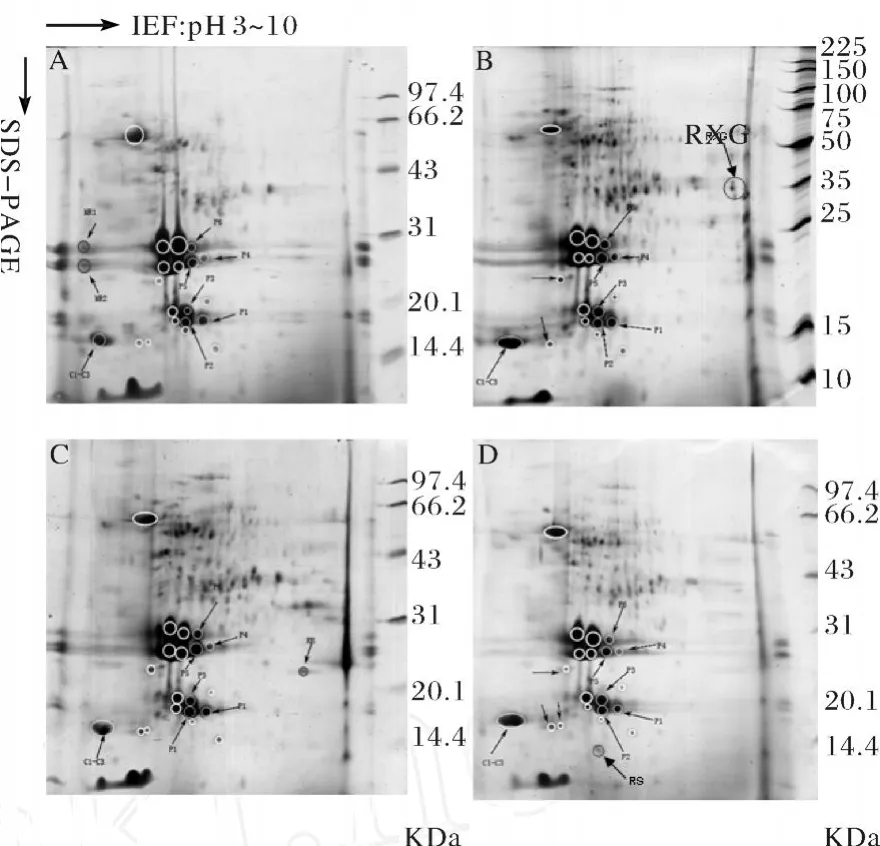
图2 园参不同部位的2-DE图谱Fig.2 The 2-DE patterns of different parts of ginseng root
对比4部位2-DE图谱,在一些区域还发现了明显的蛋白表达发生变化的区域,列举如图3和图4所示:图3为分子量在97 400~66 200,等电点在4.5~5.5的一段蛋白区域,园参各部位在此处的蛋白点模式和蛋白浓度各不相同(箭头处标示).须根和芦头在此处各有两个明显的点,但须根点的浓度远远高于芦头.表皮和主根在此处各有一个明显的点,但两者的蛋白浓度也存在很大差别.图4所示为园参各部位蛋白在偏碱性区域的明显不同,它们为分子量在66 200~20 100之间的一组蛋白.以上区域蛋白表达丰度的变化可进一步说明园参4部位在蛋白表达谱上存在明显差异,可能会对药效成分的合成产生影响,造成4部位药效的差异,可做为园参不同部位质量评价和鉴定的标准.
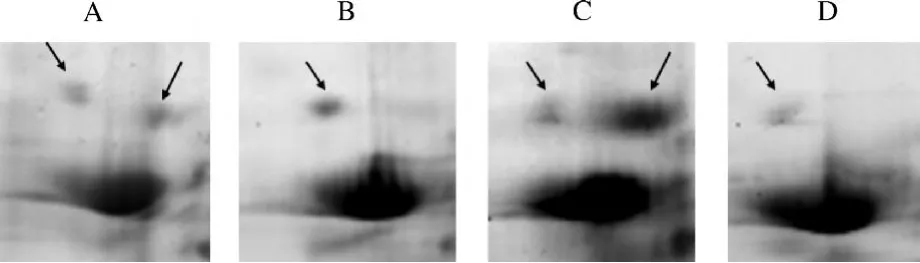
图3 不同部位人参蛋白蛋白表达差异点(区域Ⅰ)Fig.3 Different protein sports of the ginseng different parts(RegionⅠ)
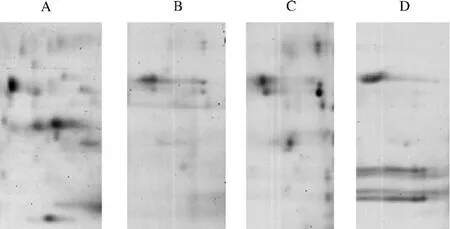
图4 园参不同部位蛋白蛋白表达差异点(区域Ⅱ)Fig.4 Different protein sports of the ginseng different parts(RegionⅡ)
3 结论
本实验通过对园参不同部位蛋白提取量、SDS-PAGE和2-DE图谱的比较,发现了园参主根、须根、表皮和芦头之间的共性及差异,可以为园参内在质量评价标准的制定提供一定的实验基础和理论指导,为各部位的鉴定提供方法指导,也将为其它中药质量评价的研究提供新思路.同时,后续的质谱鉴定工作也在进行中,可为园参药用机制的探讨打下基础,推进我国人参产业的全面发展.
[1]Leung K W,Yung K K,Mak N K.Angiomodulatory and neurological effects of ginsenosides[J].Curr Med Chem.2007,14(12):1371-1380.
[2]Wang Y Z,Chen J,Chu S F,et al.Improvement of memory in mice and increase of hippocampal excitability in rats by ginsenoside Rg1’s metabolites ginsenoside Rh1 and protopanaxatriol[J].J Pharmacol Sci.,2009,109(4):504-510.
[3]Cai B X,Jin S L,Luo D,et al.Ginsenoside Rb1 suppresses ultraviolet radiation-induced apoptosis by inducing DNA repair[J].Biol Pharm Bull,2009,32(5):837-841.
[4]Lau W S,Chan R Y,Guo D A,et al.Ginsenoside Rg1 exerts estrogen-like activities via ligand-independent activation of ERalpha pathway[J].Journal of Steroid Biochemistry&Molecular Biology,2008,108(1-2):64-71.
[5]Jin J,Shahi S,Kang H K,et al.Metabolites of ginsenosides as novel BCRP inhibitors[J].Biochemical and Biophysical Research Communicat-ions,2006,345(4):1308-1314.
[6]Cai B X,Li X Y,Chen J H,et al.Ginsenoside-Rd,a new voltage-independent Ca2+entry blocker,reverses basilar hypertrophic remodeling in stroke-prone renovascular hypertensive rats[J].European Journal of Pharmacology,2009,606(1-3):142-149.
[7]江苏中医学院.中药大辞典[M].上海:上海科学技术出版社,1986:2232.
[8]李红艳,赵 雨,杨士慧,等.人参不同部位超氧化物歧化酶活力比较[J].时珍国医国药,2010,21(3):513-514.
[9]John Hon-Kei Lum,Ka-Lee Fung,Pik-Yuen Cheung,et al.Proteome of Oriental ginseng Panax ginseng C.A.Meyer and the potential to use it as an identification tool[J].Proteomics,2002,2:1123-1130.
[10]张崇禧,郑友兰,李向高,等.规范化栽培的吉林人参质量评价研究[J].吉林农业大学学报,2003,25(4):404-406.
[11]潘坚扬,程翼宇,王毅,等.9种人参皂苷同时测定方法及在人参质量鉴别中的应用[J].分析化学,2005,33(5):1565-1568.
[12]徐 晶,窦德强.人参的质量标准研究[J].中国现代中药,2008,10(3):21-24.
[13]郑友兰,张崇禧,李向高,等.吉林人参的质量评价指标与方法[J].人参研究,2001,13(2):12-14.
[14]Gygi S P,Corthals GL,Zhang Y,et al.Evaluation of twodimensionalgelelectrophoresis-based proteome analysis technology[J].Proc Natl Acad Sci USA,2000,97(17):9390-9395.
[15]Silke Oeljeklaus,Helmut E.Meyer,Bettina Warscheid.Advancements in plant proteomics using quantitative mass spectrometry[J].Journal of Proteomics,2009,72(3):545-554.
[16]Celis J E,Ostergaard M,Jensen N A,et al.Human and mouse proteomic databases:novel resources in the protein universe[J],Febs Lett,1998,430(1-2):64-72.
[17]张崇喜.人参、西洋参和三七化学成分的研究[D].中国博士论文库:吉林农业大学,2004.
[18]Bradford M.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1996,72:248-254.
[19]Saravanan R S,Rose J K.A critical evaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrant plant tissues[J].Proteomics,2004,4(9):2522-2532.
[20]Tsugita A,Kamo M.2-D electrophoresis of plant proteins[J].Methods Mol Biol,1999,112:95-97.
[21]Rabilloud T.Solubilization of proteins for electrophoretic analyses[J].Electrophoresis,1996,17(5):813-829.
[22]胡献国.为什么参须比参主根功效好[J].中国食品,1992(2):48.
Abstract:This research aimed at establishing the 2-DE maps of ginseng rhizome,main root,lateral root and skin respectively,and comparing the differentially expressed proteins of different parts of ginseng.By the optimized TCA/acetone extraction method and the ultrasonication technology,four parts 2-DE maps of ginseng were obtained,and 13 spots were found in all parts of ginseng.Meanwhile,two special spots were found only in the main root,and one special spot in the rhizome,one special spot in the skin and one special spot group(three spots)respectively.In addition,two areas of differentially expressed proteins were also found in the 2-DE maps.These all provide the theoretical basis for the establishment of internal quality evaluation and identification for ginseng at the protein level,which could enrich the quality evaluation standard system.
Key words:different parts of ginseng;Two-dimensional gel electrophoresis(2-DE);quality evaluation standards
Two-dimensional electrophoresis analysis for different parts of Panax ginsengC.A.Meyer root
SUN Liwei1,MA Pengtao1,2,MA Rui2,L EI Xiujuan2,CHEN Xuenan1,QI Chao2
(1.Life Science Research Center,Beihua University,Jilin 132031;2.College of Life Science,Huazhong Normal University,Wuhan 430070)
Q946
A
1000-1190(2010)04-0639-05
2010-06-10.
国家科技支撑项目(2007BAI38B02);吉林市科技发展计划(200813).
*E-mail:qichao@mail.ccnu.edu.cn.

