产漆酶真菌的筛选及其固态发酵条件研究
蒋冬冬,李 莉,赵新海,张庆华,关艳丽,钟丽娟,朱巍巍,郭玲玲
(1.沈阳农业大学,辽宁沈阳 110161;2.辽宁省微生物科学研究院,辽宁朝阳 122000)
产漆酶真菌的筛选及其固态发酵条件研究
蒋冬冬1,李 莉2*,赵新海2,张庆华2,关艳丽2,钟丽娟2,朱巍巍2,郭玲玲2
(1.沈阳农业大学,辽宁沈阳 110161;2.辽宁省微生物科学研究院,辽宁朝阳 122000)
用愈创木酚平板法对14株白腐真菌进行初筛,通过测定漆酶活力进行复筛,筛选出1株生活力较强,产漆酶活力高的菌株MZ-1,经ITS-5.8S r DNA序列分析,初步鉴定为Trametes versicolor。在固态发酵培养基的基础上,对该菌株产漆酶的培养基组成进行正交优化,得到最优发酵培养基:麸皮∶秸秆粉∶豆粕∶玉米粉为3∶3∶2∶1,可溶性淀粉2%,(NH4)2SO4+蛋白胨1%,KH2PO40.1%,料水比1∶2。接种4个菌塞,温度为30℃,发酵8 d后酶活可达到1555.57 U/g。
漆酶;固态发酵;发酵条件;正交优化
漆酶(laccase,ECI.10.3.2)是一种含铜的多酚氧化酶,与抗坏血酸氧化酶和哺乳动物血浆铜蓝蛋白同源,都属于蓝色多铜氧化酶家族。在自然界中,漆酶分布于多种植物、真菌体内以及少数昆虫和细菌中[1]。漆酶皆为糖蛋白,其含糖量和种类因来源不同而有所不同,该酶具有广泛的底物专一性。不同漆酶之间的作用范围也不尽相同,涉及的底物主要包括单酚、对-苯二酚、甲氧基酚、抗坏血酸和二胺化合物(如苯二胺、多巴胺)等[2]。由于漆酶具有氧化与木质素有关的酚类和非酚类化合物以及高度难降解环境污染物的能力,因此在食品工业、制浆和造纸工业、纺织工业、土壤的生物修复等领域具有广泛的应用前景[1,3-4]。目前对漆酶的生产研究较多的是液态发酵,但在自然界中,白腐菌主要生长在木材上,固态发酵比较适合自然界的生态环境,且固态发酵具有原料来源广泛[5],易于推广等优点,已成为近几年研究的热点之一[6-7]。本研究从自然界筛选能产生漆酶的真菌,优化其固态发酵条件,以期为今后的研究和工业生产提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种来源 自分离的白腐菌3株,实验室保藏白腐菌11株,共14株。
1.1.2 培养基 ①PDA-愈创木酚培养基:马铃薯20%,葡萄糖2%,琼脂2%,灭菌后添加愈创木酚0.04%;②复筛培养基:麸皮3 g,秸秆粉2 g,豆粕2 g,玉米粉2 g,水9 mL;③固态发酵基础培养基:麸皮∶秸秆粉∶豆粕∶玉米粉为3∶3∶2∶1,可溶性淀粉5%,(NH4)2SO4+蛋白胨2%, KH2PO40.2%,料液比1∶2。
1.2 方法
1.2.1 初筛 取活化6 d的菌株平板,用打孔器制备1.0 cm的菌塞,接种到PDA-愈创木酚显色培养基平板中,置(30±1)℃条件下恒温培养4 d,记录菌落周围有无红棕色轮环产生,菌落生长的直径为d1,变色圈直径为d2,计算d1∶d2,根据所产生变色圈的大小及变色程度,选出d1∶d2比值较小且生活力较高的菌株并用保藏培养基留种。
1.2.2 复筛 将初筛所得的菌株接种到复筛培养基中,进行产酶发酵试验,最终分离得到产漆酶活力较高的丝状真菌。
1.2.3 菌株鉴定 ①菌株形态观察:于PDA固体培养基中平板划线培养菌株,观察菌落特征;制作菌丝玻片,于光学显微镜下观察菌丝特征;②菌株分子鉴定:a.ITS-5.8S rDNA序列扩增与测序: DNA提取参照《分子生物学实验指南》[8]中基因组制备的方法,以引物ITS-1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS-4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增。PCR反应条件:预变性98℃,5 min;变性95℃,35 s;复性55℃, 35 s;延伸72℃,40 s;35个循环,最终72℃,充分延伸8 min。经切胶纯化的PCR产物连接到pUCm-T载体上,转化大肠埃希菌感受态细胞,检测到载体已连接到目的片段之后交由上海生物工程有限公司完成测序。b.系统发育树的构建:将菌株MZ-1的ITS-5.8S rDNA测序结果提交Gen-Bank核酸序列数据库进行BLAST,使用Bioedit将与之同源性较高的序列进行Clustal w比对,通过MEGA软件采用邻位相邻法作出系统发育树。
1.2.4 粗酶液的制备 对各种样品分别取样3 g,加30 mL蒸馏水,25℃,160 r/min,振荡浸提4 h,用8层纱布过滤后,3500 r/min离心10 min,上清液即为粗酶液,置4℃冰箱待用。
1.2.5 漆酶活力的测定方法 按参考文献[9]略作改动。3 mL反应总体积中,含0.1 mL酶液
2.7mL 0.1 mol/L醋酸-醋酸钠缓冲液(pH 4.5),加入0.2 mL 0.5 mmol/L ABTS以启动反应,于30℃下反应,测定反应液在最初3 min内420 nm处吸光值的增加。1个酶活力单位(U)是指在上述条件下,反应体系中每分钟催化1μmol ABTS氧化所需的酶量。测定值与稀释倍数的乘积即为待测样品的酶活力。所有测量均重复3次,取平均值。
1.2.6 产酶培养基条件优化 在固态发酵培养基的基础上,保持发酵底料的配比不变,对影响漆酶产生的碳源、氮源、无机盐以及料水比4因素进行L9(34)正交试验,其因素水平见表1。
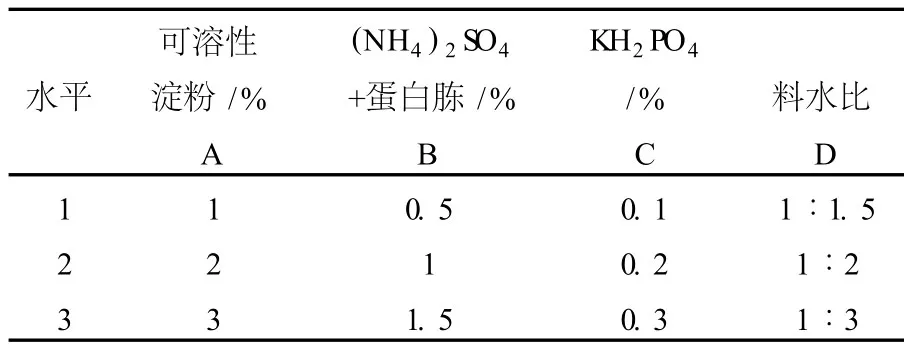
表1 产酶条件试验因素水平Table 1 Factor and level table of orthogonal-test of enzyme production
2 结果与分析
2.1 漆酶高产菌株筛选
2.1.1 初筛 选择生活力高的菌种也是筛选高效菌种的必要条件之一,生活力的高低用菌种在PDA固体培养基上的生长速度来衡量。菌丝生长速度的测定采用菌落直径测定法[10]。表2为各菌株在愈创木酚-PDA平板中生长、产圈情况, 14株菌中,菌株X25的d1与d2的比值较小,但是其菌丝生长速度比较慢,生活力较低,LZ菌株生长速度最快,但是其比值大于1,综合考虑,本试验选择P89、MZ-1、DF-1、NC-1、YH2作为下一步进行复筛的试验菌株。

表2 菌株菌落直径(d1)、变色圈直径(d2)及其比值(d1/d2)Table 2 Colony diameter(d1)、photochromic laps(d2)and their ratio(dl/d2)
2.1.2 复筛 对初筛得到的5株菌采用复筛培养基进行固态发酵产酶复筛,结果见表3。由表3可知,菌株NC-1产漆酶活力最高,依次为YH2、MZ-1、P89、DF-1,前三者的酶活差异并不大,又因菌株NC-1,YH2在固态基础培养基中生长速度以及菌丝旺盛程度较MZ-1慢很多,因此选择MZ-1菌株作下一步研究。

表3 各菌株固态发酵产酶情况Table 3 Enzyme production conditions of Solid-state fer mentation by different strains
2.2 菌株鉴定结果
2.2.1 菌株形态观察 菌株平板划线,菌丝生长良好,30℃培养3 d观察到菌落,菌落形态如图1,MZ-1菌落扁平致密,菌丝白色绒状。1000倍光学显微镜下观察,MZ-1菌丝形态见图2,其菌丝有横隔,较多分枝,有明显的锁状联合结构。

图1 M Z-1菌落形态Fig.1 Colonymorphology ofMZ-1

图2 显微镜下M Z-1菌丝形态(1000×)Fig.2 Hyphalmorphology of MZ-1 undermicroscope(1000×)
2.2.2 菌株MZ-1的ITS-5.8S rDNA序列分析菌株MZ-1的ITS-5.8S rDNA序列测定片段长度为622bp,序列提交GenBank,登录号为HQ172001。将菌株MZ-1的ITS-5.8S r DNA序列在GenBank中进行BLAST,结果显示该菌株ITS-5.8S r DNA序列与栓菌属同源性最高,相似性大于99%,利用MEGA4.1的Neighor-joining进行系统发育树的构建,结果见图3。从系统发育树中可以看出菌株MZ-1与AY840587.1聚在同一分支,其置信度为70%,遗传距离显示菌株MZ-1与AY840587.1的遗传距离最近,达到99.7%。遗传距离显示菌株MZ-1与栓菌属的遗传距离相近。结合形态观察,参照《真菌鉴定手册》,初步确定菌株MZ-1属于栓菌属变色栓菌组中的变色栓菌(Tram etes versicolor)。

图3 以ITS-5.8S rDNA序列同源性为基础的系统发育树Fig.3 Phylogenetic tree based on the homology of ITS-5.8S rDNA sequences
2.3 产漆酶培养基组成优化
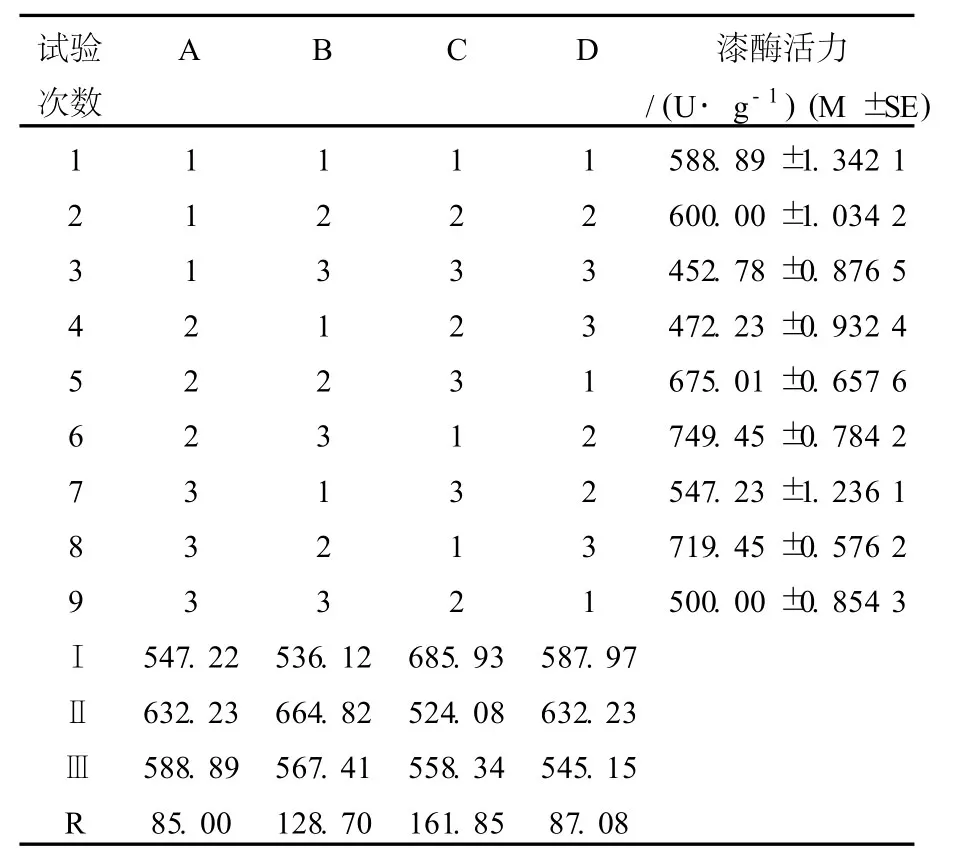
表4 产酶条件正交试验结果Table 4 Factor analysis is table of orthogonal-test of enzyme production
极差分析(表4)可见:各因素对产酶影响的次序依次为C>B>D>A,最佳组合是A2B2C1D2,优化的最佳培养基配方:可溶性淀粉2%,(NH4)2SO4+蛋白胨1%,KH2PO40.1%,料水比1∶2。该菌株在麸皮∶秸秆粉∶豆粕∶玉米粉为3∶3∶2∶1,可溶性淀粉3%,(NH4)2SO4+蛋白胨1%,KH2PO40.1%,料水比1∶2,接种4个菌塞/250 mL三角瓶,8 d,30℃条件下,漆酶的活性为1555.57 U/g。
3 讨 论
利用分子生物学方法对未知菌种进行鉴定早已得到了广大学者的充分肯定和日益广泛的应用,分子生物学方法与传统生理生化法相比更加节省人力物力,而且鉴定结果更加准确可靠[11]。本文筛选得到1株产漆酶活力较高的菌株MZ-1,经ITS-5.8S rDNA序列分析,结合形态学特征,初步鉴定为Tram etes versicolor。
固态发酵周期虽较长,但较液态发酵操作简便、能耗低、产物浓度高、回收费用较低。本文利用麸皮、秸秆、豆粕等废料进行固态发酵,原料成本低,有利于环境保护。采用正交分析,对MZ-1产酶培养基进行了初步研究,得到最优发酵培养基为麸皮∶秸秆粉∶豆粕∶玉米粉为3∶3∶2∶1,可溶性淀粉2%,(NH4)2SO4+蛋白胨1%, KH2PO40.1%,料水比1∶2。在温度为30℃,发酵时间8 d后酶活达到1555.57 U/g,是优化前的3倍左右。施晓燕等[12]分离的白腐真菌其产酶活力为13.233 U/g。相比而言MZ-1在产酶方面有较高的优越性,在以后的试验中将进一步开展对MZ-1菌株的发酵培养条件优化,技术改良使其更加高产,并对该菌株生长、产酶曲线以及所产漆酶的性质进行研究。
[1]范文霞,刘学铭.漆酶的生产和应用研究进展[J].农产品加工学刊,2007,(5):15-18.
[2]钞亚鹏,钱世钧.真菌漆酶及其应用[J].生物工程进展, 2001,21(5):23-28.
[3]冯晓静,谢益民.漆酶的特性及其在制浆造纸工业中的应用[J].湖北造纸,2007,(4):29-32.
[4]郝龙云,蔡玉青.漆酶在靛蓝牛仔布水洗中的应用[J].印染,2007,33(17):19-20.
[5]李秀婷,杨绍青,江正强.利用农业废弃物生产嗜热真菌(T.1anuginosus)耐热木聚糖酶的固体发酵研究[J].工业微生物,2004,34(4):13-l8.
[6]靖德兵,李培军,台培东.彩绒革盖菌固体发酵生产木质素酶工艺优化研究[J].微生物学通报,2004,3l(5):19-23.
[7]Couto Susana Rodriguez,M Angeles Sanroman.Coconut flesh:a novel raw material for laccase production by Trametes hirsuta under solid-state conditions.Application to Lissa mine Green B decolourization[J].Journal of Food Engineering,2005,7l(2): 208-2l3.
[8]Sambrook J,Russell DW.Molecule Cloning:A Laboratory Manua1 3 rded.Beijing,China(北京):Science Press,2002.
[9]Robert Bourbonnais,Michael G Paice.Demethylation and delignification of kraftpulp by Trametes versicolor in the presence of 2-2′-azinobis-(3-ethylbenzthi-azoline-6-sulphonate)[J].Applied Microbiology and biotechnology,1992,36(6):823-827.
[10]邢来君.普通真菌学[M].北京:高等教育出版社,1999.
[11]包怡红,梁雪,李锐达,等.产胞外多糖酵母菌株的筛选鉴定及发酵产糖[J].微生物学报,2010,50(2):278-283.
[12]施晓燕,蔡宇杰.产漆酶真菌筛选及其固态发酵条件的初步研究[J].食品与药品,2009,11(1):11-14.
Screening of Laccase-Producing Fungal Stra in and the Preliminary Study on the Solid-State Fermentation Conditions
JIANG Dong-dong1,LI Li2,ZHAO Xin-hai2,ZHANG Qing-hua2, GUAN Yan-li2,ZHONG Li-juan2,ZHU Wei-wei2,GUO Ling-ling2
(1.Shenyang Agric.Uni.,Shenyang110161;2.Liaoning Sci.Res.Acad.of Microbiol.,Chaoyang 122000)
Fourteen white-rot fungal strains were first screened by guaiacol plate method,and then rescreened by testing the laccase activity,finally obtained one white-rot fungus MZ-1 with strong vitality and high laccase activity;and it was identified initially as Trametes versicolor by ITS-5.8S rDNA sequences analysis.Based on the solid-state medium,cultural medium components for laccase production were optimized by means of orthogonal experiments,they were:wheat bran∶straw powder∶bean cake powder∶cornmeal at 3∶3∶2∶1,added 2%soluble starch,1% (NH4)2SO4plus peptone,and 0.1%KH2PO4,and the proportion of water and medium was 1∶2.Inoculated with four fungal plugs,and fermented for 8d at 30℃,the laccase activity could reach as high as 1555.57 U/g.
laccase;solid-state fermentation;fermentation conditions;orthogonal optimization
Q93
A
1005-7021(2010)06-0055-05
辽宁省科技攻关项目(2009301005)
蒋冬冬 男,硕士研究生。研究方向为微生物资源。E-mail:jdong2010@126.com
*通讯作者。Tel:0421-2913910,E-mail:liligom@163.com
2010-10-12;
2010-11-14

