邻苯二甲酸酯复合污染对土壤微生态的影响
郭 杨,韩 蕊,杜文婷,吴嘉怡,刘 旺,蔡信德*
1.中国环境科学研究院,北京 100012
2.环境保护部华南环境科学研究所,广东 广州 510655
邻苯二甲酸酯复合污染对土壤微生态的影响
郭 杨1,2,韩 蕊2,杜文婷2,吴嘉怡2,刘 旺2,蔡信德2*
1.中国环境科学研究院,北京 100012
2.环境保护部华南环境科学研究所,广东 广州 510655
在实验室模拟条件下,通过测定土壤呼吸,w(PAEs)和微生物RAPD条带数,研究了邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)和邻苯二甲酸二辛酯(DOP)3种PAEs复合污染对农田土壤基础呼吸、微生物多样性的影响.结果表明,PAEs污染初期的土壤基础呼吸被激活,但这种激活作用随着培养时间的延长而减弱,400 mg/kg组土壤基础呼吸最高;3种PAEs含量均有一定程度的下降,其中w(DEP)显著降低;试验终止时各组多样性条带的比例较预培养后有所增加(平均增加13%);不同处理组土壤微生物群落DNA序列Shannon-Weaver指数顺序为0 mg/kg>50 mg/kg>100 mg/kg>200 mg/kg>400 mg/kg.可见,PAEs复合污染提高了土壤基础呼吸,但降低了土壤微生物多样性.
邻苯二甲酸酯;土壤;微生物多样性;RAPD;土壤呼吸
Abstract:The impacts of combined phthalate acid ester(PAE)contamination,including dimethyl phthalate(DMP),diethyl phthalate (DEP),and di-n-octyl phthalate(DOP),on farm land soil basal respiration and microbial diversity were studied by monitoring soil respiration,soil PAEs concentration and random amp lified polymorphic DNA(RAPD)marker under laboratory simulation testing.The results showed that the soil basal respiration was activated by PAEs at an early stage,reaching a maximum value at 400 mg/kg PAEs treatment.However,this type of activation effect decreased with prolonged PAE exposure time.In addition,the concentration of PAEs in the soils decreased,especially the DEP concentration.The number of specific RAPD bands increased in all PAE treatments at the end of incubation,reaching 13% higher than that of the early stage of incubation.The Shannon-Weaver index of soil microbial community DNA sequence in all treatments was:0 mg/kg>50 mg/kg>100 mg/kg>200 mg/kg>400 mg/kg.Overall,the results indicated that the combined PAE contamination in soilmay stimulate soil basal respiration,but decrease soilmicrobial diversity.
Keywords:phthalate ester;soil;microbial diversity;RAPD;soil respiration
邻苯二甲酸酯(Phthalic Acid Easters,PAEs)是环境中一种常见的有机污染物[1-5],具有内分泌干扰毒性和生物累积性[6-9],已被我国列为环境优先控制污染物[10].PAEs污染不但影响农田土壤质量[11-12],而且将影响土壤微生物的数量和多样性,进而影响生态系统功能[13-14].
针对土壤邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二辛酯(DOP)和邻苯二甲酸二(乙基-己基)酯(DEHP)单一污染对微生物影响的报道[1,15-18]较多;谢慧君等[14]报道了 PAEs复合污染对土壤微生物代谢和遗传多样性的影响,但PAEs复合污染对土壤基础呼吸以及对土壤微生物多样性方面的报道还较少.笔者结合土壤呼吸,w(PAEs)和土壤微生物RAPD条带数变化,对国控3种PAEs(包括DMP,DEP和DOP)污染对农田土壤微生物活性和多样性的影响进行了研究,以期为PAEs污染土壤的健康风险评估提供科学依据.
1 材料与方法
1.1 材料
试验用土壤取自华南农业大学农场水稻田耕作层,经风干、碾碎后过 5 mm筛.土壤指标:w(有机质)为2.32%,w(TN)为0.10%,w(TP)为0.073%,w(TK)为2.00%,pH为5.56,质地为中壤土.
DMP,DEP和DOP(分析纯)均购自天津市大茂化学试剂厂,取3种 PAEs溶于丙酮,制成5 g/L储备液,冰箱4℃保存.3种PAEs标样购自环境保护部标准样品研究所,规格2 m L 1 000μg/m L.SBSA引物购自北京赛百盛基因技术有限公司,RAPDPCR所需其他试剂均购自上海生工生物工程有限公司.PAEs提取和分析过程中所接触的所有玻璃器皿都必须先用洗液洗涤,置300℃烘箱过夜,冷却后用色谱纯丙酮和正己烷淋洗,使用前风干.
1.2 土壤染毒方法
取少量过0.30 mm筛的土壤加入5 g/L PAEs储备液,使3种PAEs质量分数均达到1 000 mg/kg.待丙酮挥发,取适量上述土壤与未污染土壤混合制成5个浓度的污染土壤,3种PAEs质量分数均为0,50,100,200和400 mg/kg(分别为1~5组),每个样品1 000 g,每个浓度作3个平行,装入清洁陶瓷盆中.每盆加入适量蒸馏水,使含水量保持在30%,培养箱25℃暗培7 d进行预培养,微生物群落充分恢复后开始试验.试验共持续 30 d,培养箱25℃暗培.
1.3 土壤呼吸测定
自1.2节中的土壤每盆各取150 g,装入2250实验室土壤呼吸系统(英国ADC公司)测定土壤呼吸2 h.将土壤放回各自盆中混匀,每5 d测定一次土壤呼吸和土壤含水率,共计30 d.第一次和最后一次测定土壤呼吸时,每盆用纸袋各保留30 g鲜土,-20℃冰箱保存,用于RAPD-PCR分析;用洁净玻璃培养皿各保留 20 g鲜土,风干后用于w(PAEs)测定.
1.4 w(PAEs)测定
将1.3节中风干土样过0.30 mm筛,准确称取2 g装入50 m L带塞锥形瓶,加入10 mL正己烷/丙酮(体积比为1/1)振摇数下,超声萃取20 min,静置沉淀后倾出上层溶剂,重复3次,合并溶剂相,旋蒸至1 m L.溶剂相净化过程参照文献[19],洗脱液旋蒸至体积小于0.2 m L,加入3 mL正己烷溶剂置换,旋蒸至1 m L,GC分析.
使用岛津 GC-17A气相色谱仪(日本岛津公司).毛细管色谱柱,DB-5(30 m×0.32 mm);载气,高纯氮(N2≥99.999%);进样口温度280℃,检测器(ECD)温度300℃,不分流进样,进样量1μL,升温程序参考文献[20](起始温度为70℃,保持1 m in,20℃/m in升至130℃,5℃/m in升至230℃,15℃/m in升温至300℃,保持5 min).
1.5 土壤微生物多样性分析
土壤微生物多样性分析采用RAPD方法,土壤总DNA提取参照文献[21],使用柱式腐殖酸清除剂(上海生工生物工程有限公司)纯化粗DNA作为PCR模板.从一套RAPD引物(SBSA)20条(见表1)中筛选出 A01,A05,A07,A14和 A18五条用于PCR扩增.

表1 SBSA引物序列Table 1 Sequence of RAPD primer(SBSA)
PCR反应体系:10×缓冲液5μL,MgCl2(25 mmol/L)5μL,dNTP(10 mmol/L)1μL,模板DNA 0.5μL(10~100 ng),引物(5.1μmol/L)3μL,Taq酶(5 U/μL)0.5μL,补双蒸水(ddH2O)至50μL. PCR反应条件参照文献[21](94℃预变性4 min,40个循环为:94℃变性90 s,36℃退火90 s,72℃延伸2 m in,最后72℃延伸5 min).
1.6 数据统计分析方法
微生物多样性采用Shannon-Weaver指数表示:
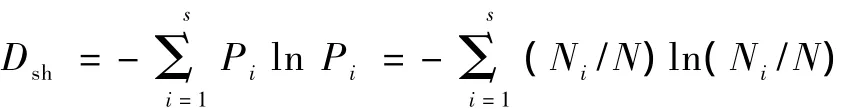
式中,Dsh为 Shannon-Weaver指数;Ni为第 i个RAPD条带的扩增量;N为土壤微生物 DNA的RAPD条带的扩增总量.Dsh可以反映种群内及种群间的遗传多样性分布和差异.
2 结果与讨论
2.1 土壤w(PAEs)变化
3种w(PAEs)在30 d的培养中均有所降低(见图1).试验终止时 50,100,200和 400 mg/kg组w(DMP)较预培养后分别下降了70.38%,34.83%,65.72%和62.64%;w(DEP)分别下降了73.45%,62.81%,97.95%和29.78%;w(DOP)分别下降了56.20%,55.17%,72.01% 和 43.98%. 其 中w(DEP)下降最为明显.CARTWRIGHT等[15]认为,DEP生物降解很快,当游离态和土壤颗粒表面吸附的DEP被分解后,DEP的微生物可利用性降低.该试验中w(DEP)的变化也证实了这点.
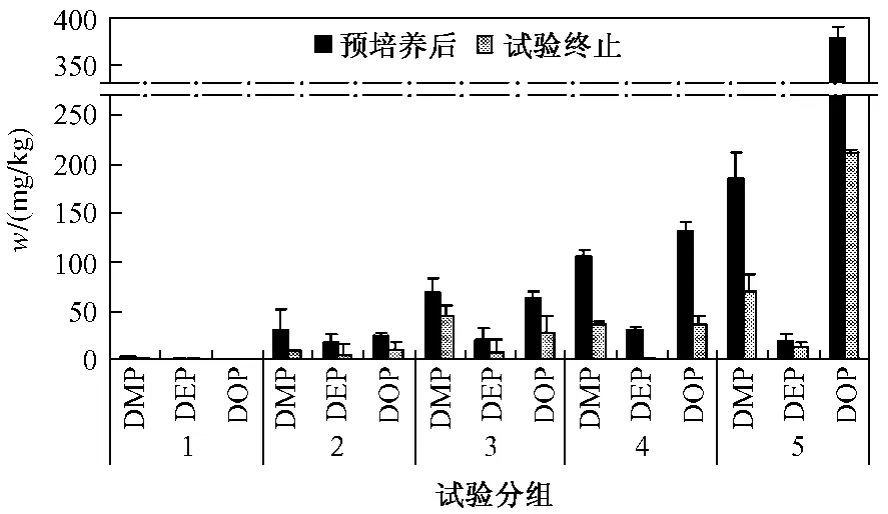
图1 土壤中w(PAEs)变化Fig.1 Transformation of the PAEs content in treated soils
2.2 PAEs污染对土壤呼吸的影响
PAEs污染对土壤基础呼吸的影响见图2.各组土壤基础呼吸值在前5 d下降较快,之后下降速度变缓.对照组(0 mg/kg)呼吸值始终低于其他组; 400 mg/kg组的土壤呼吸值最高,其前5 d的降幅也最大;100 mg/kg组的土壤呼吸值高于 50和 200 mg/kg组.土壤基础呼吸值由高至低顺序为 400 mg/kg>100 mg/kg>50 mg/kg>200 mg/kg.试验结果基本与文献[16]报道的添加PAEs初期土壤基础呼吸被激活且激活作用随培养时间的延长而减弱的现象相同.原因可能是 PAEs可作为土壤微生物代谢底物,微生物利用这些底物时表现出较高的代谢活性,土壤基础呼吸值升高;但随着培养时间的延长其生物有效性降低,土壤呼吸下降.而对照组土壤呼吸值始终低于 PAEs污染组的原因,可能是微生物可利用碳源总量有限,土壤呼吸保持较低水平且随着碳源的减少土壤呼吸下降.
但试验并未出现文献[16]中的抑制效应,原因可能是与PAEs的性质(属于非急性毒性污染物)和PAEs在土壤中的存在状态相关.DMP,DEP和DOP (其分子量分别为194.19,222.24和390.30,lg KOW分别为1.61,2.38和8.06[22])复合体系中,DMP和DEP易于被微生物所利用,故未出现土壤呼吸低于对照组的抑制现象;而DBP和DEHP(其分子量分别为278.34和390.30,lg KOW分别为3.74和7.50)生物有效性低于 DMP和 DEP.尹睿等[17]认为,当土壤中DEHP(与DOP结构相似)含量较低时,有较大比例的DEHP与土壤有机物形成复合物,生物可利用的部分减少.因此,当可利用的碳源较少时,微生物降低生理活动抵御污染物的毒害,土壤基础呼吸被抑制.

图2 PAEs污染土壤基础呼吸的变化Fig.2 The results of soil basal respiration
2.3 PAEs对土壤微生物多样性的影响
5条RAPD引物共扩增出条带395条.预培养后共扩增出条带172条,均为多态性条带;试验终止时共扩增出条带223条,其中非多态性条带8条(占3.6%),多态性条带215条(占96.4%).非多态性条带是指同一时期的5种处理的土壤微生物 DNA均扩增出的条带,多态性条带是指同一时期的5种处理的土壤微生物DNA并非全扩增出的条带.
2.3.1 PAEs对土壤DNA序列多样性的影响
预培养后各引物扩增条带数量见表2.从表2可以看出,SBSA05和 SBSA18扩增条带量最多,并且5个组条带量顺序为0 mg/kg>50 mg/kg>200 mg/kg>400 mg/kg>100 mg/kg.RAPD引物对各组微生物DNA无特异性选择,且各组使用相同的土壤制备,故条带数量可间接反映各组微生物DNA组成差异,扩增条带数越多 DNA序列种类相对就越丰富.
试验终止时各引物扩增条带数量见表3.从表3可以看出,SBSA05扩增条带量最多,5个组条带量顺序为 0 mg/kg>50 mg/kg>100 mg/kg>200 mg/kg>400 mg/kg组.由表4可知,试验结束时5个处理的多态性条带(同一样品试验前后扩增出的有差异的条带)所占比例均有所增加(其平均值由20%变化到33%),说明土壤经不同w(PAEs)处理后,微生物组成发生变化.该试验结果与谢慧君等[14]的报道基本相同,PAEs胁迫使某些耐受微生物数量增多、非耐受微生物减少,土壤微生物多样性发生变化.

表2 RAPD引物对预培养后土壤微生物DNA的扩增结果Table 2 The results of amplification ofmicrobial DNA in early stage with RAPD method

表3 RAPD引物对试验终止时土壤微生物DNA的扩增结果Table 3 The results of amplification ofm icrobial DNA in 30th day with RAPD method
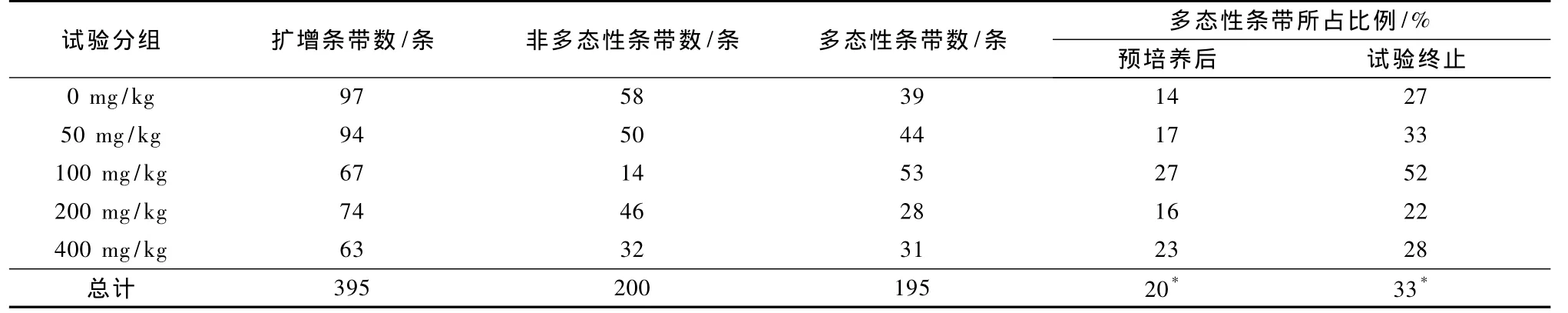
表4 RAPD引物对不同处理土壤中微生物DNA总的扩增结果Table 4 The total results of amplification ofmicrobial DNA in different soils with RAPD method
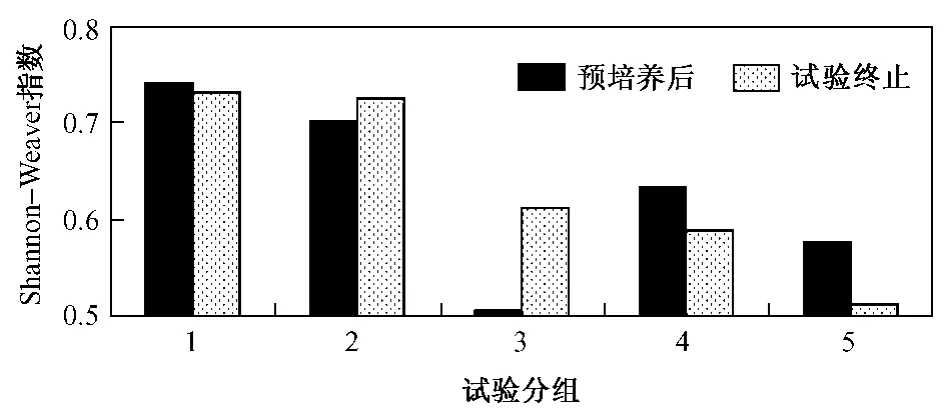
图3 土壤微生物多样性指数Fig.3 The results of Shannon-Weaver index of microbial diversity in treated soils
2.3.2 土壤微生物群落 DNA序列 Shannon-Weaver指数
DNA扩增条带数简明表达了土壤微生物DNA序列多样性的一个侧面,但它未能反映群落DNA序列相对多度的信息[23].Shannon-Weaver指数能较好地反映群落物种数量和丰富度.5种处理微生物群落DNA序列Shannon-Weaver指数存在差异(见图3).预培养后Shannon-Weaver指数大小顺序为0 mg/kg>50 mg/kg>200 mg/kg>400 mg/kg>100 mg/kg;试验终止Shannon-Weaver指数大小顺序为0 mg/kg>50 mg/kg>100 mg/kg>200 mg/kg>400 mg/kg.对照组培养前后的Dsh值无明显差异(分别为0.74和0.73);50和100 mg/kg组的Dsh值均上升(分别从0.70和0.51升至0.73和0.61),说明土壤微生物DNA序列多样性增加;200和400 mg/kg组的Dsh值降低(分别从0.63和0.58降至0.59和0.51).4个染毒组的 Dsh值始终低于对照组,说明PAEs可降低土壤微生物多样性,影响土壤健康.至试验结束,50 mg/kg组的Dsh值达到对照水平,说明土壤低浓度 PAEs污染后,经过一定时间微生物群落可逐渐恢复;100 mg/kg组的Dsh值上升,说明该污染程度下微生物多样性有恢复趋势,但能否恢复到对照水平还需进一步长期试验.相反,至试验结束200和400 mg/kg组的微生物多样性降低,且随着w(PAEs)的增加而降低,说明该污染程度的土壤微生物多样性(至少在短期内)无法恢复,只有PAEs耐受菌种可生存,土壤微生物多样性减少,土壤健康受损.
3 结论
a.PAEs复合污染将提高土壤基础呼吸,但土壤基础呼吸作用随着污染程度和污染时间而变化.对照组土壤基础呼吸始终最低.
b.土壤土著微生物能利用部分的 PAEs,但利用程度因PAEs种类和含量的不同而不同.
c.PAEs污染将导致土壤微生物多样性降低,对土壤健康造成影响.
[1]苗静,祝惠,王鑫宏,等.DOP与Pb单一及复合污染对土壤酶活性的影响[J].环境科学研究,2009,22(7):856-861.
[2]骆祝华,黄翔玲,叶德赞.环境内分泌干扰物:邻苯二甲酸酯的生物降解研究进展[J].应用与环境生物学报,2008,14 (6):890-897.
[3]GRAHAM P R.Phthalate ester plasticizers:why and how they are used[J].Environmental Health Perspectives,1973,3:3-12.
[4]KAPANEN A,STEPHEN J R,BRÜGGEMANN J,et al.Diethyl phthalate in compost:ecotoxicological effects and response of the microbial community[J].Chemosphere,2007,67:2201-2209.
[5]NIAZI J H,PRASAD D T,KAREGOUDAR T B.Initial degradation of dimethylphthalate by esterases from Bacillus species[J].FEMSMicrobiology Letters,2001,196:201-205.
[6]FOSTER PM D,CATTLEY R C,MYLCHREEST E.Effects of din-butyl phthalate(DBP)on male reproductive development in the rat:implications for human risk assessment[J].Food and Chemical Toxicology,2000,38:97-99.
[7]LIANG W,DENG JQ,ZHAN F C,et al.Effects of constructed wetland system on the removal of dibutyl phthalate(DBP)[J]. Microbiological Research,2009,164:206-211.
[8]XU X R,LI H B,GU J D.Biodegradation of an endocrinedisrupting chem ical di-n-butyl phthalate ester by Pseudomonas fluorescens B-1 [J]. International Biodeterioration &Biodegradation,2005,55:9-15.
[9]ZHOU Q H,WU Z B,CHENG S P,et al.Enzymatic activities in constructed wetlands and di-n-butyl phthalate(DBP)biodegradation[J].Soil Biology&Biochemistry,2005,37:1454-1459.
[10]环境保护部.国家污染物环境健康风险名录:化学(第一分册)[M].北京:中国环境科学出版社,2009:275-301.
[11]秦华,林先贵,尹睿,等.丛枝菌根真菌和两株细菌对土壤中DEHP降解及绿豆生长的影响[J].环境科学学报,2006,26 (10):1651-1657.
[12]吴杰民.聚烯烃类农膜及酞酸酯类(PAEs)在环境中的残留及生物降解前景[J].环境科学,1994,15(2):77-80.
[13]秦华,林先贵,陈瑞蕊,等.DEHP对土壤脱氢酶活性及微生物功能多样性的影响[J].土壤学报,2005,42(5):829-834.
[14]谢慧君,石义静,滕少香,等.邻苯二甲酸酯对土壤微生物群落多样性的影响[J].环境科学,2009,30(5):1286-1291.
[15]CARTWRIGHT C D,THOMPSON IP,BURNS R G.Degradation and impact of phthalate plasticizers on soilmicrobial communities[J].Environmental Toxicology and Chem istry,2000,19(5): 1253-1261.
[16]高军,陈伯清.酞酸酯污染土壤微生物效应与过氧化氢酶活性的变化特征[J].水土保持学报,2008,22(6):166-169.
[17]尹睿,张华勇,王曙光,等.邻苯二甲酸二异辛酯在番茄根际土壤中的持留动态[J].环境科学学报,2004,24(3):444-449.
[18]陈强,孙红文,王兵,等.邻苯二甲酸二异辛酯(DEHP)对土壤中微生物和动物的影响[J].农业环境科学学报,2004,23 (6):1156-1159.
[19]赵胜利,杨国义,张天彬,等.珠三角城市群典型城市土壤邻苯二甲酸酯污染特征[J].生态环境学报,2009,18(1):128-133.
[20]曾锋,傅家谟,盛国英,等.邻苯二甲酸二甲酯的微生物降解研究[J].环境科学研究,1999,12(4):12-14.
[21]蔡信德.土壤镍污染植物修复的生态效应和微生物强化作用研究[D].广州:中山大学,2005:40-45.
[22]隆兴兴,牛军峰,史姝琼.邻苯二甲酸酯类化合物正辛醇-水分配系数的QSPR研究[J].环境科学,2006,27(11):2318-2322.
[23]姚健,杨永华,沈晓蓉,等.农用化学品污染对土壤微生物群落DNA序列多样性影响研究[J].生态学报,2000,20(6): 1021-1027.
Effects of Com bined Phtha late Acid Ester Contam ination on SoilM icro-Ecology
GUO Yang1,2,HAN Rui2,DU Wen-ting2,WU Jia-yi2,LIU Wang2,CAIXin-de2
1.Chinese Research Academy of Environmental Sciences,Beijing 100012,China
2.South China Institute of Environmental Sciences,Ministry of Environmental Protection,Guangzhou 510655,China
X53
A
1001-6929(2010)11-1410-05
2010-06-28
2010-08-16
国家水体污染控制与治理科技重大专项(2009ZX07211-002);环境保护部公益项目(200809093)
郭杨(1982-),男,北京人,guoyang526@126.com.
*责任作者,蔡信德(1965-),男,广东梅州人,研究员,博士,主要从事土壤污染修复研究,xindecai@scies.org

