实时荧光PCR和常规PCR方法检测饲料中鸡源性成分
刘彦泓 穆 春 孙 屏 杨 滴 刘岑杰 夏元凤 徐建平
疯牛病、禽流感等大规模传染性疾病的肆虐和蔓延,给全世界带来了巨大的灾难。流行病学证明疯牛病、羊痒病和人的克雅氏病、库鲁病都是由该变性蛋白质通过食物链传播而引起的,因此,动物源性饲料的大规模应用,存在很多不安全的因素。为了彻底切断疯牛病的传播途径,2000年欧盟禁止生产和使用动物源性饲料,随后世界上很多国家都将饲料中含有动物源性成分列为主要检疫范围,包括牛、羊源性,禽源性成分等动物源性成分,严禁含有禽源性等成分的饲料进口[1]。作为农业大国,我国必须加强对动物源性饲料的监管,严格检验检疫销售和使用的饲料。因此,急需建立能够快速、准确鉴别检测饲料中鸡源性成分的方法。本研究采用常规PCR方法和实时荧光PCR方法检测饲料中鸡源性成分,方法的灵敏度高,实用性强,适用于鸡源性成分的检测。
1 材料与方法
1.1 材料
生鸡肉购自大连市场。
1.2 试剂
DNA提取试剂盒:Promega公司的Magnetic DNA Purification System For Food试剂盒。实时荧光PCR反应试剂盒(Premix Ex TaqTM)、10×PCR缓冲液/dNTP溶液、ExTaqDNA聚合酶、100 bp Maker(片段大小分别为100、200、300、400、500、600、700、800、900、1 000、1 500 bp)均购自TaKaRa大连宝生物公司。
1.3 仪器
低温高速离心机(Eppendorf)、恒温水浴箱、实时荧光 PCR 仪(ABI7000)、PCR 仪(ABI2700)、生物安全柜(苏净安泰)。
1.4 引物及探针序列
引物合成及探针合成、标记购自TaKaRa大连宝生物公司,实时荧光PCR引物序列及探针的序列见表1;常规PCR引物序列及扩增长度见表2。
1.5 模板DNA的提取

表1 实时荧光PCR引物序列及扩增长度
采用Promega公司的Magnetic DNA Purification System For Food试剂盒,按照产品说明书进行。
1.6 实时荧光PCR检测
实时荧光 PCR扩增反应具体条件:95℃ 30 s、95 ℃ 5 s、60 ℃ 31 s,40 个循环。

表3 实时荧光PCR扩增反应体系
1.7 常规PCR检测
PCR 反应体系:10×PCR 缓冲液 2 μl;dNTP(各 2.5 mmol/l)2 μl;上下游引物(10 000 nM)各 1 μl;ExTaqDNA 聚合酶(5 U/μl)0.2 μl;DNA 模板(200~500 ng)2 μl;ddH2O加至25 μl。PCR反应条件:94℃变性3 min;94℃ 60 s;55 ℃ 30 s;72 ℃ 30 s;30 个循环;72 ℃延伸 5 min。PCR扩增产物的凝胶电泳检测:制备2%的琼脂糖凝胶,取 PCR 扩增产物 5 μl与 1 μl(6×)加样缓冲液混匀,用1×TAE电泳液进行凝胶电泳分析,用100 bp Ladder DNA Marker作分子量标记,摄影并记录。
1.8 特异性检测
采用提取的牛、羊、猪、马、狗、鱼、大豆、玉米的DNA作为对照,与提取的鸡肉的基因组DNA同时进行实时荧光PCR和常规PCR扩增。
1.9 灵敏度检测
将鸡肉粉混入猪肉粉,使其含量达到1%,对于含量在1%以下的样品,将提取的1%含量的鸡DNA溶液进行连续10倍稀释,使其含量达到相当于实际样品鸡肉粉含量的 0.1%、0.01%、0.001%、0.000 1%,然后进行实时荧光PCR和常规PCR扩增。
1.1 0 饲料样品的检测
选取宠物食品、鸡血饲料、鸡骨粉、鸡羽毛粉,提取其DNA,与提取的鸡肉的基因组DNA同时进行实时荧光PCR和常规PCR扩增。
2 结果及分析
2.1 特异性检测结果
实时荧光PCR对几种动植物的DNA扩增,结果只有鸡被检测出,形成扩增曲线,其他则没有特异性扩增曲线,表明本研究所选取的DNA片段特异性比较强,结果见图1。常规PCR扩增结果也显示同样的特异性。
2.2 灵敏度检测结果
通过对不同含量的鸡基因组DNA模板进行PCR检测,得到实时荧光PCR的检出限为0.001%,结果如图2所示。本研究的检出限比金凌艳等[2]实时PCR检测牛羊源性成分的方法检出限低,这可能与基因组DNA的提取质量有关。


对于常规PCR,当含量达到0.1%时,电泳条带较暗,含量达到0.01%时没有条带,如图3所示(第2、3、4泳道)。说明常规PCR能够检出的最低含量为0.1%,这与潘良文、张舒亚等[3-4]的研究结论相同。

图3 常规PCR灵敏度检测结果
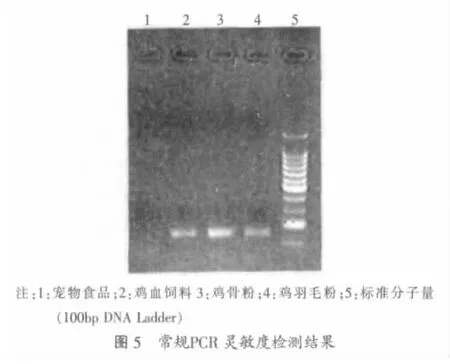
2.3 检测饲料样品的结果
对不同饲料进行实时荧光PCR和常规PCR检测,结果如图4、图5所示。说明几种饲料中含有鸡源性成分,一种宠物食品中不含有鸡源性成分。

3 讨论
本研究选择鸡线粒体DNA作为对象,根据Genbank中提供的基因序列,设计并优化了针对鸡的特异性引物及探针。线粒体DNA是高等动物唯一的核外遗传物质,基因组中无间隔系列,无组织特异性,种内遗传稳定,种间高度变异,个体中不同组织线粒体DNA高度均一[5-6],可以获得较高的拷贝数,易于检测。目前,线粒体DNA序列已经广泛应用于研究物种的遗传分化、群体遗传结构、物种进化、饲料成分监督等[7-8]。
在饲料加工过程中,原料通常需要经过高温干燥、油炸、粉碎等高强度处理,会造成DNA分子的断裂及损失,在一定程度上增加了PCR检测的难度。本研究设计的常规PCR检测目的片段长度为161 bp,既可以满足实验需要,又保证了实验结果的准确性。
实时荧光PCR技术相当于定性PCR与分子杂交的结合,它能区别只有少数碱基差异的DNA序列,具有高特异性和高精确性的优点[9]。而且实时荧光PCR是在封闭的体系中进行,反应结束无需进行电泳,避免污染和危害,缩短了检测时间。通过对市售饲料样品和送检骨粉样品的检验发现,10份饲料有4种检出含有鸡源性成分,6份油炸骨粉中1种标明猪骨粉中检出鸡源性成分,进一步证明本研究所建立的常规PCR和实时荧光PCR检测方法的准确性和可靠性,可以作为鸡源性成分的常规检验方法。
[1]潘良文,陈家华.食品和饲料中动物源性成分的检测方法的进展[J].检验检疫科学,2002(2):45-47.
[2]金凌艳,顾欣,蔡金华,等.应用两种PCR方法检测饲料中牛、羊源性成分[J].中国农业科技导报,2008(10):76-80.
[3]潘良文,陈家华,丁燕,等.进口肉骨粉中牛成分检测研究[J].生物技术通报,2001(5):23-26.
[4]张舒亚,管薇薇,刘月明,等.饲料中鱼源性真实性鉴别研究[J].饲料研究,2009(6):45-46,48.
[5]Anderson S,Bankier B G,Bruijn M H,et al.Sequence and organization of the human mitochondrial genome[J].Nature,1981(290):457-465.
[6]雷初,陈宏,王德,等.关于驴线粒体DNA D-Loop多态性分析[J].中国畜牧杂志,2004(4):10-12.
[7]Wolstenholme D R.Animal mitochondrial DNA:structure and evolution[J].Int.Rev.Cytol.,1992(141):173-216.
[8]Tartaglia M,Saulle E,Pestalozza S,et al Detection of bovine mitochondrial DNA in ruminant feeds:a molecular approach to test for the presence of bovine-derived materials[J].Journal of Food Protection,1998,61(5):513-518.
[9]Heid C A,Stevens J,Livak K J,et al.Real time quantitative PCR[J].Genome Research,1996(6):986-994.

