高温下Ti掺杂对Li4 SiO4吸收CO2性能的影响
汪文哲, 熊 贵, 张军营, 赵永椿, 郑楚光
(1.华中科技大学煤燃烧国家重点实验室,武汉430074;2.华中科技大学电子科学与技术系,教育部敏感陶瓷工程研究中心,武汉430074)
温室气体CO2已造成严重的环境危害,它的排放日益受到人们的关注.目前我国CO2排放总量已居世界前列,而燃煤电厂是CO2排放量最大的化石燃料燃烧场所.采用固体吸收剂对CO2进行捕获后储存是一种有效方法.一般认为,高温CO2固体吸收剂主要有钙基[1-2]和锂基两种.氧化钙在与CO2的反应中会释放出大量热量,这意味着在很高的温度下捕获CO2是可行的,但是也需要很高的再生温度.钙基吸收剂再生所需要的高温会增加烧结的可能性及限制多次循环的耐久性.
Masahiro Kato[3]等人研究发现,一些锂的氧化物能够在700℃以下与周围的CO2立即反应.Li4SiO4有4个显著特点:吸收量大、吸收速度快、温度和CO2浓度范围宽广、循环性能优越.其吸收CO2的反应式为:
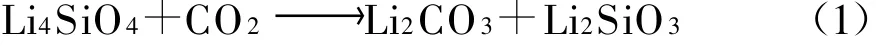
由式(1)计算,得出Li4 SiO4能够吸收CO2的最大理论质量分数值为 36.72%.M iriam[4]、Takeshi[5]等研究了Li4 SiO4粒径对CO2吸收的动力学和反应机理的影响.K.Essaki[6]等探讨了温度和CO2浓度等因素对CO2吸收的影响.为了获得更好的吸收效果,国内外许多学者对Li4 SiO4进行了掺杂研究.王银杰[7]、Victoria[8]等分别进行了Na2 CO3、K2 CO3掺杂的试验研究,发现掺杂后比纯Li4 SiO4具有更好的CO2吸收效果.C.Gauer[9]等进行了A l2O3、Fe2O3掺杂的试验研究,发现Fe掺杂的Li4 SiO4可获得良好的CO2吸收效果.研究表明,通过掺杂合适的金属氧化物中的元素,使其在Li4SiO4晶体中形成空位缺陷,可以提高反应活性.
由于TiO2和SiO2的标准摩尔吉布斯函数变接近(分别为-889.50 k J/m ol和-856.64 k J/mol),而Ti4+比Si4+的离子半径大(分别为0.068 nm和0.042 nm),在制备Li4 SiO4时,掺杂 TiO2有利于在晶体结构中形成点缺陷,增加反应活性.笔者分别采用固相合成法和溶胶凝胶法合成了Li4 SiO4材料,并在固相合成法制备Li4 SiO4时掺杂了TiO2,对选择的样品在固定床台架上进行了多次循环吸收/解吸的试验研究,以期达到更好的CO2吸收效果.
1 试验部分
1.1 Li4 SiO4的制备
固相合成法制备 Li4 SiO4的方法如下:准确称取n(SiO2)∶n(Li2 CO3)=1∶2的反应原料,用无水乙醇作为溶剂混合在球磨罐中,以350 r/min的转速球磨2 h,再将样品烘干,过筛后在800℃下煅烧4 h,冷却后得到Li4 SiO4(s-s)样品;然后将制备得到的样品破碎研磨,经孔径250μm标准筛过筛备用.
溶胶凝胶法制备 Li4 SiO4的方法如下:将Li2CO3溶解在去离子水稀释的醋酸中,在磁力搅拌的同时将正硅酸乙酯(TEOS)按要求加入,将混合液在70℃下烘干,过筛后在800℃下煅烧4 h,冷却后得到Li4SiO4(s-g)样品;然后将制备得到的样品破碎研磨,经孔径250μm标准筛过筛备用.
掺杂Ti的固溶体 Li4Si1-xTixO4制备方法如下:准确称取各物质的 n(SiO2):n(TiO2):n(Li2 CO3)=(1-x/2):x:2,掺杂量 x分别取 0、0.02、0.04、0.06、0.08 和 0.10,采用固相合成法制备.
试验所用的 Li2 CO3、TiO2、SiO2、正硅酸乙酯(TEOS)、醋酸、无水乙醇等试剂均为分析纯.
1.2 试验设备和台架
X射线衍射仪为荷兰帕纳科公司PANalytical B.V.生产的 X′Pert Pro衍射仪,该仪器使用Cu靶,X射线发生器的最大功率为3 kW.比表面分析(BET)采用美国麦克仪器公司生产的ASAP2020型比表面积与孔径测定仪在等温下利用氮吸附进行测试.利用北京光学仪器厂生产的WCT型热分析仪进行TG测试.由立式管式炉搭建成固定床台架,在其上进行高温下Li4 Si1-x Ti x O4样品对CO2循环吸收/解吸的试验.
2 结果与讨论
2.1 样品表征
图1为采用溶胶凝胶法与固相合成法制取的Li4 Si1-x Ti x O4(x为TiO2的掺杂比例)的 XRD图谱,其特征衍射峰与Li4 SiO4(01-076-1085)相吻合.从图中可以看出,溶胶凝胶法和固相合成法制得的Li4 SiO4纯度均较高,衍射峰峰值的差别表明晶体结构有所不同.随着x的增加,样品特征衍射峰强度的大小和相对比值也有所不同.各种固溶体中均未出现TiO2衍射峰,说明TiO2参与了反应,Ti4+替代了部分Si4+,由于 Ti4+的半径远大于Si4+,材料的晶体结构产生了正畸变,在晶格中形成点缺陷,这样有助于提高Li4 SiO4材料吸收CO2的活性.但随着TiO2掺杂量的增加,Li4SiO4的合成量也减少了.
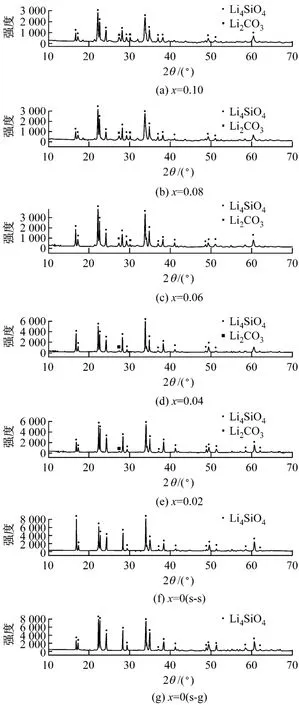
图1 800℃煅烧4 h制备的Li4Si1-x Ti x O4的XRD图Fig.1 XRD patterns of Li4 Si1-x Ti x O4 samp les sin tered at 800℃for 4 h
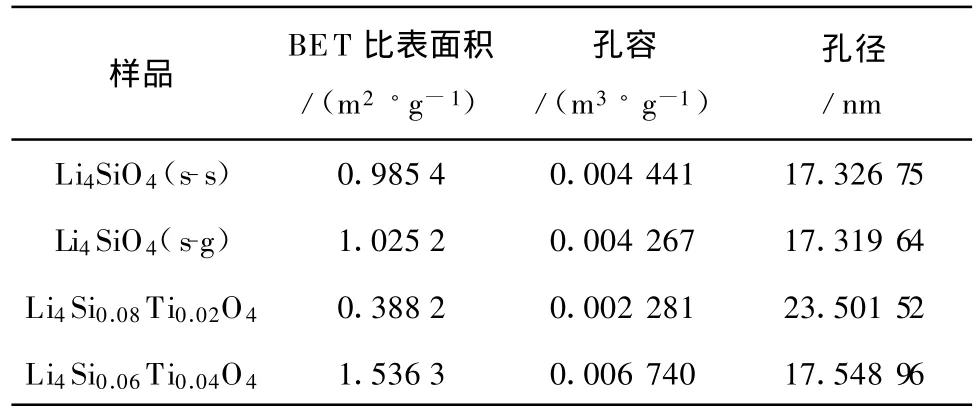
表1 制备吸收剂的表征结果Tab.1 Characterization resu lts of several Li4 SiO4 samp les prepared
表1列出了制备的几种样品的表征结果.由表1可知,由溶胶凝胶法和高温固相法制得的Li4 SiO4比表面积、孔容和孔径均相差不大.对于掺杂了TiO2的固溶体 Li4 Si1-x Ti x O4,当 x=0.02时,固溶体的孔径值大于其他测试样品,比表面积和孔容均较小;当x=0.04时,比表面积和孔容又明显地增大.结合图1分析,当TiO2的掺杂量x=0.02时,掺杂量较少,反应进行完全,生成的固溶体比表面积较小;而当x≥0.04后,Li4 SiO4衍射峰强度变小,且出现了少量其他生成物,使得固溶体的比表面积又增大.
2.2 CO2分压对吸收效果的影响
在热重分析仪上对Li4SiO4(s-s)吸收剂在不同CO2分压下的吸收效果进行测试,结果示于图2.试验中控制气体总流量为60 m L/m in,以20 K/min的升温速率从室温升到1 000℃.
从图2可以看出,随着CO2分压的降低,Li4SiO4(s-s)对CO2的最大吸收量急剧减少.在纯CO2气氛下,气体流量为60 m L/min时,Li4 SiO4(ss)对CO2的最大吸收量可达29.56%.当CO2和N2的流量分别为50 m L/min和10 m L/m in时,其最大吸收量减少到10%以下;当CO2分压为50%时,最大吸收量进一步减少,只有5%左右;当CO2分压为20%左右时,样品质量仅有微量的增加.由此可见,CO2分压对高温下Li4 SiO4吸收CO2具有很大影响,分压越大,吸收量也越大,吸收效果越好.

图2 不同CO2分压下Li4SiO4(s-s)的TG曲线Fig.2 Thermogravim etric analysis cu rves of Li4SiO4 samples at different partialp ressuresof CO2
2.3 CO2吸收试验
各种Li4 Si1-x Ti x O4样品在纯CO2气氛下的热重曲线示于图3.试验中气体流量为60 m L/m in,升温速率为20 K/min.从图中可看出,Li4 Si1-x Ti x O4样品在550℃后开始快速吸收CO2,质量迅速增加,在750℃时达到最大值,然后进入解吸过程,而在800~1 000℃时,样品质量下降到初始值,CO2解吸完全.
比较分别由高温固相法和溶胶凝胶法制取的Li4 SiO4样品的热重曲线发现,CO2的最大吸收量相近,均为29.56%左右,达到最大吸收量的温度也相同,CO2解吸速率和程度也相似,但后者吸收速率更快,能够更快地达到最大吸收量.
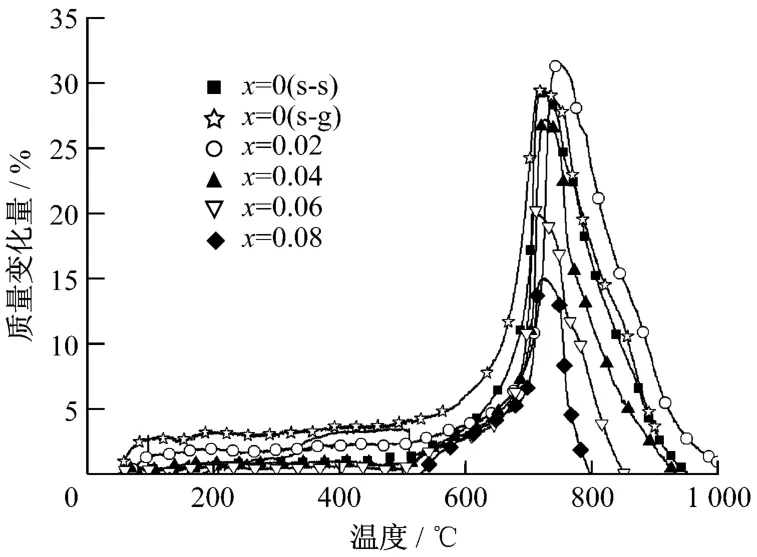
图3 纯CO2气氛下Li4Si1-x Ti x O4的TG曲线Fig.3 Thermogravimetric analysis curves of Li4Si1-x Ti x O4at pure CO2atmosphere
对掺杂了TiO2固溶体Li4 Si1-x Ti x O4的热重试验结果进行对比,发现当掺杂量x=0.02时,固溶体 Li4 Si0.08 Ti0.02 O4有最大的CO2吸收量,可达31.59%.说明掺杂微量TiO2使晶体结构产生了正畸变,形成了一部分点缺陷,在晶格中引入的空位减小了O2-的扩散阻力,提高了Li4 SiO4吸收CO2的活性.但随着x的继续增加,固溶体中Li4SiO4的含量相对减少,也减弱了吸收CO2的效果.从图中还可以看出,在x≥0.04后,各固溶体达到最大吸收量时的温度均比未掺杂的样品下降,质量增加的温度区间减小,吸收量相应减少.试验表明,比表面积的大小与样品的CO2吸收量无直接关系,物理吸附并不是Li4 SiO4吸收CO2效果的决定因素.
2.4 固定床CO2循环吸收/解吸试验
试验所用的固定床台架示意图见图4.试验前通入纯CO2,控制气体流量为0.5 L/m in,分别设定立式管式炉的上下两段炉膛温度恒定为700℃和850℃,即为CO2吸收和解吸的反应温度.试验时称取适量样品放入石英坩埚内进行CO2吸收试验,在700℃保温一段时间后将样品取出,在干燥皿内冷却后放入电子天平称量,然后将样品放入管式炉中内管的底端进行解吸,在850℃保温适当时间后将样品取出,冷却后再次称量,如此反复进行.
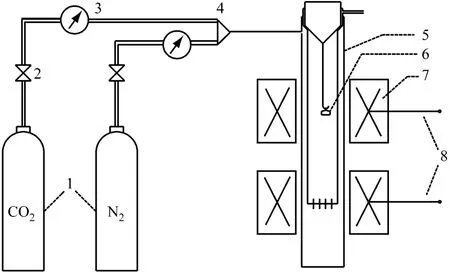
图4 CO2循环吸收/解吸固定床台架示意图Fig.4 Schematic diagram of the fixed bed fo r cyc lic CO2 absorp tion/desorption test
为了测定Li4 SiO4(s-s)在700℃时达到最大CO2吸收量的吸收时间,分别取保温时间为 10 min 、15 min 、20 min 、25 min 和 30m in,结果示于表2.在保温25 min后,CO2吸收量可达28.82%,接近保温30 min后的吸收量(29.34%).因此,在循环试验时,保温时间设定为25 min.
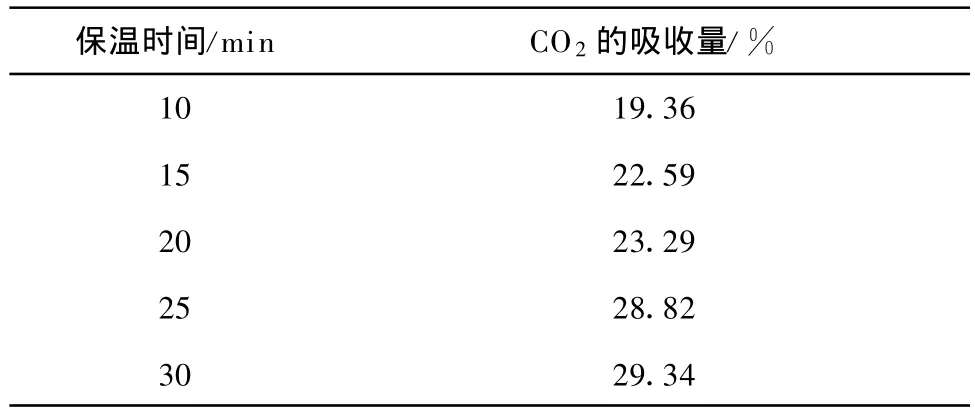
表2 不同保温时间对Li4 SiO4(s-s)吸收CO2量的影响Tab.2 Effects of holding time on CO2 absorption by Li4 SiO4(s-s)
将制备的 Li4 SiO4样品在固定床台架上进行CO2循环吸收/解吸试验.经过20次循环,CO2的吸收量如图5所示.由图5可知,Li4 SiO4(s-s)和Li4Si0.08Ti0.02O4样品均在第1次保温25 min时达到最大的CO2吸收量,分别为28.82%和28.68%;在第2次循环后,吸收量分别仅为 9.94%和12.47%;第3次时吸收量开始上升,从第4次后样品对CO2的吸收量分别稳定在20%和23%左右;循环20次后,Li4 SiO4(s-s)和 Li4 Si0.08 Ti0.02O4样品对CO2的吸收量分别下降了30%和20%.
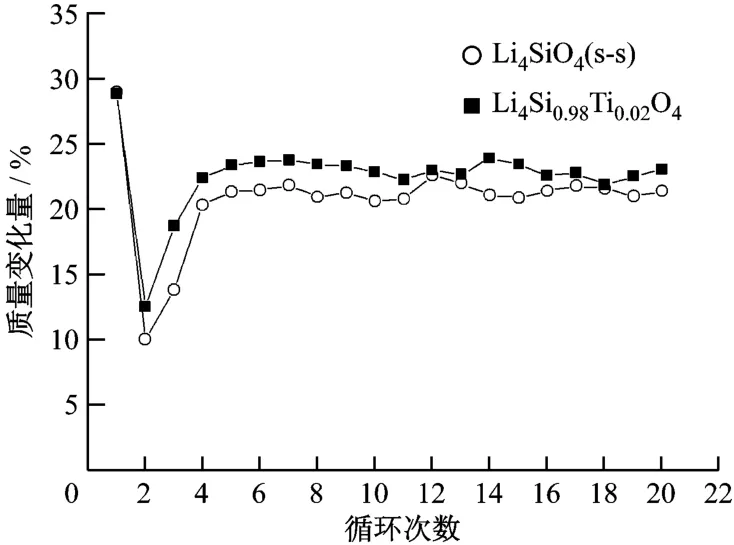
图5 20次循环中CO2的吸收/解吸量Fig.2 W eight changes of CO2 after 20 cyclesof absorption/desorp tion test
在第2次和第3次循环时,样品对CO2的吸收量急剧下降,这可能是由于在样品制备时煅烧温度只有800℃,而在循环试验中解吸温度为850℃,样品的再次煅烧引起了材料结构和性能发生进一步变化,导致在第2次和第3次循环中CO2的吸收效果下降,但吸收剂的性能在此后的循环中得以恢复.在第4~第20次循环中,固溶体Li4 Si0.08 Ti0.02O4基本达到完全再生,说明此样品具有优良的再生性能,并且在高温下有较大的CO2吸收量,可以作为在高温烟气中脱除CO2的固体吸收剂.
3 结 论
(1)与固相合成法制备的Li4 SiO4材料相比,溶胶凝胶法制备的 Li4 SiO4材料具有更高的吸收速率,更有利于高温CO2的吸收.
(2)CO2分压对高温下Li4 SiO4吸收CO2有很大影响,分压越大,吸收的CO2量也越大.
(3)当 TiO2的掺杂量 x=0.02时,固溶体Li4Si0.08Ti0.02O4吸收剂具有较快的吸收速率和良好的吸收效果,最大吸收量可达 31.59%.随着TiO2掺杂量的继续增加,吸收剂中Li4 SiO4含量减少,对CO2的吸收能力迅速下降.
(4)在固定床台架上经过20次CO2循环吸收/解吸后,固溶体Li4 Si0.08 Ti0.02O4对CO2的吸收量仅下降了20%,其中在第4~第20次循环中基本达到完全再生,说明此样品具有优良的再生性能,并且在高温下有较大的CO2吸收量,可以作为在高温烟气中脱除CO2的固体吸收剂.
[1] ABANADES JC,ANTHONY E J,WANG Jinsheng,et a l.Fluidized bed combustion systems integrating CO2cap ture with CaO[J].Environment Science Technology,2005,39(8):2861-2866.
[2] 李英杰,赵长遂.基于钙基吸收剂的循环锻烧/碳酸化反应吸收CO2的试验研究[J].动力工程,2008,28(1):117-121.LI Yingjie,ZHAO Changsui.Experimental study based on calcium-based absorbent cyclic reaction(CCR)for CO2-capture[J].Journal of Power Engineering,2008,28(1):117-121.
[3] KATO Masahiro,NAKAGAW A Kazuaki,ESSAK I Ken ji,et a l.Novel CO2absorbents using lithium-containing oxide[J].International Journal of Applied Ceram ic Technology,2005,2(6):467-475.
[4] VENEGAS M iriam J,FREGOSO-ISRAEL Esteban,ESCAM ILLA Raul,etal.K inetic and reactionmechanism of CO2sorp tion on Li4SiO4:study of the particle size effect[J].Industrial and English Chem istry Resarch,2007,46(8):2407-2412.
[5] OKUMURA Takeshia,MA TSUKURA Yusuke,GOTOU K im ika,et al.Particle size dependence of CO2absorp tion rate of powdered Li4SiO4w ith different particle size[J].Journal of the Ceram ic Society of Japan,2008,116(12):1283-1288.
[6] ESSAK I K,KATO M,UEMOTO H.Influence of temperature and CO2concentration on the CO2absorption p roperties o f lithium silicate pellets[J].Journal of Materials Science,2005,40(18):5017-5019.
[7] 王银杰,其鲁,代克化.Na掺杂对硅酸锂吸收CO2性能的影响[J].物理化学学报,2006,22(7):860-863.WANG Yin jie,QI Lu,DA IKehua.Effect of Na-doping on CO2absorption of Li4SiO4[J].Acta Physico-Chim ica Sinica,2006,22(7):860-863.
[8] MEJIA-TREJO V ictoria L,FREGOSO-ISRAEL Esteban,PFEIFFERHeriberto.Tex tural,structura land CO2chem isorp tion effects p roduced on the Lithium O rthosilicate by its doping w ith sodium(Li4-xNaxSiO4)[J].Chem ica lMaterial,2008,20(22):7171-7176.
[9] GAUER C,HESCHEL W.Doped lithium orthosilicate for absorption of carbon dioxide[J].Material Science,2006,41(8):2405-2409.

