肾癌组织中TβRⅡ基因甲基化状态的检测及其临床意义
张爱莉,樊 博,赵志红,倪晓辰
(河北医科大学第四医院泌尿外科,河北石家庄,050011)
肾细胞癌是泌尿系统最常见的恶性肿瘤之一,其中以透明细胞癌最为多见,约占90%。肾癌的发病机制不详,除遗传因素外,已知的危险因素还包括吸烟、肥胖、工业及水污染、射线等等。由于起病隐匿,约四分之一的肾癌患者在发现时已发生肿瘤局部或远处转移,目前的治疗仍以根治性手术为主,但术后复发率达20%以上,且放疗、化疗效果不佳,因此迫切需要早期诊断方法和其他有效的治疗手段。近年来对于肾透明细胞癌(RCCC)的病因和发病机制已进行了多项研究,遗传学和表遗传学的改变被认为是主要的分子机制,其中表遗传学的改变尤其是DNA甲基化是近来研究的热点。转化生长因子β受体Ⅱ(TβRⅡ)是一个新的抑癌基因,其表达缺失与多种肿瘤的发生发展密切相关。本项研究以肾透明细胞癌为研究对象,探讨TβRⅡ在肾透明细胞癌中的甲基化状态及其蛋白表达,进一步了解了TβRⅡ在肾透明细胞癌发生、发展中的作用,从而为确定肾透明细胞癌的发病机制和早期生物学诊断提供理论依据。现报道如下。
1 材料与方法
1.1 一般资料
收集河北医科大学第四医院2008年3月~2009年10月泌尿外科的肾癌手术切除标本,均无淋巴结及远处转移。一部分液氮保存用于DNA的提取,另一部分10%甲醛固定用于免疫组化研究。肾癌组织标本均经HE染色证实为透明细胞癌。用于提取DNA的肾透明细胞癌标本43例,男 26例,女17例,其中高中分化 34例,低分化9例,并留取其相应的癌旁组织(距癌边缘2 cm以上);用于免疫组化研究的肾透明细胞癌标本40例,男23例,女 17例,其中高中分化31例,低分化9例,其中28例取其癌旁组织(距癌边缘至少2 cm以上)。年龄32~78岁,平均年龄58.6岁。全部患者术前均未接受放射治疗和化学治疗。
1.2 主要试剂
Taq DNA聚合酶、亚硫酸氢盐、对苯二酚(Sigma-aldrich),蛋白酶K(德国Merck公司产品),目的基因和GAPDH引物、甲基化特异性PCR(methylation specificPCR,MSP)引物(上海捷瑞生物技术有限公司),Trizol试剂(北京赛百盛生物技术有限公司),Wizard DNA纯化试剂盒、扩增试剂盒(绿色体系)(Promega公司),TβRⅡ兔多克隆抗体、兔二抗免疫组化试剂盒、DAB显色液(北京中衫金桥生物技术有限公司)。
1.3 甲基化特异性PCR(MSP)检测 TβRⅡ基因甲基化
所选标本经常规蛋白酶K消化,采用酚/氯仿抽提法提取癌组织和癌旁正常组织的基因组DNA。每个样本均取 7 μ g DNA,用 2 mol/L NaOH变性处理[1],于10 mmol/L对苯二酚和3 mol/L亚硫酸氢钠中52℃反应 16 h,然后用Wizard DNA纯化试剂盒纯化经亚硫酸氢钠处理的DNA标本。经亚硫酸氢盐处理后,DNA中的C转变为U,而CpG岛部位发生甲基化的C则不能发生同样的改变。同一样品DNA在亚硫酸氢盐修饰前后分别用甲基化和非甲基化引物扩增,如修饰前无任何目的条带扩增而修饰后有目的条带扩增,则亚硫酸氢盐修饰完全。PCR反应条件为:95℃预变性12 min,开盖加Taq酶;然后95℃60 s,52℃(甲基化)/55℃(非甲基化)45 s,72℃40 s,40个循环;最后72℃延伸10 min。每个标本均做甲基化和非甲基化两种情况的检测。用甲基化酶(SssI)处理过的的正常人外周血DNA作为甲基化阳性对照,同时用未经SssI处理的外周血DNA作为非甲基化阳性对照,阴性对照用灭菌双蒸水代替DNA模板进行PCR。相应的甲基化引物、产物大小及退火温度见表1。

表1 MSP中TβRⅡ基因的引物
1.4 免疫组化检测RCCC组织中TβRⅡ的蛋白表达
采用P-V法,切片经二甲苯脱蜡、梯度乙醇水化、蒸馏水漂洗,3%甲醇过氧化氢阻断内源性过氧化物酶活性,抗原修复,滴加一抗(TβRⅡ浓度按1:100稀释)4℃过夜,滴加二抗,37℃温箱内孵育30min。DAB液显色后,苏木素复染,常规梯度酒精脱水,封片。同时设置以PBS代替一抗为阴性对照。免疫组化结果分析根据许良中等[2]半定量标准:物镜下阳性细胞≤10%为1分;10%~50%为2分;50%~75%为3分;>75%为4分。染色强度分数标准:无色为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。两类百分数乘积<3分为阴性;满3分为阳性(+);4分为较强阳性( );>5分为强阳性( )。
2 结 果
2.1 RCCC组和相应的癌旁正常组中TβRⅡ基因甲基化状态
TβRⅡ基因在RCCC组及癌旁正常组中的甲基化率分别为58.1%(25/43)和34.9%(15/43),差异有统计学意义,RCCC组的甲基化率显著高于癌旁正常组(χ2=4.674,P=0.031)。见图1

图1 RCCC中TβRⅡ基因的甲基化结果
2.2 TβRⅡ基因甲基化与临床病理因素的关系
TβRⅡ基因在 RCCC组中的甲基化率与年龄、性别、肿瘤大小和肿瘤分化程度的关系见表2。经统计学分析,TβRⅡ基因甲基化与临床资料无关。

表2 RCCC中TβRⅡ基因甲基化与临床病理因素的关系
2.3 RCCC组和相应的癌旁正常组中TβRⅡ基因的蛋白表达情况
TβRⅡ免疫组化染色以细胞质出现片状或颗粒状棕黄色着色为阳性。TβRⅡ在肾透明细胞癌组织中低表达或不表达,见图2,在癌旁正常组织中高表达,见图 3。40例肾透明细胞癌组织中TβRⅡ阳性表达率为60.00%(24/40),28例癌旁正常组织中阳性表达率为92.86%(26/28),两者之间差异有统计学意义(P<0.05)。癌组织中TβRⅡ的表达与患者的年龄和性别无关(P>0.05),与肿瘤的大小和分化程度相关(P<0.05)见表3。

表3 RCCC中TβRⅡ基因蛋白表达与临床病理因素的关系
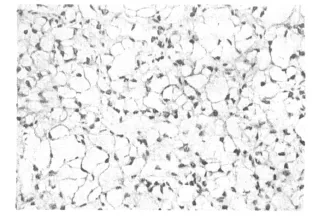
图2 TβRⅡ在肾透明细胞癌组织中低表达(IHC 400倍)
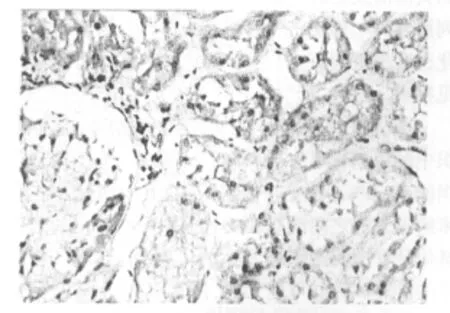
图3 TβRⅡ在癌旁正常组织中高表达(IHC 400倍)
2.4 RCCC中 TβRⅡ蛋白表达与TβRⅡ甲基化之间的关系
在TβRⅡ蛋白表达阳性的RCCC组织中,其甲基化阳性率为70.8%(17/24),在TβRⅡ蛋白表达阴性的 RCCC组织中,其甲基化阳性率为43.8%(7/16),两者差异无统计学意义(P>0.05)。
3 讨 论
恶性肿瘤的发生是一个多因素、多阶段的复杂过程,涉及多种基因和信号传导通路的异常,近年来人们发现转化生长因子β(transforming growth factorβ,TGF-β)信号传导途径异常与肿瘤的发生有着密切的联系。转化生长因子β(transforming growth factorβ ,TGF-β)作为一种细胞因子,可以调节细胞的生长,分化和胚胎发育,诱导细胞粘附和转移,促进细胞外基质形成和创伤愈合,参与和介导免疫抑制和炎症反应等多种人类重要的生理和病理过程[3-4]。而上述作用必须通过与细胞表面的膜受体即转化生长因子β受体(transforming growth factorβ receptor,TβR)结合才能发挥。其中TβRⅡ在TGF-β信号转导中作用最为重要,它主要是通过与 TGF-β配体结合,启动TGF-β信号转导通路在细胞的信息转导[3]。目前认为,转化生长因子β受体是一种抑癌基因,它在细胞表面发挥作用,其突变、缺失及失活对肿瘤的增殖、浸润和转移,及预后有重要影响。
研究表明TβRⅡ基因的失活与多种肿瘤的发生有关,除去遗传学中基因突变与缺失外,普遍认为表遗传学改变尤其是DNA甲基化是TβRⅡ基因失活而致癌的主要机制。TβRⅡ在胃癌[5-6]、前列腺癌[7-8]、肺癌[9-10]和胰腺癌[11]中的异常甲基化已有报道,但它们在肾癌中的甲基化情况尚未见报道。
本研究中作者发现TβRⅡ在肾透明细胞癌组织中的甲基化率为58.1%,显著高于癌旁正常组织的34.9%。但是在癌组织中,其甲基化与各临床病理资料之间没有相关性,说明TβRⅡ基因甲基化是肾透明细胞癌发生的早期分子事件,与肿瘤的发展和转移可能无关,所以TβRⅡ基因甲基化还不能作为肾透明细胞癌恶性程度评估和判断预后的参考指标。TβRⅡ在肾透明细胞癌组织中的免疫组化结果显示,基因蛋白表达在RCCC组显著低于癌旁正常组,且其蛋白表达与肿瘤的大小和肿瘤分化程度相关,说明TβRⅡ蛋白水平表达的下调或缺失可能参与了肾透明细胞癌的发生和发展。但是TβRⅡ甲基化阳性率在蛋白表达阳性的RCCC组织与蛋白表达阴性的RCCC组织中差异无统计学意义,究其原因,其一可能是因为在RCCC中,除了甲基化外,可能还有其他一些机制导致蛋白表达的异常,如基因突变、杂合缺失等;其二,可能由于样本例数的限制,降低了相应的检验效能,今后有待于进一步扩大样本例数以明确甲基化与蛋白表达的相关性。
本研究结果显示TβRⅡ基因启动子区的高甲基化与肾透明细胞癌的发生有关,为肾透明细胞癌的早期诊断提供了分子参考指标,同时可以用去甲基化药物对这些位点进行干预,以便对肾透明细胞癌进行早期预防和治疗。对TβRⅡ及它与肿瘤相关性的深入研究将有助于我们进一步揭示肿瘤的发生、发展、浸润和转移机制,找到抑制肿瘤的靶点或预测肿瘤患者预后的分子指标。
[1]Herman J G,Graff JR,Myohanen S,et al.Methylationspecific PCR:a novel PCR assay for methylation status of CpG islands[J].Proc Natl Acad Sci USA,1996,93(18):9821.
[2]Owens LV,Xu Craven RJ,et al.Overexpression of the focal adhesion kinasep125FAK in invasive human tumors[J].Cancer Res,1995,5(13):2752.
[3]Massague.J.TGF-β signal transduction[J].Annu Rev Biochem,1998,67:753.
[4]RobertsAB.TGF-beta Signaling from receptors to the nucleus[J].Micorbes Infect,1999,(15):1265.
[5]Kang SH,Bang YJ,Im YH,et al.Transcriptional repression of the transforming g rowth factorβ typeⅠreceptor gene by DNA methylation results in the development of TGF-β resistance in human gastric cancer[J].Oncogene,1999,18(51):7280.
[6]Oliveira C,Seruca R,Seixas M,et al.The clinicopathological features of gastric carcinomas with microsatellite instability may be mediated by mutations of different“target genes”:a study of the TGF beta RII,IGFII R,and BAX genes[J].Am J Pathol,1998,153(4):1211.
[7]Zhang Q,Rubenstein JN,Jang T L,et al.Insensitivity to transforming growth factor-beta results from promoter methylation of cognate receptors in human prostate cancer cells(LNCaP)[J].Mol Endocrinol,2005,19(9):2390.
[8]Yamashita S,akahashi S,McDonell N,et al.Methylation silencing of transforming growth factor-beta receptor type II in rat prostate cancers[J].Cancer Res,2008,68(7):2112.
[9]Zhao J,Liu Z,Li W,et al.Infrequently methylated event at sites-362 to-142 in the promoter of TGF beta R1 gene in non-small cell lung cancer[J].J Cancer Res Clin Oncol,2008,134(8):919.
[10]Zhang HT,Chen XF,Wang JC,et al.Defective expression of transforming growth factor beta receptor typeⅡis associated with CpG methylated promoter in primary non-small cell lung cancer[J].Clin Cancer Res,2004,10(7):2359.
[11]Jonson T,Albrechtsson E,Axelson J,et al.Altered expression of TGFB receptors and mitogenic effects of TGFB in pancreatic carcinomas[J].Int J Oncol,2001,19(1):71.

