Fe掺杂纳米二氧化钛的光催化活性研究
王志坚,苗玉英,李杨,毕恩卓
(1.吉林省石油化工设计研究院,长春 130000;2.长春市双阳区环境监察大队,长春 130060;3.一汽集团模具有限公司,长春 130011;4.长春理工大学,长春 130022)
随着工业生产的迅速发展,大量的污染物不断地排入自然界,使人类的生存环境日益恶化,其中水环境问题尤为严重。污水中含有大量的有机污染物,其中许多是难生物降解的,如酚类、多氯联苯和多环芳烃等,它们的生物毒性较大,严重地威胁着人类的健康和生命,改善环境状况,消除水中的有机污染物,是人类当前亟待解决的重大问题。
1972年 Fujishima等报道了在光电池中光辐射TiO2时可持续发生水的氧化还原反应,并产生氢气[1]。光催化氧化反应作为一种深度的氧化过程具有以下优点:(1)能使有害物质完全分解,不会产生二次污染;(2)可在常压下操作;(3)无需大量消耗除光以外的其他物质,可降低能耗和原材料的消耗量;(4)可达到除毒、脱色、去臭的目的;(5)光催化剂具有廉价、无毒、稳定及可重复利用。研究表明,许多难降解的污染物,如卤代烃、有机磷化合物、农药、表面活性剂及有机染料等,在光催化氧化作用下,都能得到理想的去除效果[2]。
随着现代科学技术的迅速发展,纳米材料的应用越来越广泛。纳米二氧化钛是目前研究较多的纳米无机功能材料之一,具有良好的体积效应、表面效应、光学特性、颜色效应,在光、电及催化等方面显示出其非凡性质,作为一种新型材料,其应用领域日益广泛。与常规材料相比,纳米二氧化钛因其光催化活性高、氧化能力强、化学稳定性好、价廉以及在实际应用中工艺流程简单、无二次污染等优点而备受重视,在织物、涂料、污水处理、催化剂载体、光催化剂、空气净化、杀菌、太阳能电池原料、防紫外线添加剂等方面表现出独特的性能,应用广泛[3-5]。在提高半导体催化活性方面,金属或金属氧化物与半导体复合组成的光催化剂发展迅速,制备和开发纳米二氧化钛成为国内外科技界研究的热点[6]。
1 实验部分
1.1 实验试剂与仪器
钛酸四丁酯(C4H9O)4Ti,惠世生化试剂有限公司,分析纯;盐酸(HCl),北京化学试剂总厂,分析纯;无水乙醇(C2H5OH),北京化学试剂总厂,分析纯;三氯化铁(FeCl3),莱阳化工实验厂,分析纯。
CJJ78-1型搅拌器(上海梅香仪器有限公司),DF204型电热鼓风干燥箱(北京医疗设备二厂),RJM-2.8-12型马弗炉(沈阳市节能电炉厂),HL14600型高压汞灯,(涿州市圣威尔 UV 科技公司),SP-721E型可见分光光度计(北京东南实验室设备公司),Y-2000型X射线衍射仪(丹东奥龙射线仪器有限公司)。
1.2 实验方法
1.2.1 制备铁掺杂纳米二氧化钛

图1 实验流程Fig.1 Experimental process
1.2.2 实验试剂配比
根据实验目的和原理,采取不同配比进行实验,见表1。
1.2.3 Fe掺杂纳米TiO2制备
用移液管移取30 ml乙醇置于烧杯内,滴加6.8 ml钛酸四丁酯,放于搅拌器上搅拌1~2h,制得 A液。将按一定比例计算的三氯化铁溶于10 ml水与20 ml的乙醇溶液中,制得B液。在A液搅拌1~2h后,滴加2~3滴盐酸溶液调pH值至4.0,以免凝胶速度过快,缓慢将B液滴加到搅拌着的A液中,开始滴加速度可快些,出现絮凝时要放慢速度,滴加B液时速度不能过快或太慢,否则将得不到所需凝胶,此过程一直搅拌,1~2h后出现凝胶,待稳定后停止搅拌,将所得凝胶陈化72~96h。置于鼓风干燥箱内,60℃干燥24~48h,取出,研磨,在马弗炉内500℃焙烧2h。

表1 试剂配比Tab.1 Reagents proportion
1.2.4 光催化降解实验
称量0.01 g直接耐酸性大红,溶解于去离子水中,置于500 ml容量瓶内,配成20 mg/L的直接耐酸性大红溶液,测其吸光度值。称量任一比例铁掺杂的纳米二氧化钛0.05g,放于100 ml直接耐酸性大红溶液中,进行催化降解。黑暗中搅拌10min建立吸附平衡,测其吸光度值。之后,打开高压汞灯,每隔20min取出一部分离心,取上层清液测其吸光度值,测 3组。测吸光度时,波长调至 475 nm,使用1cm比色皿进行测量。
2 结果与讨论
2.1 XRD物相分析
采用X射线衍射(XRD)通过对样品的粒径和晶型来对未掺杂纳米二氧化钛和掺杂8%纳米二氧化钛进行测定,CuK靶,Ni过滤器,扫描速度为2°/min,管电压为40 kV,管电流为30 mA。图2和图3分别是未掺杂和铁掺杂 8%的纳米二氧化钛在500℃下焙烧2h后的XRD谱图。
根据JCPDS File(No.21-1272)记载,锐钛矿结构TiO2的衍射峰分别出现在2为25.3°、37.8°、48.0°、54.4°、56.1°、62.9°和 76.1°。在图 2 和图 3中,未掺杂和掺杂8%Fe的纳米二氧化钛衍射峰位与文献记载基本一致,实验结果表明,样品中Fe元素已分布于纳米二氧化钛之中,经过500℃焙烧后转变成锐钛矿。但是并未发现 FeCl3的衍射峰,只是随着Fe的掺杂,粒径略有减小,晶胞明显收缩,这与Fe3+离子半径比Ti4+离子半径小是一致的,这也说明铁均匀地进入了TiO2晶格,为能级耦合创造了条件。应用Scherrer公式Dhkl=(k)/(cos)可计算出未掺杂的 T iO2的平均粒径d为5.89nm,掺杂后的TiO2的平均粒径d为4.65nm。

图2 未掺杂纳米TiO2的XRD图Fig.2 XRD patterns of pure TiO2

图3 铁掺杂量为8%纳米TiO2的XRD图Fig.3 XRD patterns of doped TiO2 with 8%Fe3+
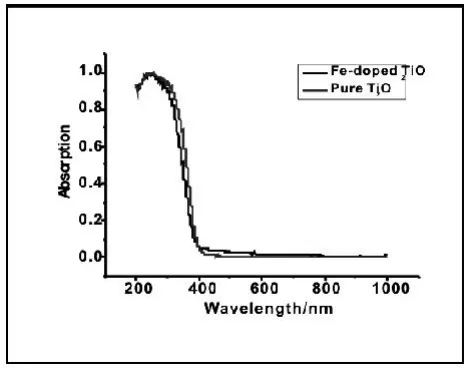
图4 纯TiO2和Fe掺杂8%TiO2的紫外漫反射图Fig.4 DRS of pure TiO2 and doped TiO2 with 8%Fe

图5 不同掺铁量TiO2对4BS的降解率比较Fig.5 Compare with efficiency of 4BS degradation of TiO2 synthesized by changing doping of iron
2.2 样品的紫外漫反射分析
图4为纯TiO2和铁掺杂8%的纳米TiO2的紫外漫反射图,由实验结果可看出,铁掺杂后的TiO2发生一定的蓝移,其原因是掺杂后的粒径变小,即经适当的 Fe3+掺杂的锐钛型纳米二氧化钛粒子的光催化降解效率升高。
2.3 不同掺铁量对TiO2催化活性的影响

表2 不同掺铁量的TiO2对直接耐酸性大红的降解率(%)Tab.2 Nanometer TiO2 regard efficiency of 4BS degradation synthesized by changing doping of iron
掺铁量与纳米二氧化钛材料光催化活性有关,光催化活性的评价通过催化降解直接耐酸性大红的表观降解率进行说明,各样品降解时间分别为 0、10、20、40、60min降解率变化见如表2。掺杂比例分别为0%、3%、5%、8%、10%、13%的纳米二氧化钛在可见光下降解率变化情况见图5。
由图5可知,掺铁改性后的纳米二氧化钛的催化活性普遍比未掺杂的高,掺杂量在8%时的降解效果最好,而且越远离这个比例,降解率下降越明显。
3 结论
通过上述实验可得出如下结论:
(1)由XRD物相分析可看出,经过500℃焙烧后,纳米二氧化钛保持了完整的晶形,热稳定性较好。
(2)由紫外漫反射谱图可看出,掺杂后纳米二氧化钛的粒径变小,光催化活性提高。
(3)通过光催化降解实验结果可看出,铁掺杂后的纳米二氧化钛的催化活性普遍比未掺杂的纳米二氧化钛的高,Fe3+的掺杂量在8%时催化活性最高。
光催化在环境治理上的应用越来越引起人们的重视,尽管目前相关研究较多,取得了一定的进展,但是离实际应用还有一定的距离,如大多实验采用粉末状TiO2和紫外光源。因此,如何选用合适的固化技术,增大其表面积以及如何提高光催化剂活性,使其能够充分利用太阳光源进行光催化降解是今后迫切需要解决的问题。
[1]Fujishima A,Honda K.Electrochemical photolysis of water at asemiconductor electrode[J].Nature,1972,238:37-38.
[2]王希民.纳米二氧化钛光催化剂研究进展[J].当代化工,2001,30(4):234-237.
[3]范崇政,肖建平,丁建伟.纳米TiO2的制备与光催化反应研究进展[J].科学通报,2001,46(4):256-273.
[4]周艺,李志伟.Pr3+、Ho3+掺杂TiO2纳米粒子的光催化性能[J].湖南师范大学学报,2003,26(2):70-72.
[5]张淑霞,李建保,张波.TiO2颗粒表面无机包覆的研究进展[J].化学通报,2001,(2):71-74.
[6]刘保顺,何鑫,赵修建.纳米TiO2表面能态及光生电子-空穴对复合过程研究[J].光谱学与光谱分析,2006,26(2):208-212.

