颈交感神经干离断对CCl4所致大鼠肝损伤肝功能的影响
曾 议,夏 锋,田 峰,程 龙,王曙光
(第三军医大学附属西南医院全军肝胆外科研究所、西南肝胆外科医院,重庆,400038)
当前研究表明化学性去肝内交感神经可以减轻CCl4所致肝损害程度,有利于肝脏合成功能改善和胆红素的代谢[1]。但对于交感神经系统如何调控肝脏功能的途径尚不明确。交感神经系统由中枢和外周两大部分组成,其中枢结构包括初级中枢和高级植物性中枢,以及中枢间的联系;外周结构是由神经节和联合神经节的神经纤维组成,其分布、走形较为弥散,构成复杂的网络。肝脏交感神经调控系统由腹腔神经节、脊髓胸腰段、下丘脑交感中枢三个不同层次的中枢构成[2]。本实验应用颈交感神经离断大鼠模型[3],探讨在交感神经调控系统高级中枢节段去交感神经状态下,对急性肝损伤时肝功能的影响,以了解肝脏的交感神经调控机制。
1 材料与方法
1.1 试剂与仪器
全自动生化分析仪、CCl4(重庆化学试剂公司),RM6280C多通道生理信号采集仪(成都仪器厂),CoulArray高效液像色谱-电化学检测系统5600A CA-1001(USA),双人双目手术显微镜。
1.2 实验动物与分组
健康雄性Wistar大鼠共30只,体质量190~220 g,均由第三军医大学实验动物中心提供。随机分成3组,每组10只。
1.2.1 A组(正常对照组):大鼠经0.3%戊巴比妥钠腹腔注射麻醉后,仅以腹腔注射相同剂量灭菌生理盐水(0.2 mL/100 g):B假手术组(Sham组)大鼠以0.3%戊巴比妥钠腹腔注射麻醉。麻醉成功后,脱毛剂脱去颈部切口毛发,皮肤消毒取颈正中切口剪开皮肤、手术显微镜下分离气管旁右侧,暴露右颈总动脉及神经节,于右侧颈总动脉分叉处的背侧面找到颈上神经节,距其下3 mm寻找右侧颈交感神经干。可见一斜向外下走形跨过颈总动脉前方的神经纤维,以微量注射器针头小心挑起、分离右颈交感神经干,分离一段节后纤维,置于0.4 mm直径铂金丝正负电极上,悬空记录神经冲动发放电位,阴极电极夹于切缘皮肤。手术野滴注温热的液体石蜡油以防神经干燥,观察神经纤维放电的情况,如放电的幅度、波形等并打印记录。待交感神经放电趋于稳定后,腹腔注射10%CCl4石蜡油液[4](0.2 mL/100 g,由CCl4原液和灭菌石蜡油按体积比1∶9配制而成);并持续记录交感神经干神经冲动电位发放变化约10 min C颈交感干离断组:大鼠在行前操作的基础上,切断右交感神经干[5],腹腔注射10%CCl4溶液;手术完毕后缝合切口。手术组动物在麻醉清醒后,若出现同侧眼裂变窄、瞳孔缩小等典型的霍纳综合征(Horner′s syndrome)则证明颈交感干离断。
1.2.2 B、C组分别于实验后第4、7、10天经腹腔注射追加相同剂量10%CCl41次,A组注射相同剂量的生理盐水,第10天注射完CCl4液24 h后。采取同一时段放血处死大鼠。处死前由下腔静脉抽血,3 900 r/min离心10 min后取血清-20℃冰箱保存,检测肝功能;处死后取同一部位肝组织,以冰生理盐水冲洗干净血迹后切取小块肝组织,滤纸吸去多余水份,以CoulArray高效液像色谱-电化学法测定肝组织内NE浓度;另取小块肝组织,以 10%甲醛固定后行病理切片染色。
1.3 检测指标与方法
全自动生化分析仪检测各组肝功能各项指标,前白蛋白(PA):免疫比浊法;白蛋白(Alb):溴甲酚氯比色法;总胆红素(TB)和直接胆红素(BD):速率法。ALT、AST操作方法参见试剂盒说明书。
颈交感神经神经冲动发放的电生理记录按参考文献[6]方法加以改进。
Coularray高效液相色谱-电化学法测定肝组织内NE浓度。
肝组织石蜡切片HE染色按照石蜡切片HE染色常规造作进行。
2 结 果
2.1 颈交感神经干离断状态对肝脏功能各项指标的影响
结果显示:shame组和手术组相比较白蛋白和前白蛋白,结果有显著差异(P<0.05);AST、ALT有显著差异(P<0.05)。shame组与手术组总胆红素比较具有显著差异(P<0.05)。结果表明,同shame组相比较,颈交感干离断有利于CCl4所致肝损害后蛋白合成功能的改善、胆红素的代谢和降低AST、ALT。
表1 各组大鼠血清肝功能指标( ±s)
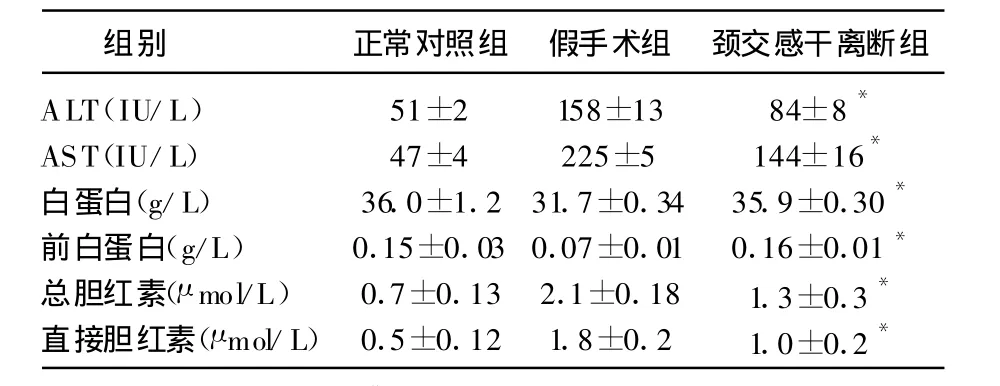
表1 各组大鼠血清肝功能指标( ±s)
与假手术组比较,*P<0.05
组别 正常对照组 假手术组 颈交感干离断组ALT(IU/L)51±2 158±13 84±8*AST(IU/L)47±4 225±5 144±16*白蛋白(g/L)36.0±1.231.7±0.34 35.9±0.30*前白蛋白(g/L)0.15±0.030.07±0.01 0.16±0.01*总胆红素(μ mol/L)0.7±0.13 2.1±0.18 1.3±0.3*直接胆红素(μ mol/L)0.5±0.12 1.8±0.2 1.0±0.2*
2.2 颈交感神经干经腹腔注射CCl4前后电生理变化
采用RM6280C多通道生理信号采集仪记录交感神经电位发放。观察神经纤维放电的情况,如放电的幅度、波形等变异性较大。在手术显微镜下分离神经纤维,直至放电较为单一为止,以使尽可能接近单纤维记录:急性肝损伤造模前大鼠颈交感神经干放电波幅较低、频率均一、电压趋于平稳,经CCl4腹腔内注射行肝损伤刺激以后,交感神经干放电立刻增加、波伏增大,呈脉充式增强,持续记录约5 min后,交感神经电活动回复正常时波形。剪断交感神经干后,记录波形立即消失,经两断端均无法再次测出。
2.3 肝组织内NE浓度
Coularray高效液相色谱-电化学法测定肝组织内NE浓度,不同处理组色谱图见图1,各组肝组织内去甲肾上腺素浓度实测值:正常对照组为(39.45±1.0)ng/mL,假手术组为(53.77±1.34)ng/mL,颈交感干离断组为(45.98±0.76)ng/mL。颈交感干离断组和正常组、shame组比较,差异非常显著(P<0.01)。
结果说明:颈交感干离断有效降低了肝组织内NE浓度;假手术组和颈交感干离断组经CCl4行急性肝损伤造模处理后,肝组织内NE浓度均较正常对照组升高。
图1 不同处理组色谱图
2.4 颈交感神经干离断对肝组织病理改变的影响
假手术组CCl4肝损伤后肝组织切片HE染色,肝组织充血明显、汇管区炎性细胞浸润明显,肝细胞混浊、肿胀、坏死。颈交感神经干离断后CCl4肝损伤后组织切片HE染色,肝组织充血、肝细胞混浊、肿胀较shame组明显减轻,炎细胞浸润较少。见图2。
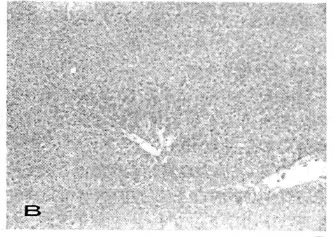
图2 肝组织病理切片 HE 100倍
3 讨 论
当前研究表明,肝脏的交感神经参与了肝脏的各种生理功能的调节,如肝脏的血液循环,糖代谢和酮体及胆汁的生成,尿素的排泌和氨的摄取等。肝脏交感神经的节后纤维主要来源于腹腔神经节和肠系膜神经节。交感神经调控系统由腹腔神经节、脊髓胸腰段、下丘脑交感中枢三个不同层次的中枢构成。Iwai M等的研究表明以刺激交感神经兴奋活化增强可以加重肝损伤[7],夏锋等研究表明,肝内去化学性交感神经可以显著减轻CCl4所致的肝损害[8],但中枢交感神经系统对内脏器官功能活动调节的神经传入和传出通路一直没有明确资料显示,内脏器官的神经功能调控值得深入研究。
另有研究发现,大鼠颈交感干离断(TCST)TCST可以降低Willis环动脉血中NE的含量、增加颈动脉血流。切断颈上神经节前纤维而保存颈上神经节可以保证节后纤维不变性。下丘脑-垂体-肾上腺轴及颈交感干-下颌下腺轴在神经-内分泌-免疫系统的相互作用中起重要作用。颈交感神经干离断后,减少了外周应激刺激向中枢的传入,进而对交感-肾上腺系统的兴奋具有抑制作用,可以减弱应激性刺激产生的交感神经中枢活化[9-10],同时可以干扰应激产生的交感-肾上腺髓质的反应,降低血浆儿茶酚胺水平,阻断或改善随后发生的一系列病理改变;四氯化碳在肝脏经细胞色素P450激活为自由基CCl3,攻击肝细胞膜上的磷脂分子,继而与膜脂质和蛋白质大分子进行共价结合,使蛋白质代谢障碍,引起膜结构和功能完整性的破坏。另外,CCl3可抑制细胞膜和微粒体膜上钙泵的活性,使Ca2+内流增加。此两种途径最终导致肝细胞浆中可溶性溶酶渗出入血,引起一系列生化指标改变[11]。前白蛋白(PA)是一种半衰期较短而对肝细胞功能变化非常敏感的蛋白成分,能适时反应肝细胞的蛋白合成功能。
本组实验结果显示:本实验中颈感神经传入活动正常情况下趋于稳定发放,放电电压和波幅较弱。在腹腔注射CCl4后颈交感干的生物电放电活动立即增强,波伏和频率明显增加,几乎没有潜伏期;我们认为可能系腹腔内交感神经末稍感觉纤维感受刺激后,神经冲动沿内脏大神经向上经交感神经节传递。最终经颈交感干的传入刺激增多,致下丘脑交感中枢兴奋增强,进一步激活交感-肾上腺系统,致血循环中儿茶酚胺增加。由此可能激活kupffer细胞活化,各种促炎因子表达上调,最终促炎和抗炎因子平衡失调,致组织细胞损害;反之离断颈交感神经干后,阻断或减弱交感中枢激活的外周信息传入,下丘脑-垂体-肾上腺轴激活减弱,阻断或改善随后发生的一系列病理改变。
本试验结果表明颈交感神经离断在CCl4所致肝损伤有利于改善蛋白合成功能和胆红素代谢,和降低血清AST、ALT。原因可能是在急性肝损伤的条件下,交感神经处于高紧张性状态,从而起到高效的调控功能。一旦失去了这种调控作用则会产生功能失衡,引起代谢改变。而在基础状态下对代谢的调控功能则相对较低。另外,副交感神经的调控与交感神经存在着一种拮抗现象。它们共同对肝脏功能进行控制。交感神经中枢位于下丘脑的腹侧正中,其生理功能偏向于异化代谢及分解作用。而副交感神经中枢位于下丘脑外侧部,其生理功能偏向于同化作用。当交感神经活化减弱以后抑了异化作用,而使同化作用的趋势占优,所以可使蛋白的合成加强。肝组织内去甲肾上腺素浓度在颈交感干离断后较假手术组降低,结果说明颈交感干离断有效降低了肝组织内去甲肾上腺素浓度,交感神经主要的神经递质分泌受到了抑制。而肝组织内去甲肾上腺素水平在颈交感干离断后较正常对照组增高,说明神经递质的释放同时受到体液因素和神经反馈调节,另外可能还有其它机制参与。
[1]Xia F,He Z,Li K,et al.Evaluation of the role of sympathetic denervation on hepatic function[J].Hepatol Res,2006,36(4):259.
[2]王子栋,徐有恒.植物性神经系统生理学-基础与临床[M].北京:科学出版社,1992:27.
[3]张丽红,马铃,崔健君.妊高征大鼠颈交感神经干离断对胎鼠脑的保护作用[J].中华麻醉学杂志,2006,26(1):75.
[4]长尾由纪子,叶木荣,赖小平.实验性肝损伤模型建立的初步探讨[J].广西中医药,2006,29(3):47.
[5]赵广翊,高林林,孟凌新.颈交感神经干离断对应激大鼠NO及胃粘膜血流量的影响[J].临床麻醉学杂志,2005,21(11):773.
[6]唐洪泰,田建广.严重烧伤早期大鼠心脏交感神经电生理活动的变化[J].中华烧伤杂志,2001,17(5):272.
[7]Iwai M,Shimazu T.Exaggeration of acute liver damage by hepatic sympathetic nerves and circulating catecholamines in perfused liverof rats treated with galactosamine[J].Hepatology,1996,23:524.
[8]夏锋,董家鸿,何振平,等.去交感神经状态对大鼠肝功能的影响[J].第三军医大学学报,2004,26(3):230.
[9]Bonvento G,Lacombe P,MacKenzie ET,et al.Diffrential effects of electrical stimulation of the dorsal raphe nucleus and of cervical sympathectomy on serotonin and noradrenaline concentrations in major cerebral arteries and pial vessels in the rat[J].JCereb Blood Flow M etab,1990,10(1):123.
[10]王贤裕,王清秀,杨光,等.星状神经节阻滞对兔血浆去甲肾上腺素浓度的影响[J].中华麻醉学杂志,2001,21(7):420.
[11]赵艳玲,蔡光明,刘军,等.正交试验法优选小鼠四氯化碳肝损伤模型[J].解放军药学学报,2001,17(4):215.

