土壤中淀粉酶产生菌的筛选及产酶条件优化
雷晓燕
(沈阳化工大学环境与生物工程学院,辽宁沈阳 110142)
土壤中淀粉酶产生菌的筛选及产酶条件优化
雷晓燕
(沈阳化工大学环境与生物工程学院,辽宁沈阳 110142)
为筛选淀粉酶的高产菌株,利用淀粉水解圈作为筛选模型,从淀粉厂附近土壤中筛选得到产淀粉酶能力较强的细菌B5.对其产酶条件进行优化,最终得到最佳碳源为质量分数为 2.0%的淀粉,最佳氮源为质量分数为 0.5%的酵母膏加质量分数为 0.5%的蛋白胨,最适初始pH值为6.0,最适培养温度为 37℃,最适溶氧量为 50 mL摇瓶装 15 mL培养基,最佳产酶时间为 48 h,培养基中同时补充质量分数为 0.05%的MgSO4、质量分数为 0.05%的 CaCl2和质量分数为0.005%的 FeSO4时可大幅提高酶活力.菌株B5液体发酵产酶活力最高可达 158.89 U/g,该淀粉酶最适反应温度为 42℃,最适反应 pH值为 5.0.
淀粉酶; 水解圈; 酶活力
淀粉酶(Amylase)是水解淀粉和糖原的酶类的总称,广泛存在于动植物和微生物中,是最早实现工业生产并且迄今为止用途最广、产量最大的酶制剂品种[1].特别是 20世纪 60年代以来,由于酶法生产葡萄糖,以及用葡萄糖生产异构糖浆的大规模工业化,淀粉酶的需要量越来越大,几乎占整个酶制剂总产量的 50%以上[2].淀粉酶根据其作用方式可分为 α-淀粉酶(EC3.2.1.1)与β-淀粉酶 (EC3.2.1.2).α-淀粉酶广泛分布于动物(唾液、胰脏等)、植物 (麦芽、山萮菜)及微生物中[3].微生物的许多种类都能产生淀粉酶,Buchanan和 Tamuri等人描述了数百种嗜热真菌和上千种细菌可产生淀粉酶,仅Bacillus属 48个种中就有 32个种能产生α-淀粉酶[4].淀粉酶种类繁多,特点各异,可应用于造纸、印染、酿造、果汁和食品加工、医药、洗涤剂、工业副产品及废料的处理、青贮饲料及微生态制剂等多种领域[5].因为淀粉酶的用途广泛,各国在对淀粉酶产生菌的筛选方面都做了大量的研究工作[6-8],目前所得淀粉酶活力最高可达到260 U/mL左右.虽然不少微生物能产生淀粉酶,但适合商业生产需要的菌株仍然很少,在淀粉酶生产过程中选择适合的菌株是最重要的前提条件.本文以土壤作为原料,从中筛选出具有产淀粉酶能力的出发菌株,并对所得的出发菌株进行产酶条件的考察和优化,进一步提高其产酶能力,为使其最终能应用于工业生产、带来经济效益做大量的准备工作.
1 实验材料与方法
1.1 材 料
1.1.1 菌种
细菌B5,由沈阳某淀粉厂附近土壤中筛选得到.
1.1.2 培养基
(1)斜面培养基:可溶性淀粉,质量分数2.0%;蛋白胨,质量分数 0.5%;NaCl,质量分数 0.5%;KH2PO4,质量分数 0.1%;KNO3,质量分数 0.1%;琼脂,质量分数 2.0%;水 100 mL;pH值 6.0.
(2)分离平板培养基:可溶性淀粉,质量分数 2.0%;酵母膏,质量分数 0.5%;蛋白胨,质量分数 0.5%;NaCl,质量分数 0.5%;KH2PO4,质量分数 0.1%;琼脂,质量分数 2.0%;水 100 mL;pH值 6.0.
(3)种子培养基:可溶性淀粉,质量分数2.0%;酵母膏,质量分数 0.5%;蛋白胨,质量分数 0.5%;NaCl,质量分数 0.5%;KH2PO4,质量分数 0.1%;水 100 mL;pH值 6.0.
(4)产酶液体培养基:可溶性淀粉,质量分数 2.0%;酵母膏,质量分数 0.5%;蛋白胨,质量分数 0.5%;NaCl,质量分数 0.5%;KH2PO4,质量分数 0.1%;CaCl2·2H2O,质量分数0.05%;MgSO4·7H2O,质量分数 0.05%; FeSO4·7H2O,质量分数 0.005%;水 100 mL;pH值 6.0.
1.1.3 主要试剂
培养基成分为市售分析纯和生化试剂.
1.1.4 主要仪器
DHP-420电热恒温培养箱 (光明医疗仪器厂),LDZX-40BⅠ型立式自动电热压力蒸汽灭菌器(上海申安医疗器械厂),ZD-85气浴恒温振荡器(常州国华电器有限公司),WD900微波炉(顺德市格蓝仕电器实业有限公司),HNP-1水平流形超净工作台 (南通沪南科学仪器有限公司),101-2A型数显式电热恒温干燥箱 (上海阳光实验仪器有限公司),FA1104分析天平 (上海精科天平有限公司),BC/BD-428A卧式冷藏冷冻转换柜 (青岛海尔特种电冰柜有限公司),SP-2000 722型可见分光光度计 (上海莱奥光学仪器有限公司).
1.2 方法
1.2.1 菌种筛选
初筛:从沈阳某淀粉厂附近采集土样,称取5 g土样,放入装有45 mL无菌水的三角瓶中,震荡 20 min后静置 5 min,然后进行浓度梯度稀释到 10-6,分别在 10-4、10-5、10-6浓度下各取1 mL土壤稀释液制成混菌平板,将培养皿放入37℃培养箱中培养 24 h.取出培养好的平皿,在长出的菌落上滴加碘液,菌落周围如有无色透明圈出现,说明淀粉被水解,即该菌株能产生淀粉酶.挑选有明显透明圈的单菌落,转接到斜面上,编号保存.
复筛:从冰箱中取出所有初筛得到的菌株,转接试管斜面活化,37℃下恒温培养 24 h.将所有菌种分别点种到分离培养基平板上进行培养,待菌落长成后向菌落上滴加碘液,比较淀粉水解圈大小,挑取d0/d1(d0为水解圈直径,d1为菌落直径)较大的菌株连续进行 3次平板点种培养,选取d0/d1值最大的菌株作为本实验出发菌株.
1.2.2 淀粉酶活力的测定[9]
发酵液 4 000 r/min离心 20 min,取上清液,即为粗酶液.
取5 mL质量分数为 0.5%的可溶性淀粉溶液,在37℃水浴中预热10 min,加入适当稀释的酶液0.5 mL,准确反应 5 min后,用 5 mL浓度为 0.1 mol/L的HCl终止反应.取 0.5 mL反应液与 5 mL稀碘液显色,在 620 nm处测吸光度.以 0.5 mL蒸馏水代替0.5 mL反应液为空白,以不加酶液(加同体积的缓冲液)的管为对照.酶活定义:在37℃、pH =6.0条件下,5 min内水解1 mg淀粉的酶量为一个活力单位.酶活力根据以下公式计算:
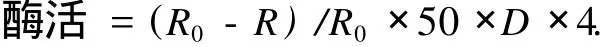
式中,R0、R分别表示对照和反应液的光密度,D为粗酶液的稀释倍数.调整D使(R0-R)/R在0.2~0.7之间,4为转换系数,无单位.
1.2.3 最佳碳源的确定
取出发菌株活化,然后取一环接入种子培养基中培养,于 24 h后分别取 1 mL培养液,加入到 2.0%淀粉,2.0%麦芽糖,2.0%乳糖, 2.0%蔗糖,2.0%葡萄糖 5种不同碳源的产酶培养基中,于 37℃摇床培养 48 h.分别离心收集粗酶液,测定其淀粉酶活力,根据所测定的结果确定最佳碳源.
1.2.4 最佳氮源的确定
取出发菌株活化,然后取一环接入种子培养基中培养,于 24 h后分别取 1 mL培养液,加入到氮源分别为 0.5%(质量分数,下同)牛肉膏, 0.5%酵母膏,0.5%蛋白胨,0.5%牛肉膏 + 0.5%蛋白胨,0.5%酵母膏 +0.5%蛋白胨 5种不同氮源的产酶培养基中.于 37℃摇床培养48 h.分别离心收集粗酶液,测定其淀粉酶活力,根据所测定的结果确定最佳氮源.
1.2.5 最佳培养基初始 pH值的确定
取出发菌株活化,然后取一环接入种子培养基中培养,24 h后分别取 1 mL培养液,加入到pH值分别为 5.0、6.0、7.0、8.0、9.0,碳源和氮源已优化的产酶培养基中,37℃下培养 48 h.分别离心收集粗酶液,测定其淀粉酶活力,根据所测定的结果确定最佳培养基的初始 pH值.
1.2.6 最佳培养温度的确定
取出发菌株活化,然后取一环接入种子培养基中培养,24 h后分别取 1 mL培养液,加入碳源、氮源和 pH值已优化的产酶培养基中,分别于 33℃、35℃、37℃、39℃、41℃下培养 48 h.分别离心收集粗酶液,测定其淀粉酶活力,根据所测定的结果确定最佳培养温度.
1.2.7 最佳溶氧量的确定
取出发菌株活化,然后取一环接入种子培养基中培养,24 h后分别取 1 mL培养液,接入已优化碳源、氮源和 pH值的产酶培养基中培养,产酶培养基的装液量分别为 10 mL、15 mL、20 mL、25 mL、30 mL,37℃下培养 48 h,分别离心收集粗酶液,测定其淀粉酶活力,根据所测定的结果确定最佳溶氧量.
1.2.8 最佳产酶时间的确定
取出发菌株活化,然后取一环接入种子培养基中培养,24 h后分别取 1 mL培养液,接入已优化碳源、氮源和 pH值的产酶培养基中培养,分别于 0 h,12 h,24 h,36 h,48 h,60 h取样,测定发酵液的酶活力,根据所测定的结果确定最佳产酶时间.
1.2.9 离子对产酶的影响
通过向培养基中添加质量分数为 0.05%的MgSO4、质量分数为0.05%的CaCl2和质量分数为 0.005%的 FeSO4等不同离子进行产酶实验,培养 48 h,测定酶活力,根据测定结果确定最适添加的离子.
1.2.10 酶反应最适 pH值的确定
分别用 pH值为 4.0、5.0、6.0、7.0、8.0、9.0的缓冲溶液配制可溶性淀粉液,将在最适条件下培养获得的粗酶液分别在以上各种 pH值条件下测定其淀粉酶活力,根据所测得的结果确定淀粉酶反应的最适 pH值.
1.2.11 酶反应最适温度的确定
将在最适条件下培养获得的粗酶液分别在27℃、32℃、37℃、42℃、47℃、52℃等各种不同温度下测定淀粉酶活力,根据所测得的结果确定淀粉酶反应的最适温度.
2 实验结果
2.1 初筛结果
土样经稀释并在淀粉培养基平板上培养后,共挑选出 24株能水解淀粉的细菌,分别将 24株细菌接种到斜面培养基上,编号为 B1~B24,菌株产生水解圈的情况如图 1所示.

图 1 淀粉酶产生菌产生的淀粉水解圈Fig.1 Hydrolysis circle of starch produced by a strain which can produce amylase
2.2 复筛结果
将所有初筛得到的菌种分别点种到淀粉培养基平板上进行培养,待菌落长成后向菌落上滴加碘液,比较淀粉水解圈大小,挑取d0/d1(d0为水解圈直径,d1为菌落直径)较大的 5株菌株连续进行 3次平板点种培养,最终选取d0/d1值最大的菌株B5作为本实验出发菌株.将 B5菌株接多支斜面,经培养后于低温保存.复筛结果见表1.

表1 复筛结果Table 1 Results of re-screening
2.3菌株产酶条件的优化
发酵过程中影响菌株生长、产酶的主要因素为:碳源、氮源、发酵培养基的初始 pH值、发酵温度、溶氧量、金属离子及产酶时间.对上述因素进行全面考察,以确定菌株的最佳产酶条件.
2.3.1 碳源对细菌B5产酶能力的影响
分别在 5种含不同碳源的发酵培养基中培养细菌B5,37℃摇床培养 48 h.经过对发酵液中淀粉酶活力的测定,可知碳源为质量分数为2.0%的淀粉时细菌 B5产酶活力最高,测定结果见图 2.

图 2 碳源对细菌B5产酶的影响Fig.2 The impact of carbon source on Bacterium B5 in producing amylase
2.3.2 氮源对细菌B5产酶能力的影响
分别在含 5种不同氮源的发酵培养基中培养细菌B5,37℃摇床培养 48 h.经过对发酵液中淀粉酶活力的测定,可知氮源为质量分数0.5%酵母膏 +质量分数 0.5%蛋白胨时细菌B5产酶活力最高,测定结果见图 3.

图 3 氮源对菌株B5产酶能力的影响Fig.3 The impact of nitrogen source on Bacterium B5 in producing amylase
2.3.3 培养基初始 pH值对菌株 B5产酶能力的影响
将碳源和氮源已优化的产酶培养基 pH值分别调为 5.0,6.0,7.0,8.0,9.0,接种 B5后 37℃下培养 48 h,测定不同 pH值下淀粉酶活力,结果见图 4,根据所测定的结果确定最佳培养基的初始 pH值为 6.0.

图 4 培养基初始 pH值对菌株B5产酶能力的影响Fig.4 The impact of initial pH on Bacterium B5 in producing amylase
2.3.4 培养温度对菌株B5产酶能力的影响
将出发菌株 B5分别在 5种不同温度下进行培养,48 h后离心收集粗酶液,测定淀粉酶活力,结果见图 5.由图 5结果可以看出,37℃培养时菌株B5产酶能力最强.
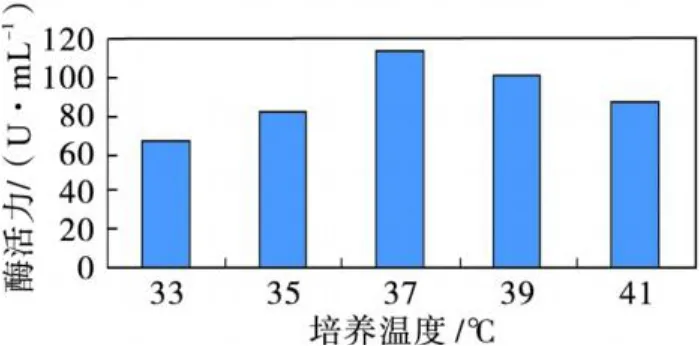
图 5 培养温度对菌株B5产酶能力的影响Fig.5 The impact of culture temperature on Bacterium B5 in producing amylase
2.3.5 溶氧量对菌株B5产酶能力的影响
将菌株B5在不同溶氧情况下进行培养,48 h后离心收集粗酶液,测定淀粉酶活力,结果见图 6.由图 6可以看出,50 mL摇瓶中装液量为15 mL时为最佳溶氧量.

图 6 溶氧对菌株B5产酶能力的影响Fig.6 The impact of dissolved oxygen on Bacterium B5 in producing amylase
2.3.6 最佳产酶时间的确定
菌株B5在发酵培养基中开始培养后,在不同时间点取样测定酶活力,结果如图 7所示.由图 7可见以看出,菌株B5的最佳产酶时间是 48 h.

图 7 菌株B5淀粉酶最佳产生时间的确定结果Fig.7 The determination of optimal time in producing amylase byBacterium B5
2.3.7 离子对产酶的影响
Mg2+、Ca2+、Fe2+是很多种酶的激活剂并且可以提高酶活力,为测定这几种离子对菌株 B5所产淀粉酶是否有提高酶活力的作用,向培养基中单一或混合添加几种离子进行发酵产酶实验,酶活测定结果见图 8.由图 8可以看出,同时添加 3种离子对菌株B5产酶能力有较大的影响.
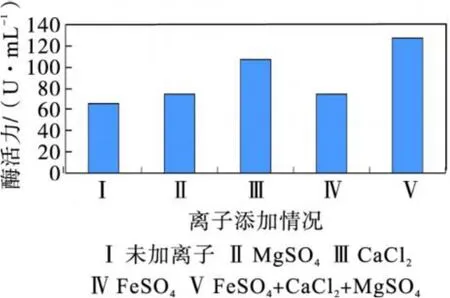
图 8 离子对菌株B5产酶的影响Fig.8 The impact of ion on Bacterium B5 in producing amylase
2.4 菌株B5所产淀粉酶酶学性质的研究
2.4.1 酶反应最适 pH值的确定
分别用不同 pH值的缓冲溶液配制可溶性淀粉液,测定淀粉酶活力,结果见图 9.

图 9 酶反应最适pH值的确定结果Fig.9 The deter mination of opt imal reaction pH of amylase
由图 9可以看出,pH值为 5.0时淀粉酶活力最强.
2.4.2 酶反应最适温度的确定
分别在各种不同温度下测定菌株 B5所产淀粉酶的酶活力,结果见图 10.由图 10可以看出,在 42℃时酶活力最强,此时酶活力可达158.9 U/mL.

图 10 酶反应最适温度的测定结果Fig.10 The determination of optimal reaction temperature of amylase
在最适条件下菌株 B5所产淀粉酶活力从最初的 92.6 U/mL提高到 158.9 U/mL,酶活力提高效果明显.
3 结 论
实验中筛选出的细菌 B5具有产淀粉酶的能力,菌株产酶能力通常会受到菌株培养时碳源、氮源、培养基初始 pH值、培养温度、溶氧、离子等许多因素的影响,另外菌株所产酶的活力也会受到酶发挥作用时最适温度和最适 pH值的影响.综合考察以上各种影响因素对酶活力的影响后,确定菌株B5产淀粉酶的最适培养条件以及淀粉酶发挥作用时的最适条件.以淀粉厂附近土样为原料,通过淀粉水解圈筛选模型筛选得到一株产淀粉酶活力较强的细菌B5.通过对B5产酶条件的考察得出:培养基中最佳碳源为质量分数2%的淀粉,最佳氮源为质量分数 0.5%的酵母膏加质量分数0.5%的蛋白胨,最适初始pH值为 6.0,最适培养温度为 37℃,最适溶氧量为 50 mL摇瓶装 15 mL培养基,最佳产酶时间是 48 h,培养基中同时补充质量分数 0.05%的MgSO4、质量分数 0.05%的 CaCl2和质量分数0.005%的FeSO4时可大幅提高酶活力.该淀粉酶最适反应温度为 42℃,最适反应 pH值为 5.0.菌株B5液体发酵产酶活力最高可达 158.9 U/mL,该菌株如果再进一步进行诱变处理酶活力还有提升空间.本实验方法简便、直观,可快速、高效地筛选出淀粉酶产生菌.
[1] 谷军.α-淀粉酶的生产与应用 [J].生物技术, 1994,4(3):1-5.
[2] 白坤,于德贵,周冬颖.α-淀粉酶的性质及其液化作用[J].中国酿造,1995(5):1-5.
[3] 张强,刘成君,蒋芳,等.耐高温α-淀粉酶产生菌的分离鉴定及发酵条件与酶性质研究[J].食品与发酵工业,2005,31(2):34-37.
[4] 罗志刚,杨景峰,罗发兴.α-淀粉酶的性质及应用[J].食品研究与研发,2007,28(8):1-18.
[5] 张丽苹,徐岩,金建中.酸性α-淀粉酶的研究与应用[J].酿酒,2002,29(3):4-15.
[6] Shoji H,Sug im oto T,Hosoi K,et al. S im ultaneous Production of G lucoam ylase and A cid Stableα-amylase U sing Novel Subm erged Culture of Aspergillus Kawachii NBRC4308[J].Journal of B ioscience and B ioengineering,2007,103(2):203-205.
[7] N agam ine K,M urashim a K,Kato T,et al.M ode of α-am ylase Production by the Shochu KojiM old Aspergillus Kawachii[J].B ioscience,B iotechnology and B iochem istry,2003,67(10):2194-2202.
[8] Sivaram akrishnan S,Gangadharan D,Nampoothiri K M,et al.α-Am ylase from M icrobial Sources——A n O verview on Recent Developm ents[J].Food Technol B iotechnol,2006,44(2):173-184.
[9] 沈萍.微生物学 [M].2版.北京:高等教育出版社,2002:63-65.
Screening ofBacterium Producing Amylase from the Soil and Opt im ization of the Condition for Enzyme Production
LEI Xiao-yan
(Shenyang U niversity of Chem ical Technology,Shenyang110142,China)
In order to screen a bacterium w hich can produce am ylase,starch hydrolysis circle is used in this experim ent as a screening m odel.The Strain B5is achieved by screening from the soil near the starch factory.A fter the optim ization of the condition,the capability of B5is improved.The optim al condition is: carbon source is starch2.0%;nitrogen source is yeast extract0.5%and peptone0.5%;the initial pH is 6.0;and the optim um incubation temperature is37℃;the appropriate load is15mL culture m edium in 50mL flask;the opt im al tim e for producing am ylase is48h;w hen0.05%M gSO4,0.05%CaC l2,and 0.005%FeSO4is added to the m edium,the am ylase activity can be improved greatly.The am ylase activity of Strain B5in liquid ferm entation can reach as high as158.89U/mL.The optim al reaction temperature of am ylase is42℃,and the optim um reaction pH of am ylase is5.0.The exper im entalm ethod is simple and intuitive,and can be used to screen am ylase-producing strain quickly and efficiently.
am ylase; hydrolysis circle; enzym e activity
Q939.9
A
1004-4639(2010)03-0203-06
2009-02-09
雷晓燕(1972-),女,陕西绥德人,讲师,硕士,主要从事生物技术教学和科研工作.

