煤系高岭土合成NaA分子筛及其机理分析
周志辉,吕振华,刘 红,杨建华,王金渠
(1.武汉科技大学资源与环境工程学院,湖北武汉,430081; 2.大连理工大学精细化工国家重点实验室,辽宁大连,116012)
煤系高岭土合成NaA分子筛及其机理分析
周志辉1,吕振华1,刘 红1,杨建华2,王金渠2
(1.武汉科技大学资源与环境工程学院,湖北武汉,430081; 2.大连理工大学精细化工国家重点实验室,辽宁大连,116012)
以煅烧煤系高岭土为原料,采用氢氧化钠溶液水热合成制备NaA分子筛。以NaA分子筛晶体的生长过程为基础,利用XRD、SEM对NaA分子筛晶体生长规律进行表征,并对其结晶机理进行了分析。结果表明,煤系高岭土制备NaA分子筛的最佳工艺条件是:煅烧温度为725℃;配料比m(Na2O)/m(SiO2)为 3, m(H2O)/m(Na2O)为40;胶化条件为70℃×2 h;晶化条件为100℃×6 h。所制NaA分子筛的钙离子交换量为316.55 g CaCO3/g。在NaA分子筛的碱液合成过程中,在晶化条件下,凝胶固相中的硅铝酸根骨架解聚重排晶化成沸石晶体骨架。
高岭土;NaA分子筛;水热合成;钙离子交换量;晶化机理
我国大型煤矿基本上都伴生有煤系高岭土,据初步统计,煤系高岭土在我国储量高达60亿t[1-2]。高岭土是一种天然非金属矿,亦是采煤过程中的剔除废弃物,其含量为原煤产量的10%~20%,已被列入当今世界主要工业固体废物之一。近年来,NaA分子筛在石油、化工、冶金、电子技术、医疗卫生等领域有着广泛的应用,尤其是在合成洗涤剂领域日益受到人们的重视,且需求量也不断增加。高岭土是合成NaA分子筛的天然矿物原料[3-8],对采煤废弃物进行煅烧或改性具有重要的资源再利用价值。由于高岭土的 m(Si)/ m(A l)比值与NaA分子筛的 m(Si)/m(A l)比值相同,反应时不需添加硅、铝源,且矿物原料来源丰富,因此在矿物合成NaA沸石中高岭土占有重要的地位。
NaA分子筛的化学组成为Na96[(A lO2)96· (SiO2)96]·216H2O,属于含水架状铝硅酸盐类矿物,其内部结构呈三维排列的硅(铝)氧四面体分布,彼此连接形成规则的孔道。这些孔道具有筛选分子的效应,其直径为0.41 nm。由于孔道有大量的均匀微孔,其结构中还存在强电场,因此孔道具有较强的离子交换能力。然而,由于在工业上利用传统化工原料合成NaA分子筛的成本较高,给其推广使用带来一定的困难,因此选择廉价矿物原料高岭土制备NaA分子筛成为目前推广NaA分子筛应用的重要环节。为此,本文以煅烧煤系高岭土为原料,采用氢氧化钠溶液水热合成制备NaA分子筛,研究煅烧温度、原料配比、胶化温度和晶化时间对合成NaA分子筛性能的影响,并对其结晶机理进行了分析,以期为煤系高岭土用于工业生产NaA分子筛提供实验依据。
1 实验
1.1 实验原料和试剂
实验所用原料取自我国内蒙古地区的粉状煤系高岭土(325目),外观呈浅红色,其化学成分如表1所示。实验所用试剂为氢氧化钠、氯化钙、氧化锌、乙二胺四乙酸二钠等,以上均为分析纯。

表1 煤系高岭土化学成分(wB/%)Table 1 Chem ical compositions of coal series kaolin ite
1.2 实验方法及表征
在一定温控程序下将煤系高岭土放入马弗炉中进行煅烧处理,然后与定量NaOH在水中混合搅拌,待室温陈化12 h后,置入烘箱内分别在不同温度下胶化和晶化,用去离子水将产物洗至中性,在45℃下干燥获得样品分子筛。采用D/ MAX-ⅢA X射线衍射仪(Cu Kα衍射)和KYKY-2800B扫描电子显微镜对样品分子筛进行分析与表征,并分别测定样品分子筛的钙离子交换量[9]和静态水吸附量[10]。本研究所计算的相对结晶度标准为:实验条件下合成分子筛的XRD图中所有峰强度之和与以下操作条件下合成分子筛的XRD图所有峰强度之和的比值,具体的合成条件为m(H2O)/m(Na2O)=35, m(Na2O)/m(SiO2)=3,陈化时间为12 h,胶化温度为70℃,晶化温度为100℃,晶化时间为6 h。
2 结果与讨论
2.1 煅烧温度对NaA分子筛性能的影响
高岭土是由高岭土类矿物组成的一种重要的黏土,通常以高纯度的高岭石存在于自然界中,其高岭石的含量在95%以上,天然高岭土中常含有少量二氧化钛、氧化铁和碱金属氧化物等杂质[1]。高岭土的晶体结构经过煅烧转变为几乎没有晶体结构活性的偏高岭土。
高岭土在50~1 000℃的氧化煅烧过程可分为4个部分[2]:①低于100℃:低温脱除表面和孔中的吸附水;②100~400℃:八面体层的结构重整和表面羟基发生预脱水过程产生的质量损失;③400~650℃:高岭土脱羟基作用和偏高岭土的形成:

其中:x值很小(偏高岭土中残留10%的羟基团);④650~950℃:偏高岭土的分解基于以下化学反应:

为获得晶体结构活性较高的偏高岭土,在700~900℃对煤系高岭土进行煅烧得到偏高岭土 ,煅烧时间均为2 h,在相同的实验条件(m(Na2O)/m(SiO2)为1,m(H2O)/m(Na2O)为60,胶化温度为70℃,胶化时间为2 h,晶化温度为100℃,晶化时间为10 h)下合成了NaA分子筛。图1为高岭土、偏高岭土和样品分子筛的XRD谱图。由图1可看出,煅烧产物偏高岭土基本上没有晶体结构特征,样品NaA分子筛的特征峰非常明显,表明合成的NaA分子筛具有较高的结晶度。

图1 高岭土、偏高岭土和样品分子筛的XRD谱图Fig.1 XRD patterns of the kaolin,metakaolin and NaA zeolite
图2为煅烧温度对NaA分子筛性能的影响。由图2可看出,在725℃煅烧高岭土制得NaA分子筛相对结晶度最高,其对应的钙离子交换量为316.55 g CaCO3/g,静态水吸附量达到28.03%。由此可见,实验所用煤系高岭土的最佳煅烧温度为725℃。

图2 煅烧温度对NaA分子筛性能的影响Fig.2 Effect of calcin ing tem perature on the properties of NaA zeolite
2.2 原料配比对NaA分子筛性能的影响
由于高岭土是硅、铝源为一体的NaA分子筛合成原料,所以钠硅比值的增大和碱度比值的减小,也就是相同体积合成液中高岭土含量的减少和OH-浓度的增多。为了在相同操作条件下用高岭土产出更多的NaA分子筛,应尽量在不影响分子筛性能的条件下使钠硅比值尽量减小。另外,出于安全的需要,实验用水热合成釜也要求合成液的OH-浓度尽量低。
图3为不同钠硅比值和碱度原料所制分子筛相对结晶度随晶化时间的变化。由图3(a)可看出,NaA分子筛相对结晶度在晶化2~4 h期间随着钠硅比值的增大而减小,当晶化时间继续延长5~8 h,m(Na2O)/m(SiO2)为3时,此时分子筛的结晶度最高。由此可见,晶化初期较小的钠硅比值有利于NaA晶体的生长,要想取得较大的结晶度还得需要较大的钠硅比值。在钠硅比值m(Na2O)/m(SiO2)为3,原料碱度比值m(H2O)/m(Na2O)为45时,此时的相对结晶度达到最大值0.8746。因此选取钠硅比值m(Na2O)/m(SiO2)为3的原料合成NaA分子筛效果最好。由图3 (b)可看出,原料碱度比值 m(H2O)/m(Na2O)为35时,分子筛相对结晶度随着晶化时间的变化不大。在晶化初期3 h时,其结晶度为0.911 9,随着晶化时间的延长,分子筛相对结晶度略有下降, 8 h时结晶度降至0.8435。原料碱度比值m(H2O)/ m(Na2O)为40时,分子筛相对结晶度随着晶化时间的延长略有上升。原料碱度比值 m(H2O)/ m(Na2O)为45时,分子筛相对结晶度从晶化初期2 h时的0.119 3,逐渐上升到8 h时的0.874 6。在原料碱度比值 m(H2O)/m(Na2O)分别为35、40、45时,分子筛相对结晶度最大值分别为0.911、0.909、0.874,这表明原料碱度 m(H2O)/ m(Na2O)比值越小、OH-浓度越高,高岭土在水中的溶解度越大,溶液中硅酸根与铝酸根离子间聚合成胶与胶溶速度均加快,这样诱导期和成核时间均缩短,从而加快晶化速度。另外,原料碱浓度上升时造成硅铝缩聚反应增大,成核速度加快。

图3 原料钠硅比值和碱度对分子筛相对结晶度的影响Fig.3 Effect of H2O/Na2O and Na2O/SiO2ratio of kaolinite on relative crystalin ity of NaA zeolite
2.3 胶化温度和胶化时间对NaA分子筛性能的影响
图4为胶化温度和胶化时间对NaA分子筛性能的影响。由图4(a)可看出,晶化前期在50℃条件下胶化得到的合成液较早开始晶化,晶化4 h前胶化温度为50℃更有利于提高晶化速度, 4 h后胶化温度为70℃更有利于晶化。由图4 (b)可看出,胶化时间从2 h延至3 h,NaA分子筛在整个晶化过程中的结晶度均得到提高。晶化时间越长,高胶化温度和长胶化时间的优越性更加明显。由此可见,温度对于NaA分子筛晶化过程的影响不容忽视,温度升高促进了高岭土固相溶解及液相浓度增加,液相在较短时间内就达到成核所需要的浓度,从而加速生成晶核,生成分子筛晶体。所以提高温度不仅缩短了诱导期,而且还提高了NaA分子筛的成核速度,缩短其成核期时间。
由于最高结晶度的胶化温度一般出现在50~70℃,根据本实验的实验结果选择了最佳胶化温度为70℃。胶化时间选择3 h时会出现整个分子筛合成流程的延长,所以本实验选择的胶化时间为2 h。

图4 胶化温度和胶化时间对NaA分子筛性能的影响Fig.4 Effect of colloidization temperature and time on the properties of NaA zeolite
2.4 晶化时间对NaA分子筛的影响
晶化时间的长短不仅影响NaA分子筛的结晶度和晶体数量,而且对NaA分子筛的晶体形态和晶体大小也有影响。图5为晶化时间对NaA分子筛性能的影响,实验条件如下:m(Na2O)/ m(SiO2)为2.5;m(H2O)/m(Na2O)为40;胶化温度为70℃;胶化时间为2 h;晶化温度为100℃。由图5可看出,随着晶化时间的延长,相对结晶度逐渐升高,在晶化时间为6 h时,最大结晶度达到1。图6为不同晶化时间下所制NaA分子筛的XRD谱图。由图6可看出,晶化时间为2 h时,XRD图谱出现了NaA晶体微弱的特征衍射峰。

图5 晶化时间对NaA分子筛性能的影响Fig.5 Effect of crystallization time on the properties of NaA zeolite
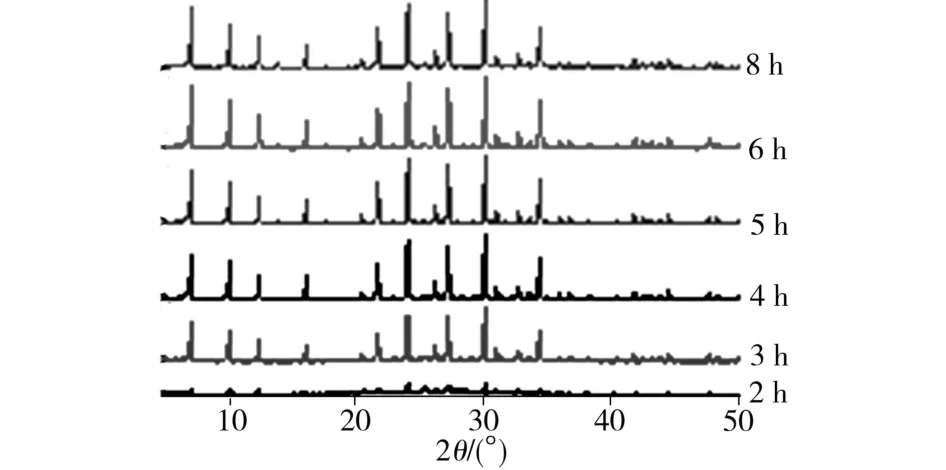
图6 不同晶化时间所制分子筛XRD谱图Fig.6 XRD patterns of NaA zeolite at different crystallization times

图7 NaA分子筛的SEM照片Fig.7 SEM images of NaA zeolite at different crystallization times
图7为不同晶化时间所制NaA分子筛SEM照片。由图7(a)~图7(d)可看出,晶化3 h时已有棱长约为3μm的NaA晶体出现,随着晶化时间的延长,分子筛的亮度逐渐增大,在6 h时分子筛晶化完全,在图6中亦可看出十分明显的分子筛特征峰。由图7(e)可看出,样品已有半球状孪晶体出现。到晶化后期8 h时,NaA分子筛的相对结晶度有所下降,对应的XRD特征峰有所削弱(见图6)。由图7(f)可看出,此时原本立方晶系NaA分子筛晶体正在转变为热力学上更为稳定的“球”状孪晶体,经测定分子筛钙离子交换量和静态吸水量也相应下降。
由于高岭土是硅、铝源于一体的NaA型沸石原料,在陈化过程中,高岭土在OH-作用下溶解成胶,形成了很多间隔较近的晶核,此晶化过程为重力作用下的静态合成,晶核在生长过程中间隔越来越近,堆积在合成釜的底部。这样营养输送给晶核的过程受阻,晶核的生长需要竞相吸收营养,从而导致各个晶核孪生生长。黄焱球等[11]研究表明,孪晶是由于晶化时间的延长而引起的二次成核,虽然可以解释水热合成过程中分子筛微晶形貌变化现象,但随着晶化时间的延长,原本在晶化到5 h晶型就很好的棱长(3μm)立方型晶体,却在晶化到6 h时逐渐转变直径为6~7μm的孪晶球体。我们在高岭土微波合成NaA分子筛的过程中,也发现晶化初期就出现直径约为2 μm的小孪晶球体。由图7可看出,高岭土合成NaA分子筛在相对结晶度、静态水吸附量、钙离子交换量等方面都很优异时还是以孪晶的形式存在的,这与原料高岭土的粒度有很大关系。从NaA型分子筛的晶粒形成和晶体生长情况来看,偏高岭土的粒度越小,越有利于沸石晶体的生成。因为粒度越小溶解时,偏高岭土与氢氧化钠溶解接触的界面越大,越有利于它的溶解,这样成胶期和成核期都会缩短。孪晶的产生在一定程度上改变了晶体的形态,也使晶体的粒度增大。
2.5 高岭土合成NaA分子筛机理分析
偏高岭土和氢氧化钠溶液合成NaA分子筛是一个非均质的固液反应体系,反应过程比较复杂。煅烧高岭土与氢氧化钠溶液混合后,偏高岭土在OH-作用下逐渐溶解,形成硅酸根和铝酸根,并相互交联形成硅铝酸根及硅铝酸盐溶胶。图8为不同晶化时间所制NaA分子筛的 IR谱图。由图8可看出,偏高岭土中的460 cm-1和1 000~1 200 cm-1处强吸收带表明硅氧四面体SiO4中Si—O键的振动,而随着晶化过程的进行,3 h时500~650 cm-1谱带强度逐渐增大,在 550 cm 处有较强的吸收峰,而550 cm 处被归属为A型沸石双四元环的特征振动[12],NaA分子筛的基本骨架开始形成,此谱带强度随着时间的延续逐步增强,表明NaA型分子筛结晶趋于完整。
从水热合成过程中偏高岭土的变化和NaA分子筛晶体的生长特征来看,NaA分子筛是基于原料高岭土的颗粒大小而成核及生长的,偏高岭土溶解产生的硅酸根和铝酸根在颗粒周围,经过陈化聚合,在晶化条件下,凝胶固相中的硅铝酸根骨架解聚重排晶化成沸石晶体骨架的成核。

图8 不同晶化时间所制NaA分子筛的IR谱图Fig.8 IR spectra of NaA zeolite prepared at different crystallization times
3 结论
(1)煤系高岭土合成NaA分子筛的最佳工艺条件是:煅烧温度为725℃;配料比m(Na2O)/ m(SiO2)为3,m(H2O)/m(Na2O)为40;胶化条件为70℃×2 h;晶化条件为100℃×6 h。
(2)煤系高岭土合成NaA分子筛的钙离子交换量为316.55g CaCO3/g,静态水吸附量为28.03%。
(3)在NaA分子筛的碱液合成过程中,偏高岭土溶解产生的硅酸根和铝酸根陈化聚合成硅铝水凝胶后,在晶化条件下,凝胶固相中的硅铝酸根骨架解聚重排晶化成沸石晶体骨架的成核。NaA分子筛颗粒基于原料高岭土的颗粒大小,是在液相的作用下成核生长的。
[1] 陈晶,孙德坤,董少春.微波法煅烧高岭土及合成洗涤助剂4A沸石[J].无机化学学报,2000,16(5): 769-774.
[2] Honghai L,Jiantai M,Xionghou G,et al,Characterization and evaluation of a novel resid FCC catalyst based on in-situ synthesis on kaolin microspheres[J].Catalysis Letters,2006,110:229-234.
[3] 中国科学院大连化学物理研究所分子筛组.沸石分子筛[M].北京:科学出版社,1978:32-35.
[4] M intova S,Olson N H,Valtchev V,Mechanism of zeolite A nanocrystal grow th from colloids at room temperature[J].Science,1999,283:958-960.
[5] Slangen PM,Jansen J C,Bekkum H V,The effect of ageing on themicrowave synthesisof zeolite NaA [J].M icroporous Materials,1997,9:259-265.
[6] M iao Q,Zhou Z,Yang J,et al.Synthesis of NaA zeolite f rom kaolin source[J],Front Chem Eng China,2009(3):8-11
[7] Sathy C,Pramada P N.Kaolin-based zeolite Y,a p recurso r fo r cordierite ceramics[J].App lied Clay Science,2004,27:187-198.
[8] Marce I,M ignoni L,Diego IP,et al,Synthesis of mordenite using kaolin as Si and Al source[J].App lied Clay Science,2008,41:99-104.
[9] QB/T 1768—2003,洗涤剂用4A沸石[S].
[10]GB 6287—86,分子筛静态水吸附测定方法[S].
[11]黄焱球,程守田,高广立.“偏高岭石-碱-水”体系中4A沸石晶体生长规律及其机理探讨[J].矿物岩石, 1997,67(17):17-22.
[12]Rocha J,Klinow ski J,Adam s JM.Synthesisof zeolite 4A from metakaolinite[J]JChem.Soc Faraday Trans,1991,87(18):3 091-3 097.
Syn thesis of NaA zeolite from kaolin and its crystallization mechan ism
Zhou Zhihui1,Lu Zhenhua1,L iu Hong1,Yang Jianhua1,W ang Jinqu2
(1.College of Resources and Environmental Engineering,Wuhan University of Science and Technology,Wuhan 430081,China;2.State Key Laborato ry of Fine Chemicals,Dalian University of Technology,Dalian 116012,China)
NaA zeolite was successfully synthesized w ith hydrothermal method from calcined kaolin used as sources for bo th silica and alum ina.The grow th of NaA zeolite w as studied by XRD and SEM, and the crystallization p rocess of NaA zeolite in the hydrothermal reaction system was analyzed.The op timal synthesis conditions were found to be as follow s:m(Na2O)/m(SiO2)=3;m (H2O)/m(Na2O)=40;the calcining temperature is 730℃;the temperature and time in the gel formation stage are 70℃and 3 h;and the temperature and time in the crystallization stage are 100℃and 6 h,respectively.Kaolin is suggested to be a feasible and economical raw material for p ractical industrial p roduction of NaA zeolite.
kaolin;NaA zeolite;hydrothermal synthesis;calcium ion exchange;crystallization mechanism
TQ424.25
A
1674-3644(2010)06-0614-06
[责任编辑 徐前进]
2010-06-04
武汉科技大学绿色制造与节能减排科技研究中心开放基金资助项目(B0917).
周志辉(1980-),男,武汉科技大学讲师,博士.E-mail:huihui120980@hotmail.com

