酪蛋白糖巨肽对小鼠肠道免疫系统的影响
李 伟,陈庆森*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
酪蛋白糖巨肽对小鼠肠道免疫系统的影响
李 伟,陈庆森*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
研究酪蛋白糖巨肽(CGMP)对正常小鼠肠相关淋巴组织的免疫应答反应的影响,对阐述CGMP的生物学功能具有重要意义。本实验将BALB/c雌性小鼠28只随机分为4组,每组7只,分别为0.9%生理盐水对照组(0.2mL/d),低、中、高3种剂量组(30、120、300μg/d)。连续灌胃16d后,取脾脏、PP结(peyer's patches)和肠系膜淋巴结(mesenteric lymph node,MLN),制备细胞悬液,进行三色荧光标记后,用流式细胞仪检测CD3+、CD3+CD4+和CD3+CD8+T淋巴细胞亚群的变化。结果表明:CGMP各剂量组均能够促进脾脏和PP结中CD3+和CD3+CD4+细胞的显著增加(P<0.05),高剂量能引起脾脏CD3+CD8+淋巴细胞的显著增多(P<0.05),低剂量能引起脾脏CD3+CD4+/ CD3+CD8+的显著增加(P<0.05);低剂量CGMP能使MLN中CD3+CD8+淋巴细胞显著增减少(P<0.01)。研究证实长期灌胃CGMP会诱导肠黏膜产生获得性的免疫应答,并且不会引起机体产生口服耐受。
酪蛋白糖巨肽;T淋巴细胞亚群;肠系膜淋巴结;PP结;脾脏
Abstract :In order to explore the effect of casein-glycomacropeptide (CGMP) on the intestinal mucosal immune response in normal mice, 28 female BALB/c mice were randomly divided into 4 groups for 7 mice in each group and by gavage given physiological saline (as control group) or CGMP at dosages of 30, 120μg/d and 300μg/d (low-, medium- and high-dosage groups)for 16 consecutive days. After treatment, all the mice were sacrificed and their spleen, peyer's patches and mesenteric lymph node (MLN) were collected to examine the change of CD3+, CD3+CD4+ and CD3+CD8+T lymphocytes subpopulations using flow cytometry. The results indicated that CGMP resulted in a significant increase in CD3+ and CD3+CD4+ lymphocytes in spleen and peyer's patches (P<0.05) in a dosage-dependent manner. Compared with the control group, high-dosage CGMP administration resulted in a higher percentage of CD3+CD8+ lymphocytes in spleen(P<0.05), and low-dosage CGMP administration made the CD3+CD4+/CD3+CD8+ ratio significantly (P<0.05) increase but the percentage of CD3+CD8+lymphocytes in MLN significantly decrease (P<0.01). The above results demonstrate that long-term gastric perfusion of CGMP can induce intestinal mucosal adaptive immune response without tolerance to its oral administration.
Key words:CGMP;T lymphocyte subgroup;MLN;peyer's patch;spleen
众多的研究证实,在正常机体内各淋巴细胞亚群相互作用,维持着机体正常免疫功能。T淋巴细胞是机体免疫系统内功能最重要的一群细胞,当不同淋巴细胞亚群的数量和功能发生异常时,可导致机体免疫功能紊乱并发生一系列病理变化。Gautreaux等[1]研究发现当去除肠系膜淋巴结、固有层和上皮内的CD4+和CD8+淋巴细胞后,会引起肠道菌群的移位,这反映了淋巴细胞亚群对于维持肠道微生态区系具有重要作用。腹泻、肠易激综合征和炎症性肠病等肠道疾病都与肠黏膜屏障受损有关[2]。人体胃肠黏膜表面积有200~300m2,通过不断对肠道内的营养物质、食物抗原、病原微生物和益生菌做出相应的免疫应答来维持机体的免疫平衡状态,大量的研究表明合理的饮食使肠道免疫功能处于最佳状态[3]。营养物质不仅仅维持着机体的正常生长需要,而且通过肠道调节机体的免疫状态方面的研究已经越来越引起人们的关注[4]。因此,寻找并研究一些食源性生物活性物质,促进机体内淋巴细胞亚群的平衡,维持机体正常的免疫功能以及新药的研制具有重要价值。
酪蛋白糖巨肽(casein-glycomacropeptide,CGMP)是κ-酪蛋白经凝乳酶和胃蛋白酶酶解后形成的含有64个氨基酸的不同种类的肽段[5]。CGMP富含支链氨基酸,蛋氨酸含量较低,不含苯丙氨酸,因此可以作为肝病患者和苯丙酮尿病患者的特定食品[6]。另外,它还具有多种生物学活性:1)促进双歧杆菌的增殖,抑制细菌和病毒的黏附[7];2)调节免疫反应;3)抑制胃肠道分泌[8]。国内外研究报道显示,CGMP可以作为改善肠道微生态区系的活性物质。目前,CGMP作为功能性食品添加剂引起了科研工作者的兴趣,特别是关于灌胃CGMP后的免疫性研究越来越重要。Ledoux等[9]通过用GMP皮下免疫兔子,能够在血液中检测到抗GMP抗体,说明GMP通过皮下注射可以引起机体产生特异性的免疫应答。但是,Mikkelsen等[10]发现小鼠饲喂GMP后,并不能够从血液中检测到抗GMP抗体。本实验通过对BALB/c小鼠灌胃不同剂量的CGMP,用流式细胞仪检测外周免疫器官,特别是肠相关淋巴组织中的T淋巴细胞亚群的变化,来探讨CGMP对肠黏膜免疫应答的影响。
1 材料与方法
1.1 材料与试剂
6周龄BALB/c雌性小鼠28只,SPF级,体质量19~23g,由中国人民解放军军事医学科学院实验动物中心提供; CGMP纯品(澳大利亚原产) 上海统园食品技术有限公司。
CD3-FITC(NO:555274)、CD4-Percp(NO:553052)、CD8α-PE(NO:553032)、CD3-FITC (NO:555274)、PE Rat IgG2a,κ同型对照(NO:553930)、FITC Rat IgG2b,κ同型对照(NO:553988)、PerCP Rat IgG2a,κ同型对照(NO:553933)、10×溶血素(NO:349202) BD公司。
1.2 仪器与设备
FACSCalibur流式细胞仪 Becton Dickinson公司;LD5-10型离心机 北京医用离心机厂;XW-80A漩涡混合仪 上海沪西分析仪器厂有限公司
1.3 方法
1.3.1 实验动物分组
将小鼠随机分为4组,每组7只,分别为0.9%生理盐水对照组,低、中、高3种剂量组。预饲2周后进行实验。按表1分别对各组进行灌胃,连续灌胃16d。各组小鼠自由饮食、饮水。

表1 实验分组(n=7)Table 1 Grouping of mice in this study
1.3.2 样本采集
连续灌胃16d后,断颈处死小鼠后,无菌操作解剖小鼠,剪取脾脏和肠系膜淋巴结,并剥离MLN上附带的脂肪组织,分别放入盛有10%胎牛血清的PBS溶液的冻存管中。从胃下3cm处至回盲部剪断小肠,将小肠与肠系膜剥离后放入分别盛有10%胎牛血清的PBS溶液的培养皿中,用眼科剪剪取小肠表面肉眼可见的PP结,放入盛有10%胎牛血清的PBS溶液的冻存管中。将取得的样本放入4℃冰箱保存,24h内制备细胞悬液。
1.3.3 细胞悬液的制备
脾脏细胞悬液的制备:参考文献[11]进行。将脾脏放于325目的标准筛网上,先用眼科剪将脾脏剪碎,用注射器芯轻轻挤压组织,用2mL 含5%胎牛血清的PBS液冲洗,用离心管接住所得冲洗液;将冲洗液通过325目的筛网滤去细胞团,经过1200r/min离心5min后,弃上清,加入1×溶血素1mL,静置8min,待红细胞完全破裂,溶液变得透亮后,加入1mL PBS,1200r/min离心5min,弃上清,加入0.5mL PBS,调整细胞浓度为107个/mL。用0.4%的台盼蓝溶液检测细胞的活率达到95%以上。
PP结和MLN细胞悬液的制备:参考文献[12]进行。用镊子将MLN从5%胎牛血清的PBS溶液中取出,放于325目的标准筛网上,先用镊子将MLN表面的脂肪剥离,用注射器芯轻轻挤压组织,用2mL含5%胎牛血清的PBS液冲洗,用离心管接住所得冲洗液;1200r/min离心,5min,后,弃上清,加入2mL PBS,重复以上步骤两次,通过325目的标准筛过滤后,调整细胞浓度为107个/mL。用0.4%的台盼蓝溶液检测细胞的活率达到95%以上。制备PP结细胞悬液的方法同上。
1.3.4 三色荧光标记
CD3-FITC、CD4-Percp单抗试剂按体积比1:9的比例用PBS进行稀释,CD8α-PE稀释比为1:4;10×溶血素与蒸馏水按照体积比1:9的比例进行稀释。分别对脾脏、MLN和PP结细胞悬液管中加入稀释后的CD3-FITC、CD4-Percp、CD8α-PE单抗各5μL;阴性管中加入同型对照抗体。涡旋混匀,避光室温静置30min。1200r/min离心5min,弃上清,用2mL PBS洗涤一次,加入含1g/100mL多聚甲醛的PBS溶液0.5mL混匀,放于4℃冰箱中待测。
1.3.5 流式细胞仪分析
淋巴细胞亚群用流式细胞仪进行分析,首先通过调整荧光电压,使阴性群体位于散点图的左下角。利用前向光和侧向光圈出淋巴细胞群体。其中CD3+细胞、CD4+细胞和CD8+细胞分别用FL1、FL2和FL3通道进行获取,每管获取10000个细胞。结果用CD3+细胞、CD4+细胞和CD8+细胞分别占门内淋巴细胞的百分比表示。利用BD CellQuest Pro数据分析软件对十字门内细胞的比例进行统计。
1.4 数据分析
用SPSS11.5对数据进行One-way方差分析,结果用均值±标准差(±s)表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同剂量CGMP对脾脏淋巴细胞亚群的影响
表2 连续灌胃CGMP 16d后小鼠脾脏淋巴细胞亚群的变化(±s,n=7)Table 2 Spleen lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days (±s,n=7)
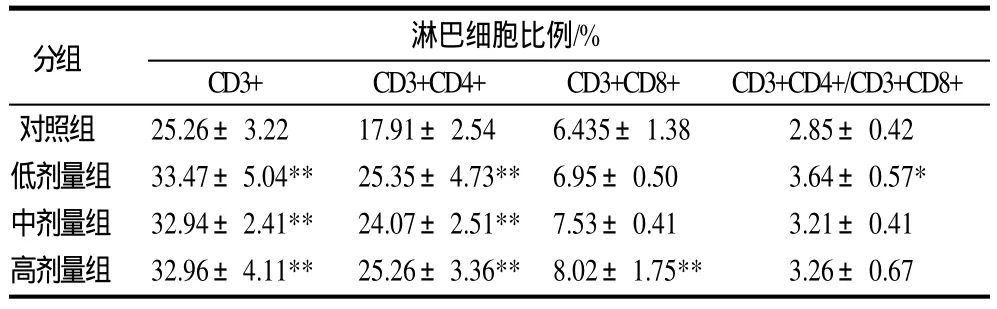
表2 连续灌胃CGMP 16d后小鼠脾脏淋巴细胞亚群的变化(±s,n=7)Table 2 Spleen lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days (±s,n=7)
注:*.与对照组比较,差异显著(P<0.05);**.与对照组比较,差异极显著(P<0.01);表中“%”表示以淋巴细胞计。下同。
分组 淋巴细胞比例/%CD3+ CD3+CD4+ CD3+CD8+ CD3+CD4+/CD3+CD8+对照组 25.26±3.22 17.91±2.54 6.435±1.38 2.85±0.42低剂量组 33.47±5.04** 25.35±4.73** 6.95±0.50 3.64±0.57*中剂量组 32.94±2.41** 24.07±2.51** 7.53±0.41 3.21±0.41高剂量组 32.96±4.11** 25.26±3.36** 8.02±1.75** 3.26±0.67
由表2可知,连续灌胃16d后,各剂量组与对照组相比,CD3+、CD3+CD4+淋巴细胞显著增多(P<0.01);高剂量组CD3+CD8+淋巴细胞显著高于对照组(P<0.01),中低剂量组则无显著变化;3个剂量都会引起CD3+CD4+/ CD3+CD8+比值升高,其中,低剂量组与对照组相比有显著差异性(P<0.05)。随着剂量升高,CD3+CD8+的比例不断升高,高剂量组与对照组相比差异具有统计学意义(P<0.01)。
2.2 不同剂量CGMP对MLN中淋巴细胞亚群的影响
由表3可知,各剂量组与对照组相比,3个剂量组的CD3+和CD3+CD4+淋巴细胞比例没有显著变化;3个剂量组的CD3+CD8+淋巴细胞都显著减少;低、高剂量组CD3+CD4+/ CD3+CD8+比值显著高于对照组(P<0.05)。
表3 连续灌胃CGMP 16d后小鼠肠系膜淋巴结淋巴细胞亚群的变化(±s,n=7)Table 3 MLN lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days(±s,n=7)
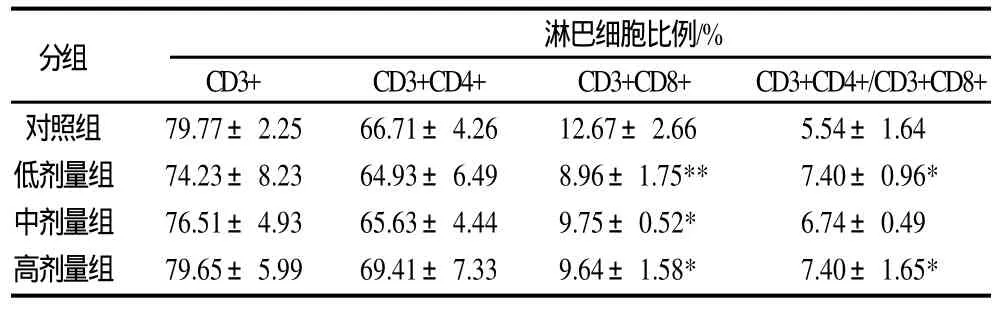
表3 连续灌胃CGMP 16d后小鼠肠系膜淋巴结淋巴细胞亚群的变化(±s,n=7)Table 3 MLN lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days(±s,n=7)
分组 淋巴细胞比例/%CD3+ CD3+CD4+ CD3+CD8+ CD3+CD4+/CD3+CD8+对照组 79.77±2.25 66.71±4.26 12.67±2.66 5.54±1.64低剂量组 74.23±8.23 64.93±6.49 8.96±1.75** 7.40±0.96*中剂量组 76.51±4.93 65.63±4.44 9.75±0.52* 6.74±0.49高剂量组 79.65±5.99 69.41±7.33 9.64±1.58* 7.40±1.65*
2.3 不同剂量CGMP对PP结淋巴细胞亚群的影响
表4 连续灌胃CGMP 16d后小鼠Peyer’s Patches淋巴细胞亚群的变化(±s,n=7)Table 4 Peyer’s patches lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days(±s,n=7)

表4 连续灌胃CGMP 16d后小鼠Peyer’s Patches淋巴细胞亚群的变化(±s,n=7)Table 4 Peyer’s patches lymphocytomete subpopulation in mice after gastric perfusion of CGMP at varying dosages for 16 consecutive days(±s,n=7)
分组 淋巴细胞比例/%CD3+ CD3+CD4+ CD3+CD8+ CD3+CD4+/CD3+CD8+对照组 35.33±5.95 28.87±5.04 4.90±1.34 6.27±1.89低剂量组 42.78±0.75* 36.37±0.93** 5.54±0.88 6.65±1.15中剂量组 44.70±7.24** 37.05±6.35** 6.47±1.46* 5.84±0.81高剂量组 43.79±3.63** 36.31±3.40** 6.12±1.07* 6.12±1.34
由表4可知,3个剂量组CD3+淋巴细胞显著高于对照组(P<0.05);3个剂量组的CD3+CD4+淋巴细胞显著高于对照组(P<0.01);CGMP会引起CD3+CD8+比例的增高,其中,中、高剂量组CD3+CD8+显著高于对照组(P<0.05);CD3+CD4+/ CD3+CD8+比值与对照组相比并无显著变化。
3 讨 论
3.1 PP结、脾脏和肠系膜淋巴结作为研究对象的意义
外周免疫器官包括淋巴结、脾脏和黏膜相关淋巴组织。脾脏是机体最大的免疫器官,内含有大量的淋巴细胞,是机体细胞免疫和体液免疫的中心。肠相关淋巴组织(gut-associated lymphoid tissue,GALT)是机体最大的淋巴组织。其中,诱导肠黏膜免疫部位主要包括PP结和MLN,效应部位是上皮内和固有层淋巴细胞。这些肠相关淋巴组织的淋巴细胞直接参与了肠道抗原的识别、呈递和免疫效应,它们能够反映肠道黏膜免疫系统的功能和状态。因此,MLN、PP结和脾脏中T淋巴细胞各亚群数量的变化能够反映出小鼠灌胃CGMP后能否诱导肠黏膜产生免疫应答反应。
目前,关于CGMP对肠黏膜免疫的调节作用研究的并不是很多,国外的研究主要集中在体外免疫实验。本研究利用小鼠作为实验模型,通过灌胃实验对引起肠黏膜免疫反应的诱导位点PP结和肠系膜淋巴结以及脾脏T淋巴亚群的变化进行研究,既可以观察CGMP灌胃后是否产生口服耐受,也能够为进一步研究CGMP介导肠黏膜免疫机理提供线索。
3.2 CGMP引起外周免疫器官T淋巴细胞亚群变化原因的探讨
目前,关于CGMP引起小鼠肠相关淋巴组织的T淋巴细胞及其亚群的变化的作用机制尚不清楚,国内外文献未见相关的报道。通过实验结果分析,发现CGMP能够促进外周免疫器官如脾脏、PP结中T淋巴细胞的增多,说明CGMP能够引起这些外周免疫器官产生相应的免疫应答,可能原因是CGMP作为免疫活性肽进入胃肠道后,首先与肠相关淋巴组织接触,引起肠黏膜免疫系统的应答,发生特异性的细胞免疫,促进成熟的T淋巴细胞向外周免疫器官迁移,并且引起了这些免疫组织中T淋巴细胞亚群发生改变。
PP结是肠道最主要的免疫起始位点,也是T细胞和B细胞发生初始免疫应答的主要场所之一,PP结中CD4+和CD8+细胞在肠黏膜免疫应答起着重要作用,CGMP能够促进PP结中CD3+和CD3+CD4+、CD3+CD8+细胞的显著增加,它们的显著增加能够反映高剂量CGMP促进T淋巴细胞在淋巴滤泡中的增殖和分化,可能的途径是CGMP由肠上皮M细胞传递给PP结内的树突细胞,高剂量能刺激PP结CD4+、CD8+T淋巴细胞增殖,并通过肠系膜淋巴结到达黏膜免疫的效应位点。
高剂量CGMP可以使脾脏CD3+、CD4+和CD8+淋巴细胞的显著增加;脾脏T淋巴细胞的增多可能与血液淋巴细胞循环有关。Otani[13]等通过体外实验发现酪蛋白水解的GMP片段能够抑制由分裂原LPS诱导的脾脏淋巴细胞的增殖,表明其对免疫反应具有抑制作用。一方面可能是CGMP通过肠相关淋巴组织和血液循环进入脾脏,在细胞因子的作用下,使脾脏淋巴细胞产生免疫应答;另外,可能是通过淋巴细胞再循环,其他淋巴组织中增殖的T淋巴细胞进入脾脏。MLN中含有大量的T淋巴细胞,CGMP能使MLN中CD3+CD8+淋巴细胞显著减少,但是CD3+CD4+淋巴细胞没有显著变化,从而引起CD3+CD4+/CD3+CD8+的比值增加,可能与淋巴细胞迁移有关。
另外,肠道微生物对于形成肠道黏膜免疫屏障具有重要作用,肠道共生菌的动态平衡直接影响着肠黏膜免疫的动态平衡,进而影响着机体的免疫系统,对于维持机体健康具有重要作用。由于CGMP能够改善肠道的微生物区系[14],所以有可能微生物区系的变化也会影响肠黏膜细胞免疫,使肠相关淋巴组织淋巴细胞亚群发生变化。
4 结 论
通过CGMP对脾脏、PP结和肠系膜淋巴结T淋巴细胞亚群变化的影响结果分析,反映了这3个部位在介导CGMP引起的细胞免疫过程中起着重要作用,长期灌胃能够介导肠黏膜免疫,促进脾脏和PP结T淋巴细胞亚群显著增多。研究发现,长期灌胃CGMP可以诱导肠黏膜产生获得性的免疫应答,不会引起口服耐受。灌胃CGMP可以刺激机体肠相关淋巴组织辅助性T淋巴细胞增多,通过分泌相应的细胞因子,调节机体的细胞免疫和体液免疫,对增强小鼠肠黏膜免疫屏障功能和阻止肠道病原菌和病毒的感染有重要作用。
另外,“药食同源”的概念正在深入人心,通过改善饮食来调节机体免疫功能,进而维持机体健康是目前食品领域研究的一个热点。CGMP可以作为增强免疫调节的功能性食品,增加肠相关淋巴组织辅助性T淋巴细胞的数量,维持肠黏膜免疫屏障功能。因此,CGMP在生物制药和功能性食品研发领域具有很重要的开发前景。
[1] GAUTREAUX M D, DEITCH E A, BERG R D. T lymphocytes in host defense against bacterial translocation from the gastrointestinal tract[J]. Infection and Immunity, 1994, 62(7): 2874-2884.
[2] 李伟, 陈庆森. 肠道黏膜免疫屏障及其菌群与机体健康关系的研究进展[J]. 食品科学, 2008, 29(11): 645-654.
[3] CALDER P C, KEW S. The immune system: a target for functional food[J]. Br J Nutr, 2002, 88 (2): 165-177.
[4] de WITT R C, KUDSK K A. The gut s role in metabolism, mucosal barrier function, and gut immunology[J]. Infect Dis Clin North Am,1999, 13(2): 465-481.
[5] MARTINEZ M J, CARRERA SANCHEZ C, RODRIGUEZ PATINO J M, et al. Bulk and interfacial behaviour of caseinoglycomacropeptide(GMP)[J]. Colloids Surf B Biointerfaces, 2009, 71(2): 230-237.
[6] NEY D M, GLEASON S T, van CALCAR S C, et al. Nutritional management of PKU with glycomacropeptide from cheese whey[J]. Inherit Metab Dis, 2009, 32(1): 32-39.
[7] NAKAJIMA K, TAMURA N, KOBAYASHI-HATTORI K, et al. Prevention of intestinal infection by glycomacropeptide[J]. Biosci Biotechnol Biochem, 2005, 69(12): 2294-2301.
[8] BRODY E P. Biological activities of bovine glycomacropeptide[J]. Br J Nutr, 2000, 84 (1): 39-46.
[9] LEDOUX N, MAHE S, DUBARRY M, et al. Intraluminal immunoreactive caseinomacropeptide after milk protein ingestion in humans[J].Nahrung, 1999, 43(3): 196-200.
[10] MIKKELSEN T L, RASMUSSEN E, OLSEN A, et al. Immunogenicity of kappa-casein and glycomacropeptide[J]. J Dairy Sci, 2006, 89(3):824-830.
[11] SASAI K, YOSHIMURA K, LILLEHOJ H S, et al. Analysis of splenic and thymic lymphocyte subpopulations in chickens infected with Salmonella enteritidis[J]. Vet Immunol Immunopathol, 1997, 59(3/4):359-367.
[12] RAMIRO-PUIG E, PEREZ-CANO F J, RAMOS-ROMERO S, et al.Intestinal immune system of young rats influenced by cocoa-enriched diet[J]. J Nutr Biochem, 2008, 19(8): 555-565.
[13] OTANI H , HATA I. Inhibition of proliferative responses of mouse spleen lymphocytes and rabbit Peyer s patch cells by bovine milk caseins and their digests[J]. J Dairy Res, 1995, 62(2): 339-348.
[14] 曹晋宜, 陈庆森, 王友湘, 等. 酪蛋白糖巨肽对小鼠肠道菌群消长规律的影响[J]. 食品科学, 2007, 28(11): 536-540.
Effect of Casein-glycomacropeptide on Intestinal Mucosal Immunity in Mice
LI Wei,CHEN Qing-sen*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin 300134, China )
R151.1
A
1002-6630(2010)15-0240-04
2010-04-19
国家自然科学基金项目(30771524)
李伟(1983—),男,硕士研究生,研究方向为生物活性物质的开发与利用。E-mail:lwcy1983@yahoo.cn
*通信作者:陈庆森(1957—),男,教授,硕士,研究方向为发酵生物技术、酶工程与蛋白质资源开发。E-mail:chqsen@tjcu.edu.cn

