一种苦荞抗真菌肽的纯化及抑菌活性分析
白承之, 王转花*, 李玉英
(化学生物学与分子工程教育部重点实验室,山西大学生物技术研究所,山西 太原 030006)
一种苦荞抗真菌肽的纯化及抑菌活性分析
白承之, 王转花*, 李玉英
(化学生物学与分子工程教育部重点实验室,山西大学生物技术研究所,山西 太原 030006)
以苦荞种子为材料,经提取、热处理,Resource S阳离子交换层析及Superdex Peptide分子筛层析,纯化具有抗真菌活性的多肽。Tricine-SDS-PAGE分析表明,该多肽的表观分子质量约为8.0kD。表面增强激光解吸电离飞行时间质谱(SELDI-TOF)显示其实际分子质量为3.909kD。该抗菌肽对白腐菌(Panus conchatus)、绿色木霉(Trichoderma reesei)和链格孢霉(Alternaria alternata)均表现出显著的生长抑制活性。绿色木霉的形态学分析显示:受到苦荞抗真菌肽影响的菌丝生长停滞,分支加剧,基内菌丝端部膨大,原生质凝缩。该抗真菌肽的制备工艺简单,产品热稳定性好,抑菌作用明显。
苦荞;抗真菌肽;纯化;抑菌活性;形态学分析;热稳定性
Abstract :An antifungal peptide (AFP) having the ability to protect organisms against fungal invasion was isolated from tartary buckwheat (Fagopyrum tataricum) seeds. The purification procedure involved extraction with 20 mmol/L Tris-HCl buffer, heating treatment, Resource S cation exchange column chromatography, and size exclusion chromatography (SEC) on Superdex peptide column. The apparent molecular weight of the purified peptide was approximately 8.0 kD evaluated by Tricine-SDS-PAGE, and its actual molecular weight was 3.909 kD determined by surface-enhanced laser desorption ionization-time of flight (SELDI-TOF). This peptide showed strong antifungal activity against Panus conchatus, Trichoderma reesei and Alternaria alternate and could cause swelling hyphal tips, hyphal distortion and condensed protoplasm in Trichoderma reesei. The easy preparation, high thermal stability and potent antifungal activity of this antifungal peptide demonstrate its great potential in food industry.
Key words :tartary buckwheat (Fagopyrum tataricum);antifungal peptide;purification;antifungal activity;light microscopic examination;thermal stability
在过去的数十年中,来自于细菌、真菌(酵母,霉菌或可食用真菌)[1-2]、高等植物(豆科和非豆科来源的植物种子)[3]、无脊椎动物(家蝇)、低等脊椎动物(蟾)[4]、哺乳动物和人类的抗真菌蛋白或抗真菌肽(antifungal proteins and peptides,AFPs)陆续被纯化和鉴定。AFPs是具有真菌生长抑制活性的一系列蛋白质的统称,分子质量在10kD以上的习惯称为抗真菌蛋白,已知的有几丁质酶、类几丁质酶、蛋白酶抑制剂、核糖体失活蛋白[5]等;而分子质量小于10kD的称为抗真菌肽,可能为脂转运肽[6]、类防御素肽或无其他生物活性的抗真菌肽。来源于高等植物的抗真菌肽尤其受到关注,因为这类抗真菌肽一般具有来源广泛,抗菌谱广[7],热稳定性高[8]等优点,在未来的农业和食品工业有潜在的利用前景。
苦荞(Fagopyrum tataricum)含有丰富的生物活性成分,目前研究报道较多的是其中的生物类黄酮、抗营养因子及过敏性成分等[9],有关荞麦抗真菌肽仅见Leung 等[10]报道的一种来自甜荞种子中的抗真菌肽。本实验以苦荞为材料,提取、纯化抗真菌肽,并对其分子特征、抑菌活性进行测定。
1 材料与方法
1.1 材料、试剂、菌种与仪器
苦荞为贵州威黑荞,由山西省农业科学院农作物品种资源研究所提供。
所用试剂均为国产分析纯。
链格孢霉(Alternaria alternata)、白腐菌(Panus conchatus)、绿色木霉(Trichoderma reesei)由山西大学生命科学与技术学院提供。
Resource S离子交换层析柱、Superdex Peptide HR10/300排阻层析柱 GE Healthcare公司;表面增强激光解吸电离飞行时间质谱(SELDI-TOF) Ciphergen公司。
1.2 方法
1.2.1 苦荞种子抗真菌肽的纯化
2008年收获的苦荞种子经过低温干燥处理,于粉碎机中粉碎,过0.2mm孔径筛网,以3:1(V/m)的比例加入丙酮,在低温条件下搅拌脱脂3h。减压抽滤,弃丙酮,收集滤饼,加入少量乙醚搅拌,减压抽滤,弃乙醚,收集滤饼,低温下干燥,所得粉末为苦荞种子脱脂粉。
取苦荞种子脱脂粉,以10:1(V/m)的比例加入浸提缓冲液(20mmol/L Tris-HCl pH8.0),在4℃条件下搅拌浸提6h,12000×g离心弃沉淀,在上清中加入硫酸铵至80%饱和度,4℃条件下搅拌盐析3h,12000×g离心弃上清,沉淀用浸提缓冲液溶解,并用截留分子质量为3kD的透析袋充分透析,所得蛋白溶液为苦荞种子水溶性总蛋白。
取上述水溶性总蛋白,在80℃恒温水浴中热处理20min,12000×g离心,除去热不稳定的杂蛋白,收集上清液中对热稳定的目的蛋白,进一步采用离子交换层析和分子筛层析在AKTA purifier蛋白纯化系统上分离。经过热处理的苦荞种子水溶性总蛋白,用Resource S阳离子交换层析平衡缓冲液充分透析后,上样于Resource S阳离子交换柱(1mL)。平衡缓冲液条件:20mmol/L NH4OAc pH4.5,洗脱缓冲液条件:20mmol/L NH4OAc,1mol/L NaCl,pH4.5,流速为0.5mL/min,待穿透峰被完全洗脱之后,设置40mmol/L NaCl的不连续梯度洗脱。收集各洗脱峰,进行抗真菌活性的筛选。
收集到的活性组分用分子筛层析的平衡缓冲液(20mmol/L Tris-HCl 150mmol/L NaCl pH8.0)充分透析,上样于Superdex Peptide HR 10/300层析柱,流速为0.5mL/min,收集活性洗脱峰。
1.2.2 分子质量测定
分子筛层析获得的活性组分使用Tricine-SDS-PAGE[11]进行分子质量估计和纯度鉴定,4%浓缩胶,16.5%分离胶,考马斯亮蓝R-250染色,并在凝胶成像系统中使用GeneTools software软件进行纯度分析。
为了得到苦荞种子抗真菌肽准确的分子质量,排阻层析获得的活性组分,使用表面增强激光解吸电离飞行时间质谱(SELDI-TOF)进行分子量测定[12],使用CM-10(弱阳离子交换芯片)进行蛋白质吸附,结果使用Ciphergen ProteinChip Software进行分析。
1.2.3 真菌生长抑制活性检测及形态学观察
选择绿色木霉(Trichoderma reesei)、链格孢霉(Alternaria alternata)和白腐菌(Panus conchatus)为受检真菌,使用牛津杯法[13]检测各层析组分对真菌生长的抑制作用。具体方法为:准备PDA培养基平板,将供试霉菌点植于培养基中心,于28℃培养至霉菌菌落直径达到1~2cm,在菌落外围放置灭菌的牛津杯,距离菌落边缘1cm,样品组(含目的蛋白)和对照组(不含目的蛋白而其他条件完全相同的缓冲液)各取200μL,使用0.22μm微孔滤膜过滤除菌,加入牛津杯内,在4℃预扩散24h,将培养基转移到28℃培养箱中培养72h后观察菌落生长状况。将样品组和对照组的菌丝直接置于倒置显微镜下观察菌丝形态[14]。
2 结果与分析
2.1 苦荞种子抗真菌肽的纯化

图1 苦荞种子抗真菌肽的Resource S阳离子交换层析Fig.1 Resource S cation exchange column fractionization of hydrolysates of thermal treated water-soluble proteins from tartary buckwheat
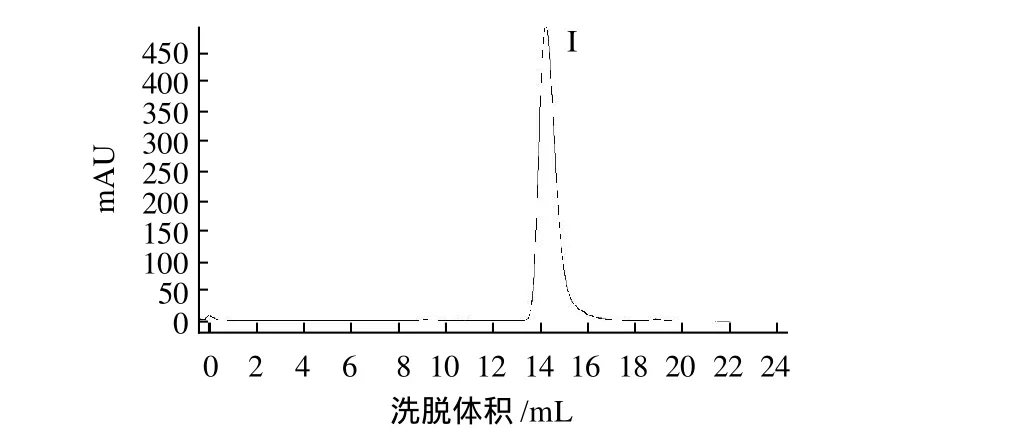
图2 阳离子交换层析活性洗脱峰Ⅳ的Superdex Peptide HR 10/300凝胶排阻层析Fig.2 Size exclusion chromatographic profile of fraction IV obtained in resource S cation exchange column fractionization on Superdex Peptide HR 10/300 column
苦荞种子水溶性总蛋白经过80℃恒温水浴20min,离心弃沉淀,上样于Resource S阳离子交换柱,获得4个层析峰(图1),仅有峰IV显示出抗真菌活性,将峰IV上样于Superdex Peptide HR 10/300分子筛层析柱,得到一个单峰(图2峰I),抑菌实验显示该峰具有抗真菌活性。
2.2 分子质量测定

图3 苦荞种子抗真菌肽的Tricine-SDS-PAGE结果Fig.3 Tricine-SDS-PAGE of the purified antifungal peptide and watersoluble proteins from tartary buckwheat
图3显示,经过热处理以及两步层析,目的多肽得到了高度纯化,其在电泳过程中的表观分子质量约为8.0kD,使用GeneTools software软件灰度扫描分析可知,表达产物的纯度均达到95%以上。
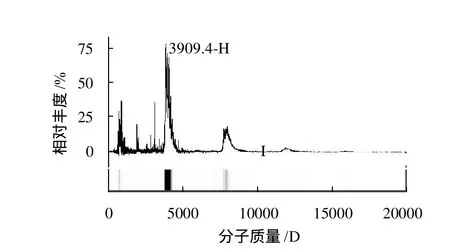
图4 苦荞种子抗真菌肽的SELDI-TOFFig.4 SELDI-TOF mass spectrum of the purified antifungal peptide
质谱结果显示该多肽的实际分子质量为3.909kD(图4),该结果与目的多肽在Superdex Peptide HR 10/300 分子筛层析结果(图2)一致。
2.3 真菌生长抑制活性检测及形态学观察
图5显示,3株供试霉菌在目的多肽的作用下,均受到显著的生长抑制作用,对于链格孢霉和白腐菌,抗菌肽会造成菌落边缘形成类似弦月的抑制形态。对于依靠孢子增殖的绿色木霉而言,菌丝可以绕过抑制区继续扩散,抑制区的菌落会形成一个类似抑菌圈的抑制形态,而对照组的菌落边缘为规则的圆形,显示没有任何生长抑制。

图5 苦荞种子抗真菌肽对3株真菌生长抑制作用的定性实验Fig.5 Antifungal activity of the purified antifungal peptide against three species of fungi
为了进一步证明实验获得的苦荞抗真菌肽的抑菌作用,选择绿色木霉平板在倒置显微镜下进行形态学观察。如图6所示,抗真菌肽可以显著抑制绿色木霉的生长,与对照组(A)相比,样品组(B)菌丝生长受到抑制,生长停滞, 顶端分支加剧,菌落形成清晰界面;样品组(D)与对照组(C)相比则出现基内菌丝端部膨大,出现泡状物,样品组(E)显示菌丝原生质凝缩,呈现出片段化特征,而对照组(C)菌丝光滑,均匀,形态正常,未出现生长受到抑制的形态特征。

图6 苦荞种子抗真菌肽对绿色木霉生长抑制作用的形态学观察Fig.6 Light microscopic examination of the purified antifungal activity against Trichoderma reesei
3 讨 论
在农业和食品工业领域,腐生丝状真菌(霉菌)的污染始终是人们关注的焦点。多种农药以及食品防腐剂因为不符合新的食品安全要求而停止使用,同时,抗真菌肽因其来源广泛、抗菌谱广、对人无毒、对环境无公害的特征越来越得到学术界的广泛关注。和抗真菌蛋白相比,抗真菌肽具有热稳定性好、不致敏等特点,在食品工业的应用潜力巨大。多种植物种子来源的抗真菌肽已经得到纯化和鉴定[5-6]。
本实验以我国小杂粮作物——苦荞为研究对象,经过阳离子交换层析和分子筛层析两步层析纯化,分离得到纯度较高的苦荞种子抗真菌肽。与已报道的纯化手段相比[10],该方法简便、成本较低、产物损失减少。其中,纯化之前的热处理步骤可以使大量与本研究无关的杂蛋白变性除去,使其后续的层析步骤变得简化。而本实验分离的抗真菌肽是热稳定多肽,并不会受到影响。质谱实验显示抗真菌肽的分子质量为3.909kD。
真菌生长抑制活性实验显示,苦荞种子抗真菌肽对于3种常见的农业致病真菌——绿色木霉、链格孢霉和白腐菌均有强的生长抑制作用。形态学观察结果与目前报道的其他来源的抗真菌肽作用于不同真菌的结果十分吻合[14-15],从而进一步证明苦荞抗真菌肽的真菌生长抑制作用。
[1] 徐同, 柳良好. 木霉几丁质酶及其对植物病原真菌的拮抗作用[J]. 植物病理学报, 2002, 32(2): 97-102.
[2] GUO Yongxia, WANG Hexiang, NG T B. Isolation of trichogin, an antifungal protein from fresh fruiting bodies of the edible mushroom Tricholoma giganteum[J]. Peptides, 2005, 26(4): 575-580.
[3] NG T B. Antifungal proteins and peptides of leguminous and nonleguminous origins[J]. Peptides, 2004, 25: 1215-1222.
[4] 徐兴军, 陈丽, 吕建伟, 等. 中国林蛙和中华蟾蜍皮肤抗菌肽的分离纯化及其抗菌活性[J]. 四川动物, 2009, 28(2): 164-167.
[5] LAM S S L, WANG Hexiang, NG T B. Purification and characterization of novel ribosome inactivating proteins, alpha- and beta-pisavins, from seeds of the garden pea Pisum sativum[J]. Biochemical and Biophysical Research Communications, 1998, 253: 135-142.
[6] LIN Peng, XIA Lixin, NG T B. First isolation of an antifungal lipid transfer peptide from seeds of a Brassica species[J]. Peptides, 2007, 28:1514-1519.
[7] WONG J H, NG T B. Vulgarinin, a broad-spectrum antifungal peptide from haricot beans (Phaseolus vulgaris)[J]. The International Journal of Biochemistry & Cell Biology, 2005, 37: 1626-1632.
[8] LIN Peng, WONG J H, XIA Lixin, et al. Campesin, a thermostable antifungal peptide with highly potent antipathogenic activities[J]. Journal of Bioscience and Bioengineering, 2009, 108: 259-265.
[9] 张昕, 崔晓东, 李玉英, 等. 苦荞过敏蛋白全长基因的克隆、表达及免疫学活性研究[J]. 食品科学, 2009, 30(1): 203-206.
[10] LEUNG H W, NG T B. A relatively stable antifungal peptide from buckwheat seeds with antiproliferative activity toward cancer cells[J].Journal of Peptide Science, 2007, 13: 762-767.
[11] SCHAGGER H, von JAGOW G. Tricine-sodium dodecyl sulfatepolyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kD[J]. Analytical Biochemistry, 1987, 166(2): 368-379.
[12] YUAN Moucun, CARMICHAEL W W. Carmichael detection and analysis of the cyanobacterial peptide hepatotoxins microcystin and nodularin using SELDI-TOF mass spectrometry[J]. Toxicon, 2004, 44(5): 561-570.
[13] SCHLUMBAUM A, MAUCH F, VGELI U, et al. Plant chitinases are potent inhibitors of fungal growth[J]. Nature, 1986, 324: 365-367.
[14] 刘颖, 徐庆. 抗真菌肽LP-1的分离纯化及特性分析[J]. 微生物学报,1999, 39(5): 441-447.
[15] 代富英, 周金燕, 谭红. 捷安肽素抗真菌作用机理研究[J]. 成都医学院学报, 2006, 1(2): 86-90.
Purification and Activity of an Antifungal Peptide from the Seeds of Tartary Buckwheat (Fagopyrum tataricum)
BAI Cheng-zhi,WANG Zhuan-hua*,LI Yu-ying
(Key Laboratory of Chemical Biology and Molecular Engineering, Ministry of Education, Institute of Biotechnology,Shanxi University, Taiyuan 030006, China)
Q516;R392
A
1002-6630(2010)15-0004-04
2009-11-05
国家自然科学基金项目(30870525;30671084);山西省自然科学基金项目(2007011077)
白承之(1983—),男,硕士研究生,研究方向为生物活性物质。E-mail:200723002001@mail.sxu.cn
*通信作者:王转花(1956—),女,教授,博士,研究方向为蛋白质化学与工程。E-mail:zhwang@sxu.edu.cn

