活的非可培养状态溶藻胶弧菌复苏后的致病性及基因表达
姜荧安,陈吉祥**,贾俊涛,郭倩茹,赵明君
(1.中国海洋大学,山东青岛266003;2.山东出入境检验检疫局,山东青岛266002;3.广东海洋大学,广东湛江524088)
研究简报
活的非可培养状态溶藻胶弧菌复苏后的致病性及基因表达
姜荧安1,陈吉祥1**,贾俊涛2,郭倩茹3,赵明君1
(1.中国海洋大学,山东青岛266003;2.山东出入境检验检疫局,山东青岛266002;3.广东海洋大学,广东湛江524088)
溶藻胶弧菌广泛分布于海洋环境,是海洋生物及人类的条件性致病菌。溶藻胶弧菌在不良环境进入活的非可培养状态,当条件适宜时复苏为可培养形式。本文研究了溶藻胶弧菌由活的非可培养状态复苏为可培养状态时的生理特征及对斑马鱼的致病性,结果发现复苏为可培养状态的溶藻胶弧菌对紫外辐射、热激、冷激的抵抗力没有明显改变。用RT-PCR未检测到VBNC状态溶藻胶弧菌tox S和tox R基因的表达,而复苏后的细胞检测到这些基因的表达。复苏后的溶藻胶弧菌对斑马鱼的LD50为6.25×106CFU/尾,与野生菌株(LD50为4.80×106CFU/尾)没有显著差别。
溶藻胶弧菌;活的非可培养状态;复苏;致病性;基因表达
溶藻胶弧菌(Vibrio alginolyticus)是1种嗜盐性革兰氏阴性细菌,广泛分布于海洋、河口及海洋生物中[1-3],可引起海水鱼、虾、贝类的疾病,给水产养殖业带来较大的经济损失[4-6]。该菌也是沿海地区人类腹泻和食物中毒的常见病原菌[7-9]。Kahla-Nakbi等从突尼斯地中海沿岸的患病乌颊海鲷(S parus aurata)和海鲈(Dicentrarchus labrax)体内分离出溶藻胶弧菌,发现7株溶藻胶弧菌对这2种鱼类有致病性,LD50的范围从5.01×104~6.20×107CFU/尾[10]。溶藻胶弧菌致病相关的毒力因子包括载铁体、蛋白酶类及外毒素。Yan等发现溶藻胶弧菌能够强烈黏附到大黄鱼的肠道黏液中,并且各种环境因素对其黏附性有很大的影响[11]。Lee等研究发现,溶藻胶弧菌的胞外产物可引起日本对虾血浆中抗脂多糖因子消失、血蓝蛋白减少[12]。Chen等发现碱性丝氨酸蛋白酶是溶藻胶弧菌分泌的主要蛋白酶,也是对虾的主要致病因子之一[13]。有关溶藻胶弧菌致病的机理仍有许多问题有待解决。
许多病原菌在不良环境中能形成活的非可培养状态(Viable but nonculturable state,VBNC),用常规方法培养不能生长繁殖,但仍然具有代谢活性,VBNC状态的细菌在一定条件下复苏为可培养形式,部分病原菌在复苏之后保持了致病性[14-15]。溶藻胶弧菌在低温寡营养条件下能进入活的非可培养状态,当采用升温和添加营养物质时能复苏为可培养状态[16],本文的目的是进一步研究VBNC状态的溶藻胶弧菌复苏后的生理特性和致病性,并研究其毒力相关基因tox R和tox S的表达情况,以揭示其疾病发生和传播机制。
1 材料和方法
1.1 实验菌株
溶藻胶弧菌VIB 283(LMG 4408T,ATCC17749T)来自英国Heriot-Watt大学。
1.2 溶藻胶弧菌VBNC状态的诱导及复苏
实验用海水采自青岛沿海水域,用孔径0.22μm微孔滤膜过滤,以除去颗粒物质,121℃灭菌20 min。将培养至对数生长期的溶藻胶弧菌接种到灭菌的过滤海水中,使其终浓度为107CFU/mL,静置于4℃冰箱里培养,每隔一定时间取样进行检测。VBNC状态的溶藻胶弧菌采用添加营养物质升温的方法进行复苏。
1.3 复苏的溶藻胶弧菌对环境应激的敏感性
由VBNC状态复苏的溶藻胶弧菌细胞和正常生长的细胞分别在2216 E液体培养基中培养12 h,收集菌悬液,8 000 r/min,离心10 min收集沉淀细胞,用等体积PBS(p H=7.4)洗涤,稀释至适当浓度用于环境应激试验。
紫外照射:用PBS将正常与复苏的溶藻胶弧菌10倍梯度稀释到102,103,104CFU/mL 3个浓度,充分混合均匀后取细胞悬液0.1 mL,分别涂布于2216 E平板,无菌条件下进行紫外照射,紫外灯功率为15 W,照射距离为30 cm,照射时间分别为0,20,40,60和80 s,照射结束后置于暗处避免光修复,于28℃培养24 h,进行菌落计数并计算存活率。
热激处理:用PBS将正常与复苏的溶藻胶弧菌10倍梯度稀释到102,103,104CFU/mL 3个浓度,再置于42℃水浴中分别处理0,30,60和90 min,定时取样并迅速置于冰浴中冷却至室温,涂布2216 E平板,28℃培养24 h,进行菌落计数并计算存活率[17]。
冷激处理:用PBS将正常与复苏的溶藻胶弧菌10倍梯度稀释到102,103,104CFU/mL 3个浓度,分别在4℃冰箱中处理0,30,60和90 min,定时取样涂布2216 E平板,于28℃培养24 h,进行菌落计数并计算存活率[18]。
1.4 RT-PCR检测不同状态溶藻胶弧菌毒力基因的表达
根据GenBank已有的溶藻胶弧菌的tox S和tox R基因序列,利用Primer 5.0分别设计2对简并引物。tox S基因引物:5’-CCACTGGCGGACAAAATAACC-3’;5’-AACAGTACCGTAGAACCGTGA-3’,扩增目的片断为640 bp。tox R基因引物:
5’-TTTGTTTGGCGTGAGCAAGGTTTT-3’;5’-GGTTATTT TGTCCGCCAGTGG-3’,扩增目的片断为595 bp。引物由上海生物工程公司合成。
正常和复苏的溶藻胶弧菌细胞在28℃培养24 h,用无菌生理盐水分别从2216 E斜面上洗下,4℃、10 000 r/min离心10 min收集菌体。VBNC状态溶藻胶弧菌细胞于4℃、12 000 r/min离心30 min进行收集。用Trizol(Invitrogen)试剂抽提正常状态、复苏状态以及VBNC状态菌体的总RNA,用无RNase的DNaseⅠ处理提取的RNA样品。取4μL DNaseⅠ处理后的RNA,使用M-MLV逆转录酶合成cDNA第1条链。然后对cDNA第1条链进行PCR扩增。PCR体系为:10×PCR buffer 5μL;25 mmol/L MgCl23 μL;200μmol/L dNTP 1μL;cDNA模板0.5μL;1.25 UTaq聚合酶0.5μL和50μmol/L上游下游引物0.5 μL,用双蒸水补至50μL。PCR反应参数为:94℃预变性5 min;94℃变性1 min;52℃退火1 min;72℃延伸1 min;30个循环72℃延伸10 min,PCR产物于1%琼脂糖凝胶电泳。
1.5 复苏溶藻胶弧菌对斑马鱼的致病性
健康斑马鱼110尾随机分为11组,每组10条,分别于2 L的容器中,20~25℃条件下饲养,定期喂食。正常和复苏的溶藻胶弧菌于2216 E液体培养基中过夜培养,用灭菌的生理盐水洗脱,稀释成不同浓度(105,106,107,108和109CFU/mL)。每组分别腹腔注射20μL不同浓度的正常菌液和复苏菌液,对照组腹腔注射生理盐水20μL。注射的斑马鱼在相同的条件下饲养30 d,记录死亡数,计算半数致死量(LD50)[19]。
2 结果
2.1 复苏溶藻胶弧菌对环境应激的抵抗力
溶藻胶弧菌在自然海水中4℃保存90 d后进入活的非可培养状态。在活的非可培养状态的溶藻胶弧菌悬液中加入终浓度为0.025%的酵母液,28℃培养16 h后,得到复苏的细胞,经16 S rRNA基因序列分析确定为溶藻胶弧菌。
在紫外照射下,正常状态和复苏的溶藻胶弧菌细胞的存活率随时间延长而逐渐降低,照射80 s后2种状态的细胞都失去培养能力,正常和复苏细胞的存活率没有明显差别(见图1A)。在42℃热激条件下,正常和复苏细胞的存活率随着处理时间的延长迅速降低,90 min后细胞大部分失去培养能力,2种状态细胞的存活率分别是12.38%和2.73%(见图1B)。在4℃冷激条件下,正常和复苏细胞存活率均没有明显降低, 90 min后正常状态的细胞存活率保持在101.90%,复苏的细胞存活率为94.55%(见图1C)。
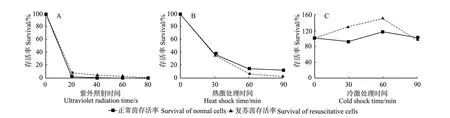
图1 正常与复苏状态溶藻胶弧菌VIB 283在不同环境应激的存活曲线:A,紫外辐射;B,热激(42℃)处理;C,冷激(4℃)处理Fig.1 Survival curves of normal and resuscitative cells ofVibrio alginolyticusVIB 283 under different environmental stresses:A,ultraviolet radiation;B,heat shock;C,cold shock
2.2 RT-PCR检测溶藻胶弧菌tox R和tox S基因的表达
溶藻胶弧菌VIB 283在正常和复苏状态tox R和tox S基因均有表达,而在VBNC状态下没有检测到表达(见图2)。
2.3 溶藻胶弧菌的致病性
将正常状态和复苏状态的溶藻胶弧菌分别腹腔注射斑马鱼,结果发现复苏状态的溶藻胶弧菌恢复了对斑马鱼的致病性,复苏后菌株对斑马鱼的LD50为6.25 ×106CFU/尾,而正常野生菌株对斑马鱼的LD50为4.80×106CFU/尾,复苏后的溶藻胶弧菌的毒力没有明显降低。
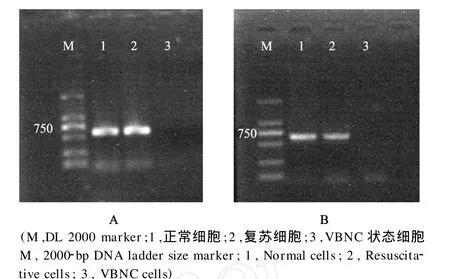
图2 RT-PCR检测不同状态溶藻胶弧菌VIB 283tox R基因(A)和tox S基因表达(B)。Fig.2 RT-PCR detection oftox Rgene(A)andtox Sgene (B)ofVibrio alginolyticusVIB 283 in different status.
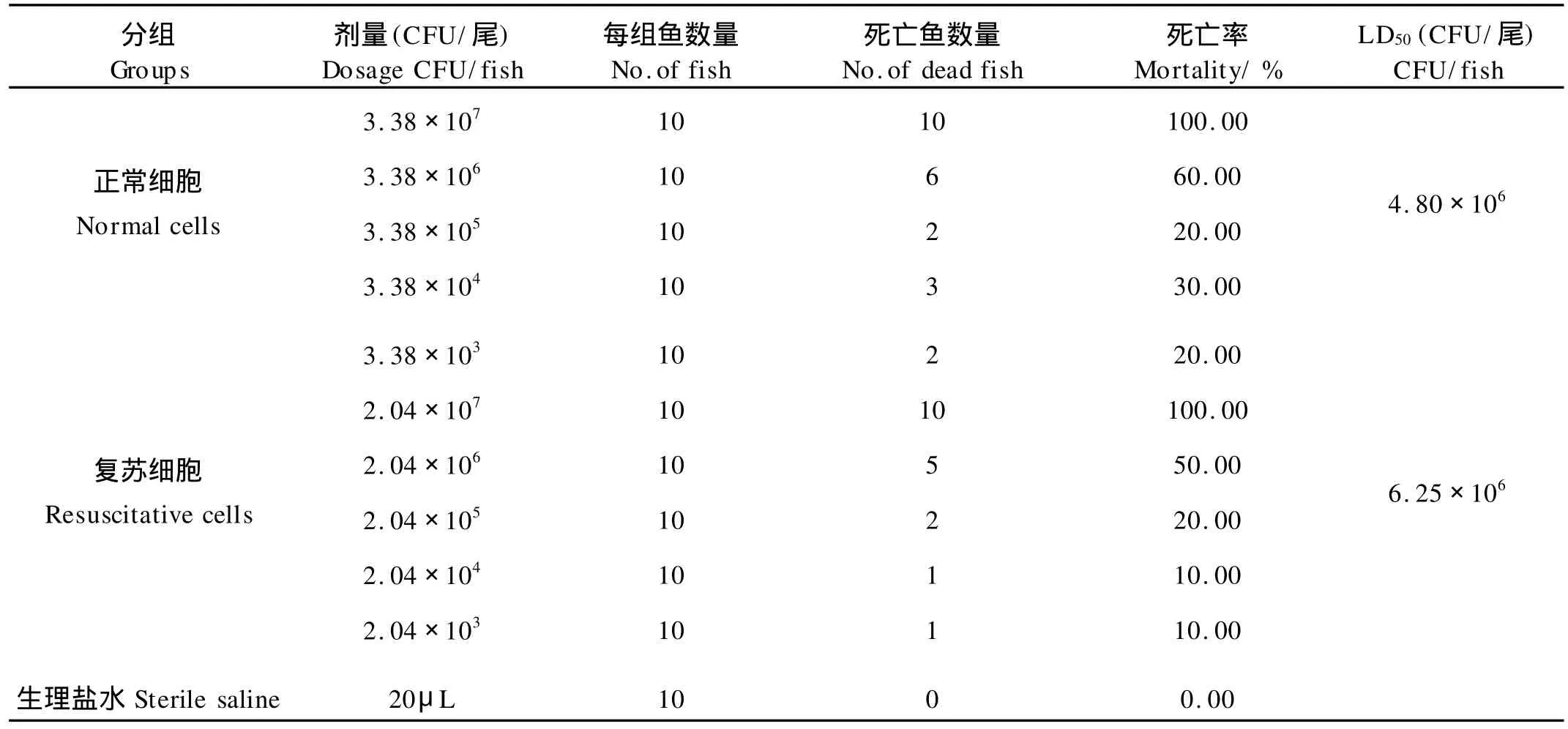
表1 溶藻胶弧菌VIB 283正常状态和复苏状态细胞对斑马鱼的致病性Table 1 Virulence to zebra fish of normal and resuscitative cells ofVibrio alginolyticusVIB 283
3 讨论
已报道形成VBNC状态的细菌超过60种,其中大部分是人和动物的致病菌。Baffone等报道溶藻胶弧菌在人工海水中保存28~30 d时进入VBNC状态[20]。研究发现溶藻胶弧菌VIB 283在自然海水中低温保持90 d后进入活的非可培养状态,进入VBNC状态的细胞形态发生变化,变为球形,细胞体积缩小,当复苏为可培养形式后,细胞恢复为正常形态。复苏的溶藻胶弧菌与正常细胞相比对紫外照射、冷激和热激的抵抗力没有显著降低。表明溶藻胶弧菌从非可培养状态复苏为可培养状态后对环境的适应能力没有显著降低。
不同病原菌在VBNC状态时的基因表达和毒性有一定差异。Rahman等发现痢疾志贺氏菌1型的VBNC细胞保留若干致病因素和潜在的毒力[21]。 Gonzalez-Escalona等发现VBNC状态的霍乱弧菌tuf基因表达量下降,relA与rpoS基因表达量增加[22]。Colwell等发现注射VBNC状态的霍乱弧菌能导致受测试志愿者的腹泻症状,同时发现此菌在进入VBNC状态28 d后,仍能产生霍乱毒素,PCR检测说明产生霍乱毒素的基因仍然存在[23]。Coutard报导处于VBNC状态的副溶血弧菌可检测到16S-23S rRNA和rpoS基因表达,但没有检测到tdh1和tdh2基因表达[24]。Saux发现不同来源的创伤弧菌在人工海水形成VBNC时能检测溶血素基因的表达[25]。Baffone报道从VBNC复苏的副溶血弧菌暂时失去了对小鼠的致病性,而这些细胞在结扎的小鼠回肠模型(Ileal loop model)中传代2次后又恢复了致病性[20]。作者研究发现复苏的溶藻胶弧菌对斑马鱼的致病性与正常状态的溶藻胶弧菌相比并没有显著降低。说明VBNC状态的溶藻胶弧菌仍然保留着潜在的毒力,当在一定的适宜环境下复苏后即重新表达并产生毒力和感染性。
tox R基因在弧菌中广泛分布,能对弧菌的多种毒力基因的表达进行调控。tox R基因最初是在霍乱弧菌(Vibrio cholerae)中发现,它对编码霍乱毒素的ctx基因具有转录调控作用[26],随后还发现tox R基因可以编码1种跨膜蛋白,该蛋白对ctx、tcp及omp U、omp T基因的协同调控有重要作用[27-30]。tox S基因与tox R基因位于同一个操纵子,它处于tox R基因的下游。tox S基因能够明显增强由tox R基因调控的转录反应[31]。Tox R和Tox S蛋白共同调控着tox T基因的表达,而tox T蛋白作为毒力基因级联调控的一部分,能够激活至少8种不同的毒力基因启动子[28]。我们用RT-PCR没有检测到VBNC状态的溶藻胶弧菌tox R和tox S基因的表达,但当其复苏为可培养状态时,tox R和tox S基因的表达又恢复到可检测水平。推测tox R和tox S基因对毒力基因的表达调控作用可能与溶藻胶弧菌复苏后恢复致病性相关。
[1] Kaneko T,Colwell R R.Distribution ofVibrio parahaemolyticus and related organisms in the Atlantic ocean off South Carolina and Georgia[J].Appl Microbiol,1974,28(6):1009-1017.
[2] Stefan H,Helmut W,Karin N B,et al.Isolation ofVibrio alginolyticusfrom seawater aquaria[J].Int J Hyg Environ Health, 2000,203(2):169-175.
[3] Gjerde J,B e B.Isolation and characterization ofVibrio alginolyticusandVibrio parahaemolyticusfrom the Norwegian coastal environment[J].Acta Vet Scand,1981,22(3-4):331-343.
[4] Balebona M C,Andreu M J,Bordas M A,et al.Pathogenicity of Vibrio alginolyticusfor cultured gilt head sea bream(S parus aurataL.)[J].Appl Environ Microbiol,1998,64(11):4269-4275.
[5] Gomez-Leon J,Villamil L,Lemos M L,et al.Isolation ofVibrio alginolyticusandVibrio splendidusfrom aquacultured carpet shell clam(Ruditapes decussatus)larvae associated with mass mortalities[J].Appl Environ Microbiol,2005,71(1):98-104.
[6] Lee K K,Yu S R,Chen F R,et al.Virulence ofVibrio alginolyticusisolated from diseased tiger prawn,Penaeus monodon[J]. Curr Microbiol,1996,32(4):229-231.
[7] Rubin S J,Tilton R C.Isolation ofVibrio alginolyticusfrom wound infections[J].J Clin Microbiol,1975,2(6):556-558.
[8] 封会茹,游京蓉,刘玉堂,等.溶藻胶弧菌引起暴发型食物中毒的病原学研究[J].中国食品卫生杂志,2003,15(4):331-334.
[9] Balebona M C,Moriñigo M A,Borrego J J.Hydrophobicity and adhesion to fish cells and mucus ofVibriostrains isolated from infected fish[J].Int Microbiol,2001,4(1):21-26.
[10] Kahla-Nakbi A B,Chaieb K,Besbes A,et al.Virulence and enterobacterial repetitive intergenic consensus PCR ofVibrio alginolyticusstrains isolated from Tunisian cultured gilthead sea bream and sea bass outbreaks[J].Vet Microbiol,2006,117(2-4):321-327.
[11] Yan Q P,Chen Q,Ma S,et al.Characteristics of adherence of pathogenicVibrio alginolyticusto the intestinal mucus of large yellow croaker(Pseudosciaena crocea)[J].Aquaculture,2007, 269(1-4):21-30.
[12] Lee K K,Chen F R,Yu S R,et al.Effects of extracellular products ofVibrio alginolyticuson penaeid prawn plasma components [J].Lett Appl Microbiol,1997,25(2):98-100.
[13] Chen F R,Liu P C.Lee K K.Lethal attribute of serine protease secreted byVibrio alginolyticusstrains in kuruma prawn Penaeus japonicus[J].Z Naturforsch C,2000,55(1-2):94-99.
[14] Xu H S,Roberts N,Singleton F L,et al.Survival and viability of nonculturableEscherichia coliandVibrio choleraein the estuarine and marine environment[J].Microb Ecol,1982,8(4): 313-323.
[15] James D,Oliver.The viable but nonculturable state in bacteria [J].J Microbiol,2005,43:93-100.
[16] Du M,Chen J X,Zhang X H,et al.Characterization and resuscitation of viable but nonculturableVibrio alginolyticusVIB283 [J].Arch Environ Microbiol,2007,188(3):283-288.
[17] Mary P,Sautour M,Chihib N E,et al.Tolerance and starvation induced cross-protection against different stresses inAeromonas hydrophila[J].Int J Food Microbiol,87(1-2):121-130.
[18] Chiang M L,Ho W L,Chou C C.Response ofVibrio parahaemolyticusto ethanol shock[J].Food Microbiol,2006,23(5): 461-467.
[19] Reed L J,Muench H.A simple method of estimating fifty percent endpoints[J].Am J Hyg,1938,27:493-497.
[20] Baffone W,Citterio B,Vittoria E,et al.Retention of virulence in viable but non-culturable halophilicVibriospp.[J].Int J Food Microbiol,2003,89(1):31-39.
[21] Rahman I,Shahamat M,Chowdhury M A,et al.Potential virulence of viable but nonculturable Shigella dysenteriae Type 1[J]. Appl Envirn Microbiol,1996,62(1):115-120.
[22] Gonz lez-Escalona N,Fey A,Höfle M G,et al.Quantitative reverse transcription polymerase chain reaction analysis ofVibrio choleraecells entering the viable but non-culturable state and starvation in response to cold shock[J].Environ Microbiol, 2006,8(4):658-666.
[23] Colwell R R,Brayton P R,Grimes D J,et al.Viable but nonculturableVibrio choleraeand related pathogens in the environment:Implications for the release of genetically engineered microorganisms[J].Bio/Technology,1985,3:817-820.
[24] Coutard F,Pommepuy M,Loaec S,et al.mRNA detection by reverse transcription-PCR for monitoring viability and potential virulence in a pathogenic strain ofVibrio parahaemolyticusin viable but nonculturable state[J].J Appl Microbiol,2005,98(4): 951-961.
[25] Saux M F L,Dominique H H,Loaec S,et al.Detection of cytotoxin-hemolysin mRNA in nonculturable populations of environmental and clinicalVibrio vulnif icusstrains artificial seawater [J].Appl Environ Microbiol,2002,68(11):5641-5646.
[26] Miller V L,Mekalanos J J.Synthesis of cholera toxin is positively regulated at the transcriptional level by toxR[J].Proc Natl Acad Sci U S A,1984,81(11):3471-3475.
[27] Crawford J A,Kaper J B,DiRita V J.Analysis of ToxR depend-ent transcription activation ofompU,the gene encoding a major envelope protein inVibrio cholerae[J].Mol Microbiol,1998,29 (1):235-246.
[28] DiRita V J.Co-ordinate expression of virulence genes by Tox R inVibrio cholerae[J].Mol Microbiol,1992,6(4):451-458.
[29] Miller V L,Mekalanos J J.A novel suicide vector and its use in construction of insertion mutations:osmoregulation of outer membrane proteins and virulence determinants inVibrio cholerae requirestoxR[J].J Bacteriol,1988,170(6):2575-2583.
[30] Miller V L,Taylor R K,Mekalanos J J.Cholera toxin transcriptional activator Tox R is a transmembrane DNA binding protein [J].Cell,1987,48(2):271-279.
[31] Miller V L,DiRita V J,Mekalanos J J.Identification oftoxS,a regulatory gene whose product enhancestoxR-mediated activation of the cholera toxin promoter[J].J Bacteriol,1989,171(3): 1288-1293.
Abstract: Vibrio alginolyticusis widely distributed in marine environment.It is an opportunistic pathogen of human being and marine animals.The bacterium is able to adapt to environmental stresses and enter into the viable but nonculturable(VBNC)state.The VBNC cells could be recovered to culturable state under certain conditions.This study investigated the physiological characteristics and pathogenicity to zebra fish of the resuscitative cells.The sensitivity of the resuscitative cells to UV,high temperature (42℃)and cold stresses did not change obviously when compared with that of the normal cells.Reverse transcription-polymerase chain reaction(RT-PCR)was used to identify expression level of virulence relatedtoxSandtoxRgenes of the resuscitative cells.The expressions oftoxSandtoxRgenes were not detected in the VBNC cells but in the resuscitative cells.The resuscitative cells retained their virulence when they were intraperitoneally inoculated into zebra fish.The LD50of the wild-type cells and the resuscitative cells was 4.80×106CFU per fish and 6.25×106CFU per fish respectively,which showed no significant difference.
Key words: Vibrio alginolyticus;VBNC;physiological characteristics;gene expression;pathogenicity
责任编辑 于 卫
Virulence Retention and Gene Expression of Vibrio alginolyticus VIB 283 Resuscitated from Viable but Nonculturable State
J IANG Ying-An1,CHEN Ji-Xiang1,J IA Jun-Tao2,GUO Qian-Ru3,ZHAO Ming-Jun1
(1.Ocean University of China,Qingdao 266003,China;2.Shandong Entry-Exit Inspection and Quarantine Bureau,Qingdao 266002,China;3.Guangdong Ocean University,Zhanjiang 524088,China)
O179.29
A
1672-5174(2010)09Ⅱ-142-05
国家自然科学基金项目(30972275);农业部公益性行业专项(nyhyzx 07-046);国家质检总局科研项目(2010IK180)资助
2009-12-09;
2010-05-25
姜荧安(1986-),女,硕士生,研究方向:海洋微生物学。E-mail:trick203@163.com。
Tel:+86-532-82031561;Fax:+86-532-82031561;E-mail:betcen@ouc.edu.cn

