柚皮苷和柚皮素在Caco-2细胞模型的吸收研究
易少凌
广东食品药品职业学院,广东广州 510520
柚皮苷和柚皮素在Caco-2细胞模型的吸收研究
易少凌
广东食品药品职业学院,广东广州 510520
目的:研究柚皮苷(Naringin)和柚皮素(Naringenin)在Caco-2细胞模型中的吸收特性。方法:用Caco-2细胞单层模型研究柚皮苷和柚皮素的双向转运,并考察柚皮苷和柚皮素随时间吸收的变化。用高效液相色谱法检测药物浓度,计算其表观渗透系数。结果:柚皮苷(50μM)、柚皮素(50μM)双向转运的浓度均随着时间增加而增加,柚皮苷的顶端→基底端(AP面→BL面)和基底→顶端(BL面→AP面)的表观渗透系数(Papp)均小于1.0×10-6cm.s-1,Papp(B-A)/Papp(A-B)约为0.4;柚皮素的顶端→基底端(AP面→BL面)和基底→顶端(BL面→AP面)的表观渗透系数(Papp)均位于1.0×10-6cm.s-1~10×10-6cm.s-1之间, Papp(B-A)/Papp(A-B)约为2.0。结论:柚皮苷属于吸收不良的药物,而柚皮素属于吸收中等偏差水平;柚皮素比柚皮苷更易被吸收,该药物的吸收情况与是否存在糖基有关;柚皮苷被小肠顶侧膜的转运载体所摄取,而柚皮素的吸收则兼有外排作用。
柚皮苷;柚皮素;Caco-2细胞模型;双向转运
柚皮苷(Naringin)又称柚苷、柑橘苷、异橙皮苷,主要存在与芸香科植物葡萄柚、橘、橙的果皮和果肉中,柚皮苷也是中草药骨碎补、枳实、枳壳、橘红的主要有效成分。各种植物中柚皮苷含量随品种、产地的不同而有较大差别,通常未成熟的果含量更高。柚皮素是柚皮苷的苷元。它们均具有抑制P450酶、抗炎、抗肿瘤、利胆、抗氧化等作用。
据文献报道,兔灌胃研究柚皮素的绝对生物利用度为4%~8%,但吸收机制不清楚。本实验旨在运用Caco-2细胞模型研究柚皮苷和柚皮素的吸收。
1 材料和方法
1.1 材料、仪器、设备
柚皮苷Naringin(Product of USA,含量95%);柚皮素Naringenin(Product of United Kindon,95%);橙皮素Hesperetin(Product of United Kindon,含量95%)。
DMEM培养基(Dulbecco’s Modified Eagle’s medium,GIBCO);胎牛血清(Fetal bovine serum,杭州四季清);非必需氨基酸(Nonessential amino acid,NEAA,GIBCO);胰蛋白酶(Trypsin,上海生工);β-Glucuronidase(product of England);MTT(四甲基偶氮唑盐,5mg/ml溶于PBS);HBSS(Hank’s balanced salt solution,PH7.2~7.4)(含有16g/L的NaCl、0.04g/L的KCl、0.20g/ L的MgSO4·7H2O、0.134g/L的KH2PO4·14H2O、0.35g/L的NaHCO3、2.38g/L的HEPES、0.14g/L的CaCl2、1.0g/L的D-葡萄糖,用NaHCO3调PH值,均为分析纯);二甲基亚砜、甲醇、乙腈、丙酮(均为色谱纯);NaH2PO4(北京益利精细化学品有限公司,分析纯,GB1267-77);磷酸(广州化学试剂厂,分析纯,20000101-3)。
Caco-2细胞(ATCC(American Type Culture Collection,USA));12孔Transwell(Corning Costar,Cambridge,MA,USA);培养箱(Heraeus,德国)。
1.2 细胞培养
Caco-2细胞在37℃,含5%的CO2环境中培养,用DMEM培养液。培养液中含10%胎牛血清、1%非必需氨基酸、2.38g/L的HEPES以及100U·ml-1青霉素和100μg·ml-1链霉素双抗液。当细胞生长至80%~90%融合时,用0.25%胰酶+0.02%EDTA液消化细胞,按1∶3传代培养,每两天换一次培养液。
1.3 细胞毒性实验
MTT实验是一种通过检测活细胞线粒体中琥珀酸脱氢酶的活性反映细胞活力的方法。上述培养的Caco-2细胞以1×104/孔接种于96孔培养板,于37℃,含5%的CO2环境中孵化36小时后去除培养基,分别加入含有不同浓度的柚皮苷、柚皮素的HBSS溶液200μl(含<1%的DMSO),每个浓度3孔,空白3孔。在培养箱中孵化3小时后结束,吸出药液,加入20μl含5mg/L MTT的PBS溶液继续孵育4小时后,去除MTT,每孔加入200μl DMSO溶解紫色结晶产物。用酶联免疫检测仪在590nm比色测定,以A药液/A空白-浓度绘图。
1.4 细胞模型转运试验
1.4.1 细胞模型的建立
上述培养的Caco-2细胞接种在12孔Transwell板上,接种密度为2×105/孔,内层加培养液0.5ml、外层加培养液1.5ml,第1周隔天换液,后2周每天换液,待生长至21天左右,细胞形成紧密的单层,可用于实验。
1.4.2 细胞单层完整性验证
在每种药物的转运实验进行前及结束后,均用EVOM(Epithelial voltammeter,WPI,Sarasota,FL,USA)测定在pH值为7.2~7.4时的跨上皮细胞电阻(transepithelial electrical resistance,TEER),确定单层细胞的紧密性与完整性。
1.4.3 双向转运试验
运用柚皮苷和柚皮素的跨膜通透率作为检测其转运情况的标准。在pH值为7.2~7.4的情况下,进行柚皮苷和柚皮素从Caco-2细胞单层顶端(A面)→基底端(B面) 以及基底端(B面)→顶端(A面)的转运实验。实验前,细胞用HBSS(pH7.2~7.4)液小心冲洗3次,最后1次在37℃培养箱中孵育0.5h。顶端(A面)→基底端(B面):在A面分别加0.5ml的柚皮苷(29μg/ml,50μM)或柚皮素(13.6μg/ml,50μM);B面加1.5ml的HBSS液。基底端(B面)→顶端(A面):在B面分别加1.5ml的柚皮苷(29μg/ml,50μM)或柚皮素(13.6μg/ml,50μM);A面加0.5ml的HBSS液。放入培养箱37℃孵育,分别于30min、60min、90min、120min从B面或者A面取样检测。
1.5 样品浓度测定
1.5.1 测定前处理
200μl样品,其中80μl直接进样,120μl经酶水解后进样。处理方法如下:取样品100μl于离心管中,加10μl 10μg/ ml的内标(橙皮苷),加5 000U/ml的酶50μl,于37℃中水解4h,加10μl pH4.55HAc,涡旋30s,加300μl丙酮,涡旋1min,10 800rpm,离心10min,取上清液,氮气吹干,加150μl CH3OH : pH2.55磷酸缓冲液(1:1),涡旋30s,10 800r/s,离心5min,取上清液,进样100μl。
1.5.2 分析方法及条件
柚皮苷和柚皮素均使用HPLC测定浓度。Waters高效液相色谱系统:Waters 600 Controller、Waters 717 plus自动进样器、Waters 486紫外检测器、Waters Millennium 32色谱数据处理软件;色谱柱(Thermo, Part No. 28 105-254 630)。流动相:甲醇(A):PH2.55NaH2PO4(B):乙腈(C),梯度洗脱,从0min~18min,A从45%~13%,B从55%~37%,C从0%~50%;从18min~20min,A从13%~45%,B从37%~55%,C从50%~0%,然后以这个比例平衡10min。
1.6 表观渗透系数
根据下式计算得药物的表观渗透系数Papp(apparent permeability coefficients ): Papp= (dQ/dt )/(A×C0)。其中:C0是药物所在端(donor)的初始浓度,dQ为药物在dt时间段内在接受端(receiver)透过量, A是Transwell多聚碳酸酯膜的表面积。
2 结果
2.1 药物含量测定
2.1.1 专属性
专属性实验显示柚皮苷、柚皮素和橙皮苷出峰处,均未出现干扰峰,且在该条件下柚皮苷、柚皮素和橙皮苷完全分离(图1)。
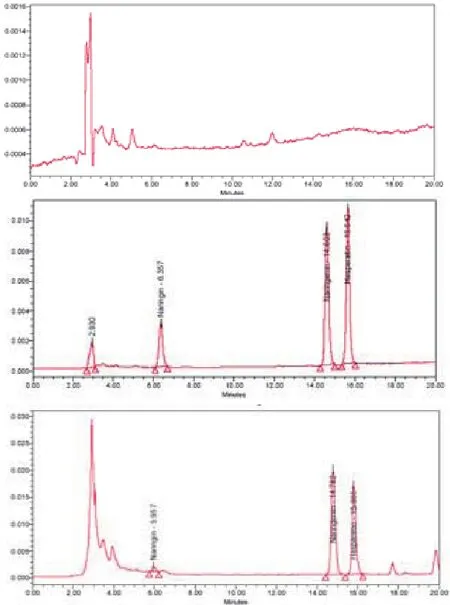
图1 Naringin、Naringenin 的HPLC图谱
2.1.2 未水解样品的标准曲线制备及精密度考察
制备浓度梯度为0.01、0.025、0.05、0.1、0.25、0.5、1、5g ·L-1的柚皮苷与柚皮素的HBSS溶液1ml作为标准曲线样品。直接进样50μl分析,以已知浓度为横坐标,所得峰面积为纵坐标,用加权最小二乘法进行回归运算,求得直线回归方程。柚皮苷的标准曲线为 y = 79568x+760.05,R2=0.9999,Nringenin的标准曲线为y = 180748x+1120.2,R2=1,该法线性好,线性范围均为0.01μg · ml-1~5.0μg· ml-1;绝对回收率大于70%;高(5μg· ml-1)、中(0.25μg· ml-1)、低(0.025μg· ml-1)3个浓度的日内、日间精密度均小于10%。符合生物样品分析的一般要求。
2.1.3 已水解样品的标准曲线制备及精密度考察
制备浓度梯度为0.01、0.025、0.05、0.1、0.25、0.5、1、5 g ·L-1的柚皮苷和柚皮素 的HBSS溶液1ml作为标准曲线样品。依(样品处理)的方法将标准曲线样品经酶水解后进样100μl分析,以已知浓度为横坐标,所得药物峰面积与内标峰面的比值为纵坐标,用加权最小二乘法进行回归运算,求得直线回归方程。柚皮苷的标准曲线为 y =0.4548x+0.0103,R2=0.9998,Nringenin的标准曲线为y =1.1638x+0.0381,R2=0.9998,该法线性好,线性范围均为0.01μg· ml-1~5.0μg· ml-1;绝对回收率大于75%;高(5μg· ml-1)、中(0.25μg· ml-1)、低(0.025μg· ml-1)3个浓度的日内、日间精密度均小于10%。符合生物样品分析的一般要求。
2.2 Caco-2细胞毒性实验
当药物浓度对细胞无毒时,A药液/A空白>=1。细胞毒性实验显示,柚皮苷浓度 <30μg/ml时,A药液/A空白>=1;柚皮素浓度<15μg/ml时,A药液/A空白>=1。该结果说明在实验浓度下药物对Caco-2细胞无毒性。
2.3 单层细胞完整性的验证
在进行柚皮苷和柚皮素的Caco-2细胞转运实验之前,测定了单层细胞的胯膜电阻(TEER)以验证细胞膜的完整性,其TEER的值大于200Ω·cm2(在200Ω·cm2~500Ω·cm2之间),该细胞模型完整性在要求范围内,可用于进行双向转运实验。
2.4 柚皮苷、柚皮素双向转运实验
Caco-2细胞模型对柚皮苷和柚皮素的双向转运实验结果显示,柚皮苷(50μM)、柚皮素(50μM)双向转运的浓度均随着时间增加而增加,并在120min内呈线性增加趋势,其线性回归相关系数达0.9以上(图2),未出现饱和现象。Caco-2细胞模型对柚皮素的双向转运实验中,样品未经水解直接HPLC测定的图谱中发现了柚皮苷峰,且其浓度随着柚皮素吸收的增加而增加。柚皮苷的顶端→基底端(AP面→BL面)和基底→顶端(BL面→AP面)的表观渗透系数(Papp)均小于1.0×10-6cm·s-1, Papp(B-A)/Papp(A-B)约为0.4;柚皮素的顶端→基底端(AP面→BL面)和基底→顶端(BL面→AP面)的表观渗透系数(Papp)均位于1.0×10-6cm ·s-1~10×10-6cm·s-1 之间, Papp(B-A)/Papp(A-B)约为2.0(表1,表2)。
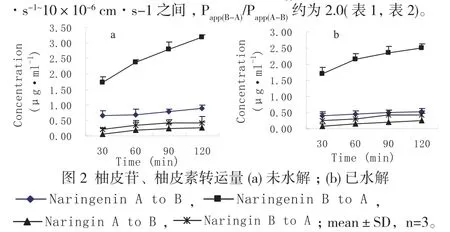
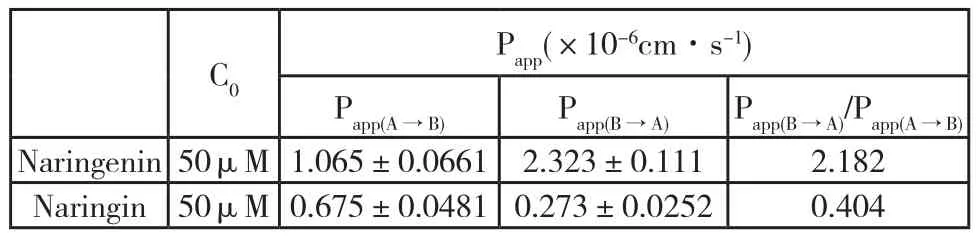
表1 柚皮苷、柚皮素的Papp值(未水解),mean±SD,n=3
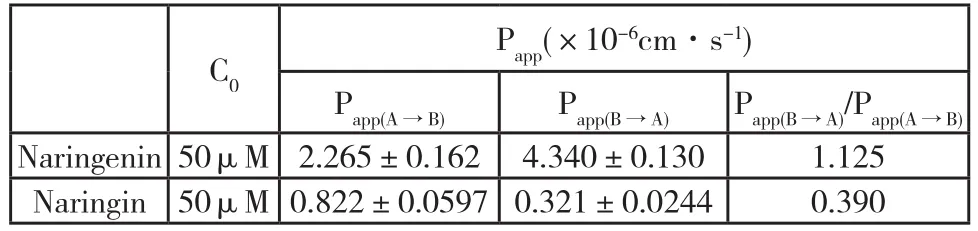
表2 柚皮苷、柚皮素的Papp值(已水解),mean±SD,n=3
3 讨论
Caco-2细胞来源于人类结肠癌细胞,其结构和生化特点类似于人类小肠上皮细胞,含有与小肠刷状缘上皮相关的酶,能够在细胞水平提供关于药物分子通过小肠粘膜的吸收、代谢、转运信息。该模型操作简便,重现性好,可评价不同实验条件下药物的跨膜转运速率。
Caco-2细胞模型中,通常用Papp来评价药物在肠道的吸收情况,FÊger等和Artursson 等用Caco-2细胞模型研究了多种不同结构药物的转运机制,发现Papp值为5×10-8cm·s-1~5×10-5cm·s-1。经过与体内结果进行比较发现,吸收为1%~100%的药物,其Papp为(0.1~10) ×10-6cm·s-1;而吸收差的药物(即吸收< 1% )的Papp< 10-7cm·s-1。因此,根据实验结果,柚皮苷属于吸收不良的药物,柚皮素比柚皮苷更易被吸收,柚皮素属于吸收中等偏差水平,这与动物实验结果相符(柚皮素兔灌胃的绝对生物利用度为4%~8%)。
理论认为,Papp(A→B)与Papp(B→A)接近时,化合物以被动扩散方式转运; Papp(A→B) 明显大于Papp(B→A)时,化合物被小肠顶侧膜的转运载体所摄取;Papp(B→A)明显大于Papp(A→B)时,化合物被小肠顶侧膜的转运蛋白外排。双向转运实验结果表明,柚皮苷Papp(B→A) /Papp(A→B)约为0.4,说明柚皮苷被小肠顶侧膜的转运载体所摄取;而柚皮素Papp(B→A)/ Papp(A→B)约为2.0,提示其在小肠吸收转运过程中受到外排性转运蛋白的影响。
在柚皮素的转运实验中,发现了柚皮苷峰,且随着柚皮素吸收的增加而增加,这可能是因为柚皮素通过细胞时在酶的催化下发生了第Ⅱ相反应(即结合反应)的葡萄糖醛酸反应,但需要更进一步的实验验证。
综上所述,柚皮苷属于吸收不良的药物,柚皮素属于吸收中等偏差水平;柚皮素比柚皮苷更易被吸收,该药物的吸收情况与是否存在糖基有关;柚皮苷被小肠顶侧膜的转运载体所摄取,柚皮素的吸收兼有外排作用;柚皮素通过细胞时可能在酶的催化下发生了第Ⅱ相反应(即结合反应)的葡萄糖醛酸反应,但需要更进一步的实验验证。本实验对研究两种药物在人体中的生物利用度和吸收机制均具有一定的参考作用。
[1]龚盛昭,陈秋基,曾海宇.柚皮中有效成分综合利用的途径[J].广州食品工业科技,2003(19):81-82.
[2]Su-Lan Hsiu,Tang-Yen Huang, Yu-Chi Hou,Der-Hang Chin, Pei-DaWn Lee Chao Comparison of metabolic pharmacokinetics of naringin and naringenin in rabbits[J]. Life Sciences,2002 (70):1481-1489.
[3] Artursson P, Karlsson J. Correlation betWeen oral drug absorp tion in humans and apparent drug permeability coefficients in human intestinal ep ithelial (Caco-2) cells [J].B iochem B iophys Res Comm un,1991, 175(3):880-885.
[4] FÊger F, Kopf A, Loretz B, et al. Correlation of in vitro and in vivo models for the oral absorp tion of pep tide drugs [J]. Am ino Acids, 2008,35(1):233 - 241.
[5]李峥,庄笑梅,李素云.噻吩诺啡在Caco-2细胞上的转运特征[J].中国药理学与毒理学杂志,2010(24):64-68.
Q946
A
1674-6708(2010)24-0131-03

