槲皮素包合物的研究进展
翟广玉,马岩,闫臻,段艳丹
(1.郑州大学护理学院,河南郑州450052;2.郑州大学药学院,河南郑州450052;3.郑州市妇幼保健院,河南郑州450012)
槲皮素包合物的研究进展
翟广玉1,马岩2,闫臻3,段艳丹1
(1.郑州大学护理学院,河南郑州450052;2.郑州大学药学院,河南郑州450052;3.郑州市妇幼保健院,河南郑州450012)
综述了国内外槲皮素包合物的研究概况。为了改善槲皮素的水溶性,人们把槲皮素与环糊精及其衍生物制成包合物。如槲皮素与β-环糊精(β-CD)、α-环糊精(α-CD)、部分甲基化-β-环糊精(M-β-CD)、羟甲基-β-环糊精(HP-β-CD)、硫代丁基-β-环糊精(SBE-β-CD)等制成包合物,使槲皮素的水溶性明显提高,更有利于在体内的吸收,提高了生物利用率。
槲皮素;环糊精及其衍生物;包合物;研究进展
前言
槲皮素(Quercetin)是植物中分布极广的黄酮类化合物,广泛存在于蔬菜、水果和中草药中,如圆葱、葡萄、三七和银杏等都含有槲皮素。槲皮素化学名为3,5,7,3’,4’-五羟基黄酮,多以苷的形式存在,如芦丁(芸香苷)、槲皮苷、金丝桃苷等。槲皮素具有较好的祛痰、止咳和平喘作用,还有降低血压、减少毛细血管脆性、降血脂、扩张冠状动脉、增加冠脉血流量等作用[1]。槲皮素作为一种非常有药用潜力的天然黄酮类化合物,一直被广泛关注。近年研究表明,槲皮素在癌症防治上具有重要作用。由于槲皮素的水溶性极差(<7μg/mL),药代动力学性质导致了生物利用度较低(<3.6%),所以槲皮素在临床上的使用受到了极大的限制。故以槲皮素为先导化合物对其进行结构修饰,合成出水溶性增强,药代动力学性质改善的槲皮素包合物,对于槲皮素的临床应用具有极其重要的意义。
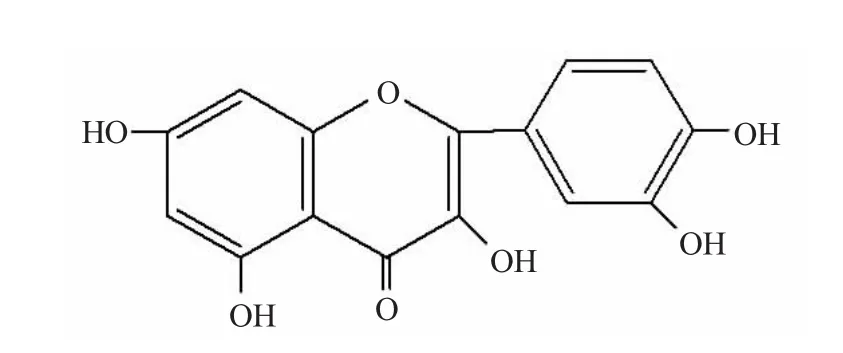
图1 槲皮素的结构Fig.1 Structure of quercetin
1 国内研究概况
1988年闫汝南等[2]为了改善槲皮素的溶解度,将槲皮素与β-CD形成包合物或与PVP形成复合物后,水溶性明显增加。在体外人工肠液中,溶解速率也明显增加。
1998年邵伟等[3]用恒温回流的方法制备了槲皮素β-环糊精包合物。经红外光谱和差示扫描量热图谱分析等方法对包合物进行了鉴定。经包合反应的热力学研究证明槲皮素β-CD包合物的物质的量组成为1∶1。含量及溶解度的测定确定包合物中槲皮素的含量为15.95%(质量百分含量),β-CD对槲皮素的包合率为76.06%。槲皮素β-CD包合物的溶解度为23.15μg/mL,比槲皮素的溶解度2.78μg/mL增加了8.33倍。
2001年姜新道等[4]用搅拌-浓缩-减压干燥的方法制备了槲皮素部分甲基化β-CD包合物。实验确定了形成包合物的比例为1∶1。经红外光谱和差示扫描量热图谱分析等方法对包合物进行了鉴定,表明槲皮素与部分甲基化β-环糊精已形成包合物。溶解度测定证明,槲皮素在水中的溶解度大大增加了。
2002年邵伟等[5]用溶液-搅拌法制备出槲皮素羟丙基-β-环糊精包合物,经红外光谱测试、差热分析等方法对包合物进行了鉴定和确证,表明槲皮素与羟丙基-β-环糊精已形成包合物,含量测定证明包合物主、客分子比为1∶1,槲皮素-羟丙基-β-环糊精包合物可明显提高槲皮素的溶解度,槲皮素的溶解度由原来的0.0392 mg/mL增至包合后的34.227mg/mL。
2002年王茹林等[6]用相溶解的方法研究黄酮类化合物与β-CD及其衍生物的包合作用。用相溶解图表显示β-CD和芦丁,槲皮素,桑色素形成1∶1包合物,包合物似乎是AL包合的一种类型。β-CD衍生物比β-CD有更强的包合能力。包合物相溶解的下降顺序为:M-β-CD>HP-β-CD>β-CD。其中,M-β-CD与槲皮素形成的包合物溶解度最高,是槲皮素在水中的50倍。
2003年双少敏等[7]用荧光光谱法和热力学系统研究黄酮类化合物(芦丁,槲皮素,桑色素和羟乙基-芦丁)与β-CD和它的衍生物HP-β-CD,CM-β-CD的包合行为,并检测了包合物的化学计量比和包合常数。结果显示化学计量比为1∶1,CD衍生物有较强的结合能力。根据热力学参数(△G°<0,△H°<0,△S°<0或△S°>0),该包合反应属于放热反应。
2003年宋全道等[8]合成出了槲皮素部分甲基化β-环糊精包合物。根据形成包合物时主客分子的平衡浓度的关系,确定包合物中主客分子的物质的量比。结果显示∶槲皮素与部分甲基化β-环糊精以1∶1的物质的量比形成包合物,包合稳定常数为5142 L·mol-1,不溶于水的槲皮素包合后其溶解度增加到0.192g·L-1。
2004年刘秀萍等[9]采用荧光光谱法研究了β-环糊精及其衍生物与槲皮素的包合作用,测定了包合物的形成常数,并用等物质的量连续变化法确定了包合物形成的计量比,探讨了有机小分子醇对包合过程的影响。结果表明:槲皮素环糊精包合物包合能力强弱顺序为:HP-β-CD>M-β-CD>β-CD,脂肪醇对槲皮素环糊精包合物包合作用的影响与其所含碳数及体积有关。
2005年ZhengYing等[10]研究了β-环糊精,羟丙基β-环糊精,硫代丁基β-环糊精的化学稳定性对槲皮素溶解度的影响,解释了槲皮素与这些β-环糊精的包合机理。在溶液中槲皮素-β-环糊精包合物的特性由稳定性评价,相溶解的测定由氢谱进行表征。使用分子模型确立了β-环糊精与槲皮素相互作用的模型。形成包合物后,槲皮素的溶解度提高了,顺序为SBE-β-CD>HP-β-CD>β-CD。质谱分析显示,槲皮素的B,C和A环与β-环糊精的疏水活性基团表现出良好的相互作用。这是使用槲皮素-β-环糊精包合物的溶剂化模型通过分子动力模拟确定的。确立了包合物模型,可以解释β-环糊精在水中与槲皮素的包合作用,使其稳定性和溶解度增大。
2006年崔山风等[11]分别以溶液搅拌法和有机溶剂挥发法制备了槲皮素包合物。用相溶解度法判断槲皮素与β-CD、HP-β-CD形成包合物的物质的量比,并借助红外扫描法对包合物进行鉴定。经IR扫描发现:包合物已经形成,槲皮素与β-CD、HP-β-CD形成包合物的物质的量比1∶1,槲皮素HP-β-CD包合物在水中的溶解度更大些。
2006年杨照罡等[12]采用研磨法制备包合物,对其包合常数进行测定。差热分析(DSC)结果表明包合物中槲皮素吸热峰位前移,IR图谱槲皮素羰基吸收峰产生位移,X-衍射图谱包合物中槲皮素吸收峰消失,电镜扫描照片包合物中未见槲皮素晶体,说明形成新物相。结果显示制备的包合物溶解度较槲皮素纯品增加约37倍,5min的溶出百分率较槲皮素纯品提高近10倍。
2006年闫春丽等[13]用PM3量子力学的方法研究槲皮素β-环糊精的稳定结构和包合过程。稳定性的驱动力是分子间氢键的形成。分子模型与NMR观察数据和分子动力学(MD)模拟结果一致,即客体分子的B环位于β-CD空腔的第二个羟基附近时的键合能量是最好的。用PM3在1atm和298.15K条件下的热力学统计计算证明,槲皮素β-环糊精是以1∶1包合的,过程本质是向焓变有利的方向进行的。
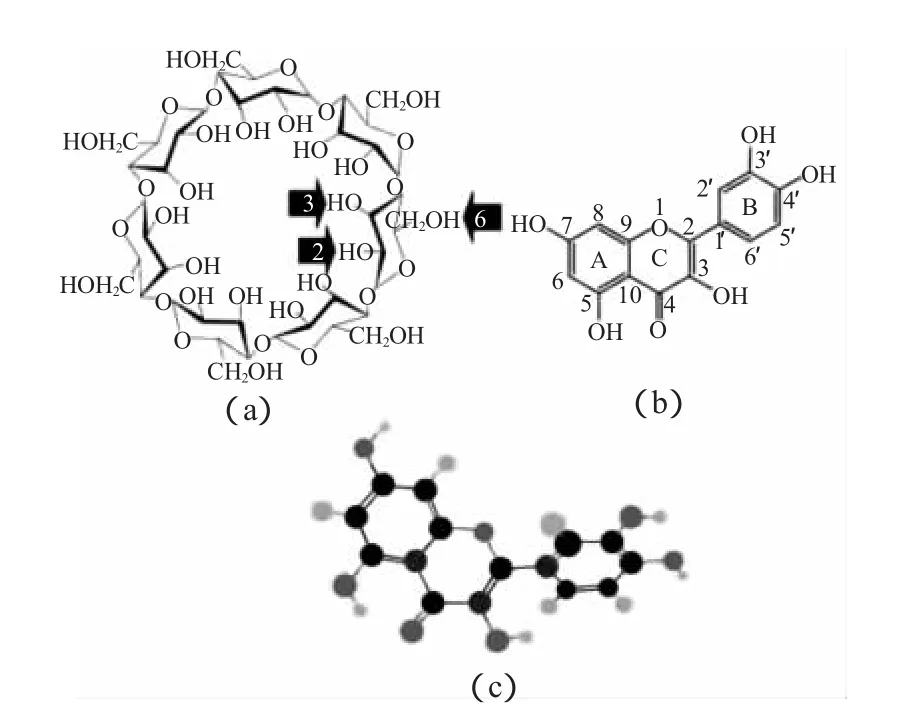
图2 (a)环糊精的分子结构,(b)和(c)槲皮素的分子结构Fig.2 Molecular structures of β-cyclodextrin(a),quercetin(b)and
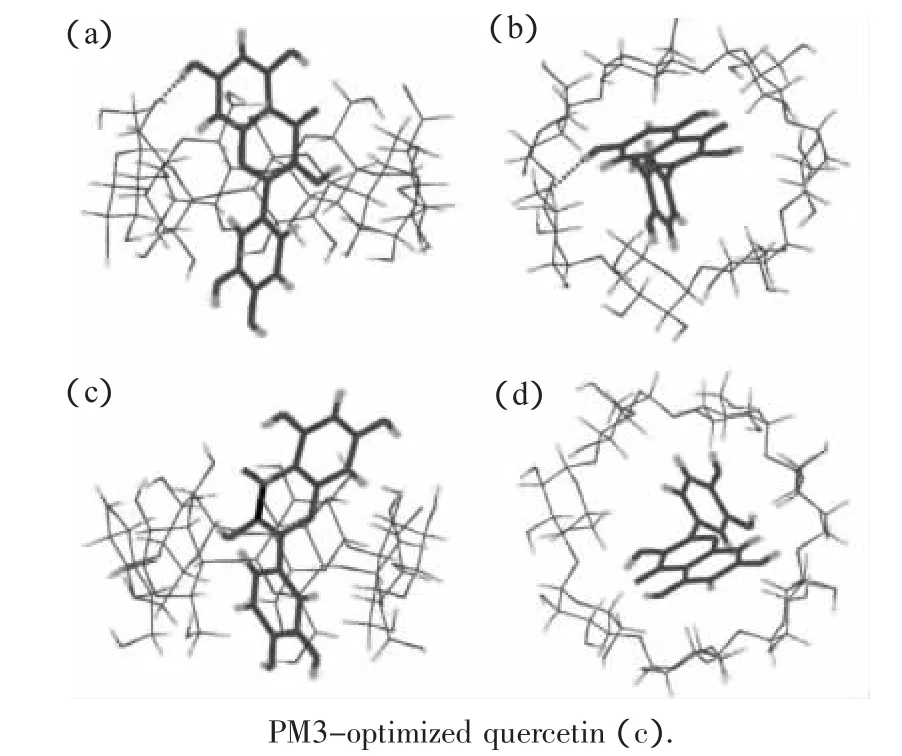
图3 槲皮素—β—环糊精包合物的结构Fig.3 Structures of the quercetin and β-cyclodextrin inclusion complex
2007年吴春等[14]为了改善槲皮素的水溶性,将其制成β-环糊精包合物,使其在水中的溶解度由2.86μg/mL提高到24.01μg/mL。在模拟人体胃液的条件下,研究了包合物对亚硝化反应的抑制作用。结果表明:槲皮素-β-环糊精包合物对亚硝胺的合成具有明显的抑制作用,其最大阻断率为90.5%,对亚硝酸钠具有较好的清除活性,最大清除率为85.4%。
2007年闫春丽等[15]基于PM3和UNIUM2方法,研究了槲皮素和β-环糊精之间的包合作用。得到的结果清楚显示,客体分子的B环位于β-环糊精空腔的第二个羟基附近,这样键合的能量更好些。分析认为,这个包合物结构应该是槲皮素的-7-羟基与β-环糊精的-6-羟基形成了氢键,这个氢键在槲皮素β-环糊精包合物的键合中起重要作用。
2 国外研究概况
1990年Fukazawa Ryutaro等[16]研究了利用槲皮素环糊精包合物储藏食物。方法:把100gβ-环糊精的水溶液与26.5g槲皮素丙酮溶液在50℃混合,20℃搅拌5h,或者5℃搅拌12h可以制成包合物。把1kg的凤尾鱼放入含1.7g包合物的2L5%的Na-Cl溶液中于95℃煮10min,然后30℃干燥17h,可防止凤尾鱼中的脂肪被氧化,防氧化超过30d。
1994年Tanaka Takemi等[17]研究认为含有槲皮素-β-环糊精包合物的食品颜色更稳定,可耐光、耐热和耐化学物质。把槲皮素溶液与环糊精水溶液混合,搅拌,即制成环糊精槲皮素包合物,加入颜料可制成有颜色的基料,这种基料可以加入到各种食品中制成有色食品。例如:100g糖加入0.2g柠檬酸、0.05g苹果酸、10mL柠檬汁制成200mL混合汁基,加入1%碳酸氢钠调pH=7.0。一份汁基,四份水,加入已经溶解好的槲皮素或者槲皮素-β-环糊精包合物溶液,混合均匀即可得到黄色饮料。把这种饮料倒进玻璃瓶中,密封。在阳光下放置3个星期而不发生变化。在阳光下,加入槲皮素-β-环糊精包合物比只加入槲皮素的饮料更稳定。
1998年Indap MA等[18]研究认为槲皮素是一种广泛分布的生物黄酮,具有抑制肿瘤细胞生成的作用。现在设计研究槲皮素环糊精包合物对老鼠肿瘤的生成抑制。这种包合物的LD10是50mg/kg,这个剂量对肿瘤的生成抑制观察没有显著的现象。可是,制备提供在老鼠骨髓瘤的抑制剂产生的辐射防护是有效的。结果显示,添加槲皮素环糊精包合物将改进肿瘤放射治疗的效果。
1998年Assi Abdel-Azim等[19]研究槲皮素与β-环糊精作用后的抗炎效果。槲皮素是一种天然存在的具有药理作用的无毒黄酮类化合物,用不同炎症模型评价它的抗炎活性。向大鼠右边大腿爪子注射卡拉胶,葡聚糖,血小板活化因子以及高岭土诱导产生炎症,另外研究了槲皮素-β-环糊精包合物,并用吡罗昔康和吲哚美辛做对照药物。试验结果显示,槲皮素不是通过抑制环氧合酶发挥作用的,槲皮素(30 mg/kg,p.o)抑制早期高岭土引起的水肿,而吡罗昔康(10 mg/kg,p.o.)和吲哚美辛(10 mg/kg)抑制后期。证实了槲皮素的抗炎活性,同时指出它的作用机理至少不同于非甾体抗炎药。由得到的包合物在水中的平衡相溶解图表可知,槲皮素溶解度提高了,显示A型相图。由曲线最初的直线部分的斜率计算稳定常数Kc为263M-1,这与紫外光谱所得结果237M-1一致。因此,槲皮素-β-环糊精包合物提高了槲皮素水溶性,抗炎活性,反过来也提高了口服生物利用度。
2000年Bergonzi,Maria C等[20]研究天然黄酮醇和α-,β-和γ-环糊精之间的相互作用。黄酮醇极性大,但水溶性很低。酚性活性成分广泛分布在天然苷元和糖苷中,也是许多中药的标志成分。研究的主体分子是高良姜素,山奈酚,槲皮素和芦丁,并用不同的物理方法混合,捏合和冷冻方法制备包合物。β-环糊精黄酮醇用不同的理化方法表征。如:DSC、IR、NMR(1H-NMR、13C-NMR、COSY、NOESY、HM QC)光谱。以前,只有少数研究报告关于环糊精黄酮醇包合物,主要用色谱方法。但色谱方法不能给出主客分子相互作用的充分信息。
2001年Khaled Khaled A等[21]研究认为槲皮素是一种很有治疗活性的天然黄酮。可是,它的溶解度是有限的,很难吸收。通过制备聚乙二醇(PEG),HP-β-CD,聚乙烯吡咯烷酮(PVP)与槲皮素共混,增加了槲皮素的溶解度和水溶性。提高了生物利用率。通过X-线衍射,IR光谱进行了表征,溶解度和水溶性对所有体系都有显著提高。PVP体系显示出最大的影响,PEG体系显示出较低的影响。增加槲皮素的溶解度与添加赋形剂有关,在PEG和HP-β-CD的AL型相图上,PVP在AP型相图上显示出来。产物的仪器分析显示,在无定形状态中,HP-β-CD和PVP仍然存在。IR显示,药物的酚羟基与PEG和HP-β-CD的伯羟基,与PVP的羰基形成了氢键。
2002年Indap MA等[22]研究了槲皮素与羟丙基β-环糊精包合物的一般毒性和抗肿瘤活性。槲皮素的包合物最大致死量400mg/kg没有发现毒性,游离的槲皮素只能使用很少的量,因为它的水溶性太差。对于槲皮素的羟丙基β-环糊精包合物最大容许剂量是10~400mg/kg。一次性使用时,毒性比槲皮素还小的多。在体外实验显示,槲皮素羟丙基-β-环糊精降低了K-562和B16F10里的瘤细胞。
2004年CalabroM L等[23]通过共蒸发技术获得了槲皮素与α,β-环糊精的包合物。使用不同的分析技术(差示扫描量热法,X-衍射法,IR、1H-NMR、UV-Vis),通过分子结构特征的研究,清楚显示出“主”“客”体特征的波谱形状。通过溶解度的测定,描述了配合物形成的化学计量比率和稳定常数。在所有的图形中,配合比是1∶1。通过几种不同的生物分析方法(红赫晓啉试验,谱带分析)评价了黄酮的抗氧化活性。槲皮素与环糊精包合后,进一步改进了在部分生物体内抗氧化活性,增加了药物的溶解度。
2004年Pralhad Tayade等[24]用冷冻干燥的方法制备药物环糊精固体系统。用相溶解的方法计算包合物的化学计量比和稳定常数:槲皮素β-CD(1∶1,402M-1),槲皮素HP-β-CD(1∶1,532M-1),并用FT-IR、DSC、X-线衍射和SEM证实了在固态条件下形成这两个包合物。
2005年AlvarezParrilla Emilio等[25]研究了苹果多酚的配合物和抗氧化活性。用荧光光谱和FRAP技术研究绿原酸(CA)、芦丁(Rt)、槲皮素(Qc)与β-CD的包合物。所有多酚均形成的包合物化学计量比都是1∶1。他们的稳定常数下降顺序为Qc(1138M-1)>CA(465M-1)>Rt(224M-1),用DSC在固态条件下测量,确定了包合物的形成。Qc显示最高的抗氧化活性,Rt和CA次之。所有的包合过程显示它们的抗氧化活性均有轻微提高(在7%~14%之间),Rt和CA比Qc更明显些。
2006年Kale Rajendrakumar等[26]研究证明槲皮素环糊精包合物可抑制体内和体外人类癌细胞的增长。用一般药物和它的溶解形式对不同来源的人类细胞系做体外抗增殖研究,并且用老鼠黑素瘤模型研究体内肿瘤抑制。制备的配合物极大提高了槲皮素的溶解度和释放速度,降低了形成药物结晶量。SBE-β-CD的槲皮素包合物对人类白血病和子宫颈癌细胞的增殖具有极大的抑制作用。口服槲皮素后,老鼠黑素瘤内肿瘤降低,减少了肿瘤细胞的增殖。槲皮素SBE-β-CD包合物比普通药物能显示出极大的抗癌活性,为低剂量提供依据。试验证明用环糊精包合后不影响治疗效果。
2007年Jullian Carolina等[27]认为槲皮素水溶性极低,对槲皮素和β-CD、HP-β-CD、SBE-β-CD的包合物抗氧化活性进行研究。用来描述包合物形成程度的化学计量比和稳定常数已用相溶解测量。AL型相图显示包合物的化学计量比均为1∶1,实验结果显示包合能力SBE-β-CD>HP-β-CD>β-CD,药动学结果显示槲皮素SBE-β-CD包合物是活性最强的。用ESR光谱研究槲皮素环糊精包合物的净化能力,结果与槲皮素在水中相比,所有包合物均显示出具有(去掉)更高的清除能力。除此之外,这些结果也显示所形成的包合物保持着槲皮素的抗氧化活性。
2007年Sri K Vijaya等[28]通过捏合和共蒸发的方法制备环糊精的包合物以改善槲皮素和芦丁的水溶性及难溶的性质。包合物的特性通过溶解度分析,X-线粉末衍射,差示扫描量热法,傅里叶变换红外光谱而表征。包合物比配位体混合物和纯药物显示出更高的溶解度。
2008年Dias等[29]合成了槲皮素铝β-环糊精包合物并用IR、UV-vis、1H、13 C NMR和TG、DTA对它们的特征进行分析。用相溶解度研究方法观察槲皮素铝β-环糊精包合物化学计算1∶1包合形成,AL型相图表明形成1∶1包合并可以计算稳定常数。由依赖温度的稳定常数而得到的热力学参数和实验结果显示,包合物形成是热力学焓驱动过程。槲皮素铝配合物的IR显示黄酮类化合物和金属的作用涉及到羰基的氧原子。槲皮素铝β-环糊精包合物的IR显示黄酮类化合物的芳香环位于主体分子约束的环境内。IR、TG和DTA数据证明槲皮素铝β-环糊精包合物以固体状态形成。与它们各自的前体相比,固态槲皮素铝β-环糊精包合物的热分解发生在不同的阶段,这证明了包合物真的形成了。这些技术显示包合物是通过黄酮类化合物的B环形成的。
2008年Lucas-Abellan Carmen等[30]在酸性pH条件下,研究了槲皮素和杨梅酮的环糊精包合作用,并用酶系统山葵过氧化物酶表征了体外制备的该包合物。在H2O2存在下,该酶可使黄酮醇氧化。反应介质中环糊精的存在可抑制黄酮醇的氧化,因为黄酮醇的包合发生在环糊精的水不溶性腔内,抑制效果依赖于黄酮醇和所用环糊精类型之间的包合常数Kc。在环糊精存在下得到非线性抑制曲线并计算了它们的Kc,顺序为:HP-β-CD>麦芽糖(maltosyl)-β-CD>β-CD。而且计算HP-β-CD和槲皮素或杨梅酮的包合效能(CE)值各自为267.4和5.3。这表明在该研究条件下,尽管它们的Kc值非常接近,但槲皮素与HP-β-CD包合效果比杨梅酮更好些。
3 结束语
通过恒温回流、研磨法、溶液搅拌法、挥发法、捏合法、共蒸发法或者冷冻干燥法等技术可以制备槲皮素与环糊精、部分甲基化环糊精、羟乙基环糊精、硫代丁基环糊精等包合物,使槲皮素的水溶性大大增加,显著地提高了槲皮素的生物利用度。通过红外光谱、紫外可见光谱、核磁共振谱、荧光光谱、差示扫描量热法、X—衍射法等表征了槲皮素包合物的结构特征。
[1]崔山风.槲皮素的研究进展[J].西北药学杂志,2006,21(6):279~281.
[2]闫汝南,夏开源,程兴全.芦丁和槲皮素溶解度的改进[J].中草药,1988,19(11):492~494.
[3]邵伟,王金山,王春香,等.槲皮素-β-环糊精包合物的研究[J].高等学校化学学报,1998,(7):1101~1103.
[4]姜新道,刘振胜,王芬,等.槲皮素-部分甲基化-β-环糊精包合物的研究[J].山东医药工业,2001,20(3):3~4。
[5]邵伟,谢清春,王春香,等.槲皮素-羟丙基-β-环糊精包合物的研究[J].中药材,2002,25(2):121~123.
[6]王茹林,杨郁,双少敏,等.β-环糊精衍生物对黄酮类药物的增溶作用[J].应用化学,2002,19(7):702~704.
[7]双少敏,徐文祥,张国梅,等.黄酮—环糊精包合作用的热力学研究[J],山西大学学报:自然科学版,2003,26(3):196~199.
[8]宋全道,丁易,米广太.槲皮素-部分甲基化β-环糊精包合物的研究[J].山东大学学报:医学版,2003,41(3):206~207.
[9]刘秀萍,张国梅,杨郁,等.脂肪醇对槲皮素-环糊精包合物包合作用的研究[J].光谱学与光谱分析,2004,24(3):323~326.
[10]ZHENG YING,HAWORTH,IAN S,et al.Physicochemical and structural characterization of quercetin cyclodextrin complexes[J].Journal of Pharmaceutical Sciences,2005,94(5):1079~1089.
[11]崔山风,胡英,戴义.槲皮素包合物的制备工艺及增溶作用研究[J].中国药师,2006,9(8):701~702.
[12]YANG ZHAO-GANG,AWUTI GULISITAN,CAO YI,et al.Preparation and physicochemical characterization of quercetin HPCD inclusion complexes[J].Journal of Chinese Pharmaceutical Sciences,2006,15(2):69~75.
[13]YAN CHUNLI,LI XIAOHUI,XIU ZHILONG.A quantummecha nical study on the complexation of cyclodextrinwith quercetin[J].Theochem,2006,764(1~3):95~100.
[14]吴春,徐丽萍,聂芊.槲皮素-β-环糊精包合物作为亚硝化反应的抑制剂研究[J].食品与发酵工业,2007,33(7):78~80.
[15]YAN CHUNLI,XIU ZHILONG,LI XIAOHUI.Theoretical study for quercetin/-cyclodextrin complexes:quantum chemical calculations based on the PM3 and ONIOM2 method[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2007,58(3~4):337~344.
[16]FUKAZAWA RYUTARO,FUTASE TAKAO.Preservation of foods with cyclodextrin-quercetininclusion compound:JP,02268643A[P].1990-11-02.
[17]TANAKATAKEMI,OKEMOTOHISASHI,KUWAHARA NOBUHIRO.Quercetin-containing coloring:JP,93-59421[P].1993-02-25.
[18]INDAP M A,BHOSLE SUNITA C,VAVIA P R.Quercetincyclodextrin complex and it's chemotherapeutic investigations in cancer[J].Indian Drugs,1998,35(9):545~549.
[19]ASSI ABDEL-AZIM,EI-SAYED A M.Evaluation of the antiinflammatory profile of quercetin enhancing its effects by-cyclodextrin[J].Journal of Drug Research,1998,22(1~2),293~320.
[20]BERGONZI MARIA C,BILIA ANNA R,MAZZI GIOVANNI.Studies on the interactions between some flavonols and cyclodextrins[J].Proceedings of the Phytochemical Society of Europe,2000,46:201~209.
[21]KHALED KHALED A,MAHROUS GAMAL M.Comparative study of the dissolution and physicochemical characteristics ofthe binary systems of quercetin with p olyethylene glycol,polyvinylpyrrolidone,and hydroxypropyl cyclodextrin[J].Saudi Pharmaceutical Journal,2001,9(1):34~42.
[22]INDAP M A,BHOSLE SUNITA C,TAYADE P T.Evaluation of toxicity and antitumour effects of a hydroxypropyl-cyclodextrin inclusion complex of quercetin[J].Indian Journal of Pharmaceutical Sciences,2002,64(4):349~353.
[23]CALABRO M L,TOMMASINI S,DONATO P.Effects of-and-cy-clodextrin complexation on the physico-chemical properties and an tioxidant activity of some 3-hydroxy flav ones[J].Journal of Pharmaceutical and Biomedical Analysis,2004,35(2):365~377.
[24]PRALHADTAYADE,RAJENDRAKUMARKALE.Studyof freeze-dried quercetin-cyclodextrin binary systems by DSC,FT-IR,x-ray diffraction and SEM analysis[J].Journal of Pharmaceutical and Biomedical Analysis,2004,34(2):333~339.
[25]ALVAREZ-PARRILLA EMILIO,DE LA ROSA LAURA A,TORRES-RIVAS FRANCISCO.Complexation of apple antioxidants:Chlorogenic acid,quercetin and rutin by-cyclodextrin(-CD)[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2005,53(1~2):121~129.
[26]KALE RAJENDRAKUMAR,SARAF MADHUSUDAN,JUVEKAR AARTI,et al.Decreased B16F10 melanoma growth and impaired tumor vascularization in BDF1 mice with quercetincyclodextrin binary system[J].Journal of Pharmacy and Pharmacology,2006,58(10):1351~1358.
[27]JULLIAN CAROLINA,MOYANO LORENA,YANEZ CLAUDIA.Complexation of quercetin with three kinds of cyclodextrins:An antioxidant study[J].Spectrochimica Acta,Part A:Molecular and Biomolecular Spectroscopy,2007:67A(1):230~234.
[28]SRI K VIJAYA,KONDAIAH A,RATNA J VIJAYA,et al.Preparation and characterization of quercetinand rutin cyclodextrin inclusion complexes[J].Drug Development and Industrial Pharmacy,2007,33(3):245~253.
[29]DIAS KARINA,NIKOLAOU SOFIA,DE GIOVANI WAGNER F.Synthesis and spectral investigation of Al(III)catechin/-cyclodextrin and Al(III)quercetin/cyclodextrin inclusion compounds[J].Spectrochimica Acta,Part A:Molecular and Biomolecular Spectroscopy,2008:70A(1):154~161.
[30]LUCAS-ABELLAN CARMEN,FORTEA ISABEL,ABALDON JOSE ANTONIO.Encapsulation of Quercetin and Myricetin in Cyclodextrins at Acidic pH[J].Journal of Agricultural and Food Chemistry,2008,56(1):255~259.
Research Development of Quercetin Inclusion Complexes
ZHAI Guang-yu1,MA Yan2,YAN Zhen3and DUAN Yan-dan1
(1.College of Nursing,Zhengzhou University,Zhengzhou 450052,China;2.College ofPharmaceutical Sciences,Zhengzhou University,Zhengzhou 450052,China;3.Zhengzhou City Maternal and Child Health Centers,Zhengzhou 450052,China)
The research progress in the inclusion complexs of quercetin at home and abroad was summarized.In order to improve the water solubility of quercetin,inclusion complex of quercetin,cyclodextrin and its derivatives were prepared,such as quercetin and β-cyclodextrin(β-CD),αcyclodextrin(α-CD),part of methylated-β-cyclodextrin(M-β-CD),hydroxypropyl-β-cyclodextrin(HP-β-CD),and sulfobutyl ether-β-cyclodextrin (SBE-β-CD),and made the water solubility of quercetin improved markedly,and be more conducive to the absorption in vivo,and increased bioavailability.
Quercetin;cyclodextrin and its derivatives;inclusion complex;research development.
book=43,ebook=43
TQ 033
A
1001-0017(2010)04-0032-05
2010-02-28
翟广玉(1954—),男,河南项城人,教授,硕士生导师,主要从事中草药有效成分提取及结构优化等研究。

