核磁共振法同时测定桔子原汁中主要糖类和柠檬酸
阎政礼,杨明生
(1.湖南师范大学医学院,湖南长沙410006;2.湖南师范大学化学化工学院,湖南长沙410081)
核磁共振法同时测定桔子原汁中主要糖类和柠檬酸
阎政礼1,杨明生2,*
(1.湖南师范大学医学院,湖南长沙410006;2.湖南师范大学化学化工学院,湖南长沙410081)
采用核磁共振波谱分析技术,确定桔子原汁中葡萄糖、果糖、蔗糖及柠檬酸在重水中的各种构型,对桔子原汁中葡萄糖、果糖、蔗糖及柠檬酸进行指纹归属。运用模拟谱证实了桔子原汁中存在葡萄糖、果糖、蔗糖和柠檬酸。以邻苯二甲酸氢钾作内标,利用质子核磁共振谱的主要特征峰同时对桔子原汁中葡萄糖、果糖、蔗糖及柠檬酸进行定量分析。葡萄糖、果糖、蔗糖和柠檬酸测定结果的RSD(n=6)分别为3.61%、3.24%、2.19%、4.6%;葡萄糖、果糖、蔗糖和柠檬酸的回收率分别为99.4%、98.8%、97.8%、95.7%。该方法取样量少、简单、快速、准确,可以同时测定桔子原汁中葡萄糖、果糖、蔗糖和柠檬酸含量。
桔子原汁,葡萄糖,果糖,蔗糖,柠檬酸,NMR
Abstract:Various configurations of glucose,fructose,sucrose and citric acid in raw orange juice were determined by NMR when dissolved in heavy water.Glucose,fructose,sucrose and citric acid were attributed by fingerprint.Simulated spectra confirmed glucose,fructose and sucrose citric acid’s existence in raw orange juice.Potussium biphthalate was selected as an internal standard,1H-NMR spectra was used to determine the content of glucose,fructose and sucrose citric acid at the same time.RSD(n=6)of glucose,fructose and sucrose citric acid were 3.61%,3.24%,2.19%and 4.6%respectively,recovery of them were 99.4%,98.8%,97.8%and 95.7%,respectively.This method used only a little sample and was simple,rapid,accurate and suitable for the determination of the contents of glucose,fructose,sucrose and citric acid in raw orange juice at the same time.
Key words:raw orange juice;glucose;fructose;sucrose;citric acid;NMR
桔子果肉和果汁中含有丰富的葡萄糖、果糖、蔗糖、苹果酸、拘椽酸、柠檬酸以及胡萝卜素、硫胺素、核黄素、尼克酸、抗坏血酸等。测总糖含量的方法有盐酸—酚法[1]、蒽酮比色法[2]等,测还原糖含量方法有直接法[3]、间接法[4]、3,5-二硝基水杨酸法[5]等。这些方法只能测出桔子原汁中还原糖和总糖的含量,若选用传统方法来检测桔子原汁,不但步骤多、操作复杂,且偏差较大。高效液相色谱法虽然可对葡萄糖、果糖、蔗糖单个含量进行准确测定,但涉及的条件多,操作复杂。柠檬酸的测定有高效液相色谱法[6]以及衍生化气相色谱法[7],衍生化气相色谱法装置较贵,操作繁琐,应用不普遍。目前,核磁共振技术在有机合成及天然提取的化合物的结构鉴定上应用非常广泛,也常用于医用药物的定性、定量鉴定。而对桔子原汁混合体系中葡萄糖、果糖、蔗糖及柠檬酸含量采用核磁共振技术进行定性、定量研究尚未见文献报道。本研究旨在利用核磁共振技术,建立一种快速、准确而又同时测定桔子原汁中葡萄糖、果糖、蔗糖、柠檬酸的含量的方法,以加快柑桔品质鉴定的检测速度,在实现与国际检测技术接轨等方面有重要意义。
1 材料与方法
1.1 材料与仪器
葡萄糖、果糖蔗糖、柠檬酸、邻苯二甲酸氢钾均为分析纯;重水 氘代度:99.8%;DSS。
AVANCE 500MHZ超导傅立叶变换核磁共振仪Bruker,瑞士;Sartorius电子天平 德国;DS-1高速组织捣碎机 上海标本模型厂制造;Eppendorf 5804R冷冻高速离心机 德国;离心机 湖南仪器仪表总厂。
1.2 实验方法
1.2.1 样品处理 首先将桔子的非可食部分剥去,称取约200g剥好的桔子,均匀放置在刀片杆两侧,固定好捣碎机的杯子,打开电源,以10000r/min捣碎约5min,取出均浆,用纱布滤去渣滓,再将滤液置于厚质的50mL冷冻离心管中,以5000r/min,在冷冻高速离心机中离心10min,后用5mL移液枪取出上清液,置上清液于试剂瓶中,冷藏备用,离心管中残渣弃去。
1.2.2 样品配制
1.2.2.1 1号样品 量取约5mL上述备用的蜜桔原汁样品冷冻干燥,除去水,用0.6mL重水溶解,转移至5mm的核磁共振样品管中。用于测定1H-NMR谱、H-H COSY 谱、13C-NMR 谱、DEPT谱、HSQC 谱、HMBC谱。
1.2.2.2 2号样品 取0.5g蜜桔原汁于核磁共振样品管中,加10mg邻苯二甲酸氢钾,加0.2mL重水,用于精密度测试。
1.2.2.3 3号样品 取0.5g蜜桔原汁于核磁共振样品管中,加10mg邻苯二甲酸氢钾,加0.2mL重水,测试后分别加入与样品相当量的葡萄糖、果糖、蔗糖、柠檬酸,用于回收率测试。
1.2.2.4 4、5、6号样品 分别准确称取约2g蜜桔、砂糖桔、赣南橙原汁样品及约50mg邻苯二甲酸氢钾于5mL的具磨口塞的离心试管中,加0.5mL重水,摇匀。取约0.6mL于5mm的核磁共振样品管中,用于测定1H-NMR谱。
以上准确称取的标准和样品都精确到0.1mg。样品配制好后,放置15min,待溶液稳定后进行测定。每个核磁样品管测量6次。
1.2.31H-NMR谱测试条件 将制好的样品充分振摇,待样品及标准品完全溶解,放置15min,待溶液稳定后进行测定。每次测定都进行调谐、匀场,测定条件控制在:T:300K,SF:500.13MHz,SWH:5376.344,NS:64,DS:2,每个核磁样品管测量6次。谱图处理时以DSS确定化学位移零点,积分时先对谱图峰形和基线进行校正,后对需积分的每个峰进行基线校正,保证积分值的准确。
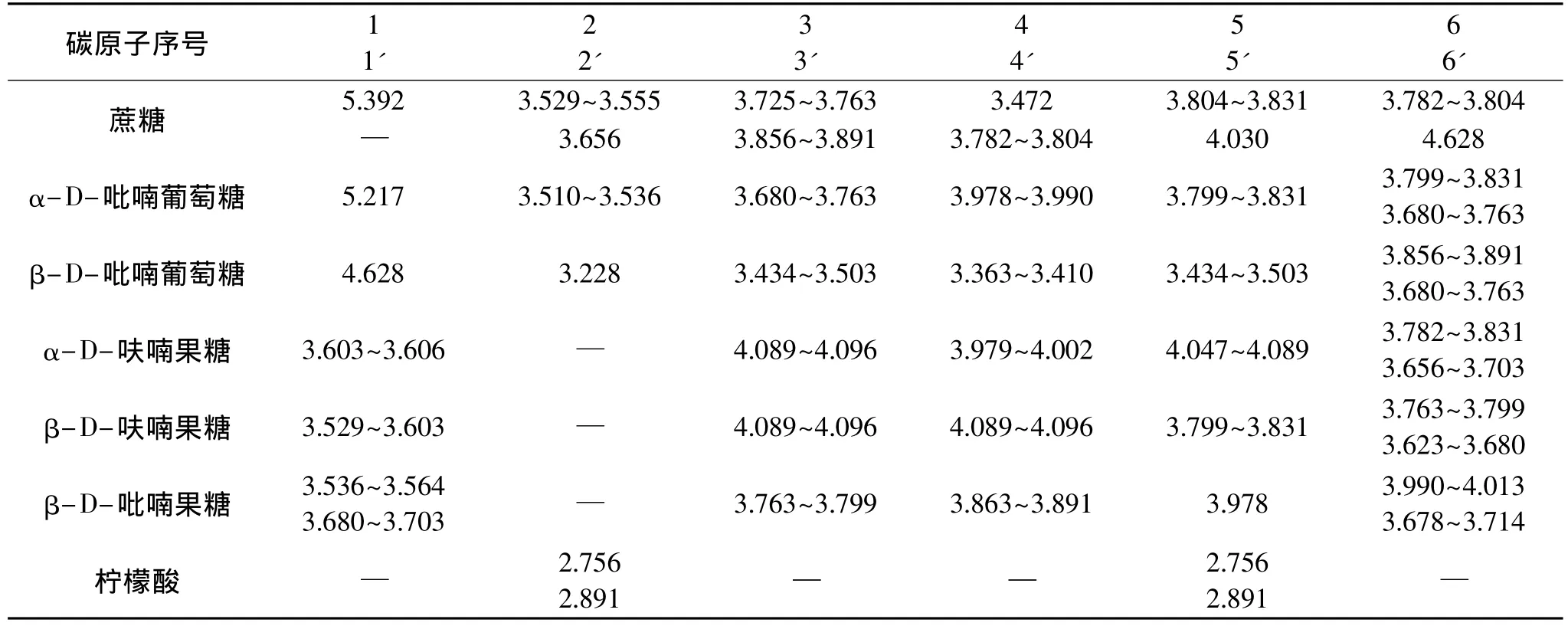
表1 蜜桔原汁中三种主糖、柠檬酸的1H-NMR归属
1.2.4 定量依据 利用吸收峰面积与氢质子数成正比,通过加入标准物作内标,可以准确求出桔子原汁中葡萄糖、果糖、蔗糖和柠檬酸含量(mg)。葡萄糖的积分值为α-D-吡喃葡萄糖及β-D-吡喃葡萄糖的端基质子积分值之和,若要计算葡萄糖两种构型比值,可计算两种构型积分比。果糖积分值为β-D-吡喃果糖、α-D-呋喃果糖和β-D-呋喃果糖三种构型积分值之和,果糖四个峰正好包含了果糖三种构型每种构型两个质子,因此,计算果糖含量时应除以二。蔗糖的积分值即为α-D-吡喃葡萄糖环上1-H的积分值。
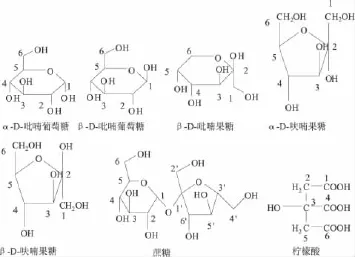
图1 三种主要糖类及柠檬酸在重水中的构型
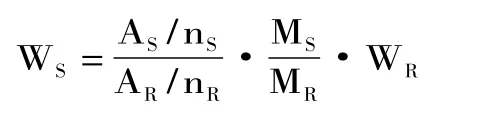
式中WS:样品质量;AS:样品质子吸收峰面积;nS:样品吸收峰所包含质子数;WR:标准质量;AR:标准质子吸收峰面积;nR:标准吸收峰所包含质子数;MS:样品摩尔质量;MR:标准摩尔质量;其中S为葡萄糖、果糖、蔗糖和柠檬酸;R为邻苯二甲酸氢钾;M葡萄糖=180,M果糖=180.13,M蔗糖=342.3,M邻苯二甲酸氢钾=204.23,M柠檬酸=192.13。
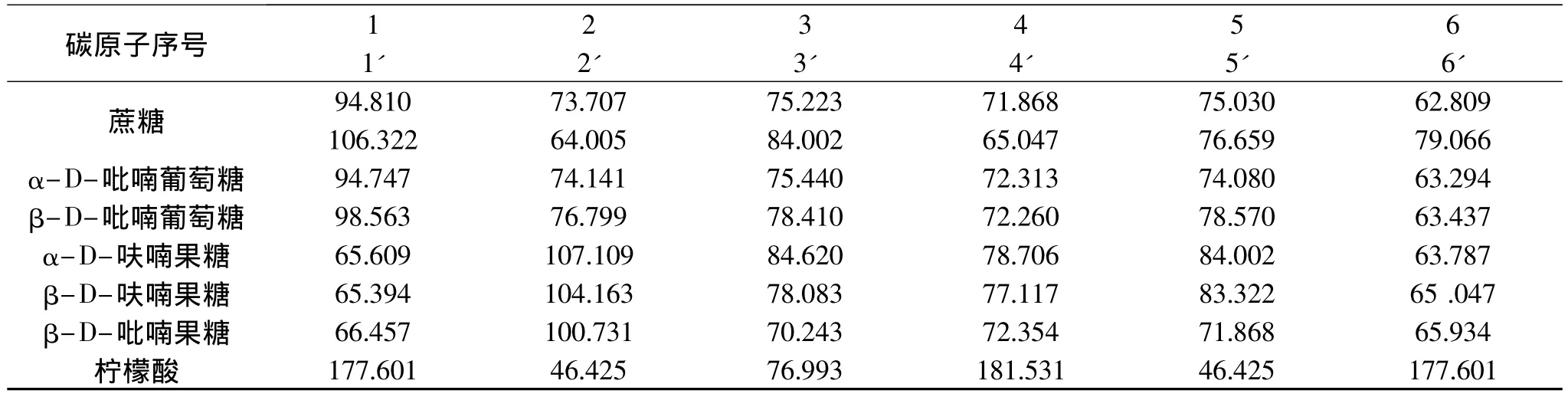
表2 蜜桔原汁中三种主糖、柠檬酸的13C-NMR谱归属
2 结果与讨论
2.1 蜜桔原汁中主要糖类及柠檬酸的1H-NMR谱和13C-NMR谱的归属
根据冷冻干燥的蜜桔原汁、葡萄糖标准、果糖标准、蔗糖标准、柠檬酸标准的1H-NMR谱、H-H COSY谱、13C-NMR 谱、DEPT谱、HSQC 谱、HMBC 谱,确定桔子原汁存在葡萄糖、果糖、蔗糖和柠檬酸,其中,葡萄糖以α-D-吡喃葡萄糖和β-D-吡喃葡萄糖两种主要构型存在。果糖主要以β-D-吡喃果糖、α-D-呋喃果糖和β-D-呋喃果糖三种主要构型存在,在三种构型中,β-D-吡喃果糖含量最高,其次为β-D-呋喃果糖,α-D-呋喃果糖含量最低。蔗糖及柠檬酸在重水中只有一种构型。根据图2和图3对桔子原汁中葡萄糖、果糖、蔗糖、柠檬酸进行了指纹归属,归属顺序如图1,具体归属如表1及表2。1H-NMR谱中,δ:5.217为 α-D-吡喃葡萄糖 1-H,受 2-H 的偶合而裂分为双峰,偶合常数3JH-H=3.5Hz;δ:4.628 为β-D-吡喃葡萄糖1-H,受2-H的偶合而裂分为双峰,偶合常数3JH-H=8.0Hz。δ:5.392 为蔗糖 1-H,受蔗糖2-H的偶合而裂分为双峰,偶合常数3JH-H=3.5Hz;δ:4.198 归属为蔗糖 6'-H,受蔗糖5'-H 的偶合而裂分为双峰,偶合常数3JH-H=9.0Hz。δ:2.891,δ:2.756为柠檬酸的两个亚甲基吸收峰。由于两个CH2与手性碳原子相连,导致两个CH2上的2个质子磁不等价,产生同碳偶合,具有不同的化学位移值,偶合常数2JH-H=15Hz。
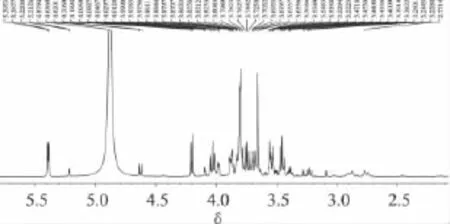
图2 冷冻干燥的蜜桔原汁1H-NMR谱
冷冻干燥的蜜桔原汁的13C-NMR谱如图3所示,给出18个果糖碳信号,其中,δ:107.109为α-D-呋喃果糖的2-C,δ:104.163为β-D-呋喃果糖的2-C,δ:100.731为 β-D-吡喃果糖2-C。在冷冻干燥的蜜桔原汁的13C-NMR谱中,给出12个葡萄糖碳信号,其中,δ:94.747 为 α-D-吡喃葡萄糖的 1-C,δ:98.563为β-D-吡喃葡萄糖的1-C。图3还给出了12 个蔗糖碳信号,δ:94.810 为 1-C,δ:106.322 为1'-C。冷冻干燥的蜜桔原汁13C-NMR谱中,给出6个柠檬酸碳信号,其中,δ:177.601为1-C和6-C的羰基碳,δ:181.531为 4-C 的羰基碳,δ:46.425为2-C 和5-C的亚甲基碳。
通过以上谱图,可以对冷冻干燥的蜜桔原汁中葡萄糖的二种构型、果糖的三种构型、蔗糖、柠檬酸进行指纹归属,葡萄糖与果糖在重水中的构型及相对含量与资料报道相符[8]。
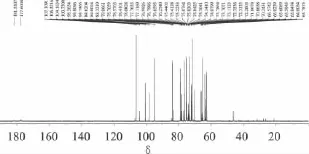
图3 冷冻干燥的蜜桔原汁13C-NMR谱
2.2 蜜桔原汁样品冷冻干燥谱与模拟谱的比较
从图4和图5可以看出,冷冻干燥的蜜桔原汁中葡萄糖、果糖、蔗糖、柠檬酸与葡萄糖、果糖、蔗糖、柠檬酸模拟谱中1H-NMR谱和13C-NMR谱的峰型和位置基本一致,蔗糖在蜜桔原汁含量较高,而柠檬酸在桔子原汁含量较低,这一点从蜜桔原汁1H-NMR和13C-NMR谱可以看出。
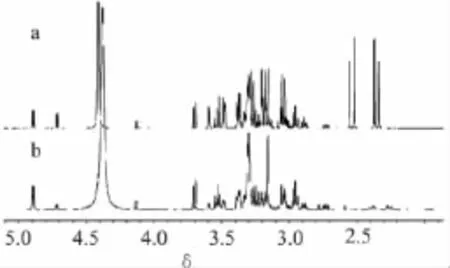
图4 蜜桔原汁1H-NMR谱(a)与模拟的1H-NMR谱(b)比较
2.3 蜜桔原汁中三种主糖、柠檬酸和内标的质子特征峰的确定
蜜桔原汁的1H-NMR谱中,如图6,δ:5.394为蔗糖1-H,与其它峰不重叠,利用它作为质子特征峰对蔗糖进行定量。δ:5.217为α-D-吡喃葡萄糖的1-H,δ:4.629归属为β-D-吡喃葡萄糖的1-H ,两者之和即为葡萄糖的总积分值。δ:4.100~4.092为α-D-呋喃果糖3-H 和 β-D-呋喃果糖3-H、4-H,δ:4.018~3.993归属为β-D-吡喃果糖6-H上一个质子两重峰与α-D-呋喃果糖4-H两个峰中一个峰。δ:3.984~3.976归属为β-D-吡喃果糖5-H与α-D-呋喃果糖4-H两个峰中另一个峰。这三个区间正好包含了果糖三种构型每种构型两个质子,而β-D-吡喃果糖6-H上一个质子两重峰中一个峰与蔗糖的5'-H上三重峰中一个峰重叠,因此,在计算果糖积分值时,应把 δ:3.984~3.976、δ:4.053~4.018、δ:3.993~3.976这三个区间的积分值相加再减去蔗糖的1-Hδ:5.394积分值,即为果糖三种构型每种构型两个质子的积分值,除以二,即为果糖的总积分值。δ:2.873两重峰和δ:2.753两重峰皆为柠檬酸两个质子,任选一组积分值除以二,即可对柠檬酸进行定量。δ:7.561~7.740为邻苯二甲酸氢钾的两组多重峰,任选一组峰进行积分都为两个质子。
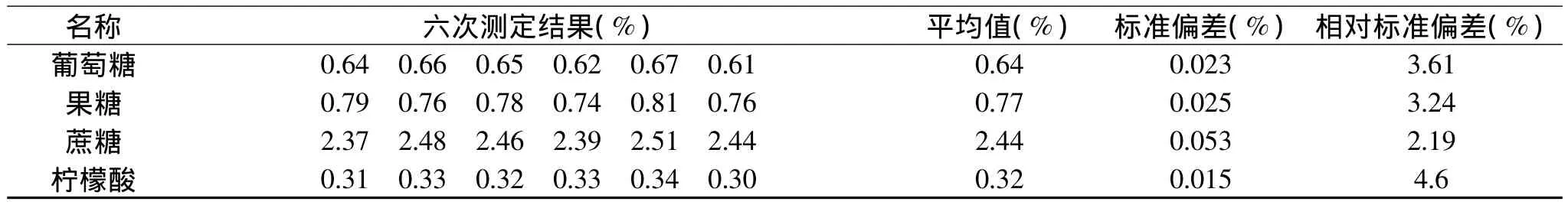
表3 精密度实验结果
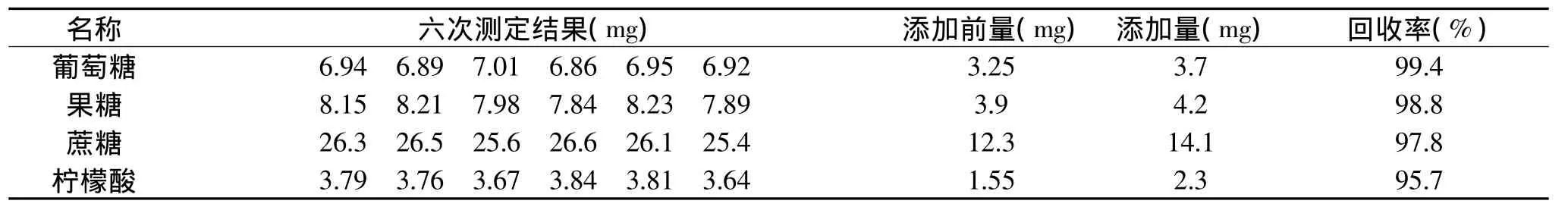
表4 回收率实验结果
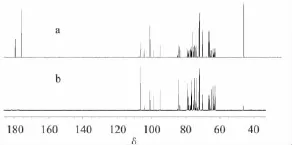
图5 蜜桔原汁13C-NMR谱(a)与模拟的13C-NMR谱(b)比较
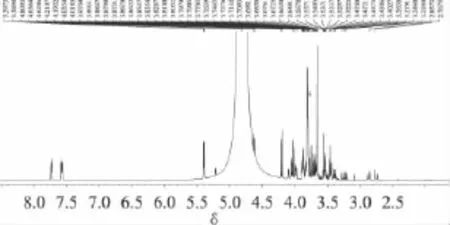
图6 蜜桔原汁加内标的1H-NMR谱
2.4 精密度实验
测试时,将样品进行6次平行测定,按照公式计算蜂蜜中葡萄糖、果糖、蔗糖、柠檬酸的百分含量,计算平均值、标准偏差和相对标准偏差,结果如表3。
从表3可以看出:葡萄糖、果糖、蔗糖和柠檬酸测定结果的相对标准偏差分别为3.61%、3.24%、2.19%、4.6%,多次测定结果接近,相对标准偏差亦在允许范围内,说明定量的精密度令人满意。
2.5 回收率实验
测试时,每个蜜桔原汁样品添加标准前测试6次,添加标准后测试6次,取葡萄糖、果糖、蔗糖和柠檬酸添加前后的量的均值,计算三种主要糖及柠檬酸的回收率,其结果见表4。由表4可以看出:葡萄糖回收率为99.4%,果糖回收率为98.8%,蔗糖的回收率为97.8%,柠檬酸回收率为95.7%,实验达到了回收的目的,这说明核磁共振法测定桔子原汁准确度高,分析测定结果可靠性强。
2.6 样品检测结果
根据实验最佳条件测出蜜桔(1)、砂糖桔(2)、赣南橙(3)中葡萄糖、果糖、蔗糖、柠檬酸百分含量,结果如表5。
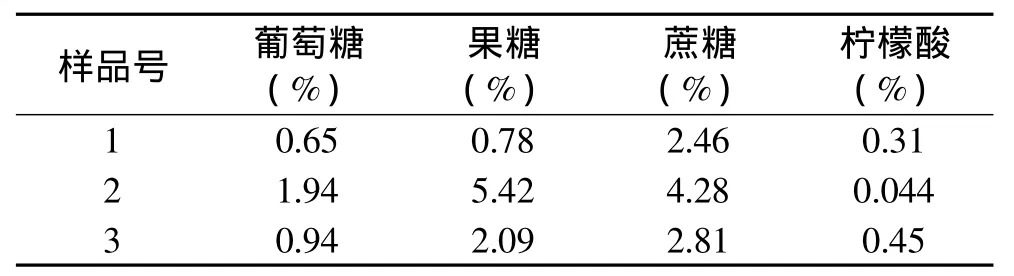
表5 桔子原汁检测结果
由表5可以看出,蜜桔中葡萄糖、果糖、蔗糖、柠檬酸的百分含量分别为 0.65%、0.78%、2.46%、0.31%,砂糖桔中葡萄糖、果糖、蔗糖、柠檬酸的百分含量分别为1.94%、5.42%、4.28%、0.044%,赣南橙中葡萄糖、果糖、蔗糖、柠檬酸的百分含量分别为0.94%、2.09%、2.81%、0.45%。砂糖桔中葡萄糖、果糖、蔗糖的百分含量比蜜桔都高了几倍,而砂糖桔中柠檬酸百分含量比蜜桔、赣南橙低了几倍。
3 结论
应用核磁共振法,可以确定桔子原汁中葡萄糖、果糖、蔗糖及柠檬酸在重水中的各种构型,运用模拟谱证实了葡萄糖、果糖、蔗糖和柠檬酸在桔子原汁中的存在。选用邻苯二甲酸氢钾作内标,通过相关质子特征峰的积分值可以直接求出桔子原汁中葡萄糖、果糖、蔗糖、柠檬酸的绝对含量。葡萄糖、果糖、蔗糖和柠檬酸测定结果的 RSD(n=6)分别为3.61%、3.24%、2.19%、4.6%,误差在允许范围内;葡萄糖、果糖、蔗糖和柠檬酸的回收率为 99.4%,98.8%,97.8%,95.7%,回收率令人满意。样品测定结果表明:桔子原汁中葡萄糖、果糖、蔗糖、柠檬酸的测定结果接近真实值。本方法具有操作简便、快速,重现性好、准确度高等优点,为蜜桔、砂糖桔和赣南橙等混合体系中葡萄糖、果糖、蔗糖、柠檬酸的测定提供了一种简单、可行的方法。
[1]王建壮,安洁,吕华冲.植物多糖含量测定的方法学研究[J].海峡药学,2008,20(5):48-50.
[2]汤灿辉,彭新君,文礼章,等.蒽酮-硫酸比色法测定三叶虫茶中总糖的含量[J].湖南中医药大学学报,2008,28(5):38-40.
[3]偰德翱.电位滴定法测定葡萄酒中还原糖含量的研究[J].食品工程,2007(3):61-63.
[4]赵阳楠,常继东.苯酚硫酸法和间接碘法测定灵芝多糖含量比较[J].食用菌,2007(3):58-60.
[5]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[6]郭瑛,肖朝萍,王红.高效液相色谱法测定乌梅有机酸[J].分析化学,2004,32(12):1624-1626.
[7]杜曦,周锡兰,余录,等.葡萄及葡萄酒中有机酸测定的衍生化气相色谱法[J].酿酒,2008,25(3):82-84.
[8]荣国斌译,朱士正较.波谱数据表—有机化合物的结构解析[M].上海:华东理工大学出版社,2002:152-237.
Determination of major sugars and citric acid in raw orange juice were by Nuclear Magnetic Resonance at the same time
YAN Zheng-li1,YANG Ming-sheng2,*
(1.College of Medicine,Hunan Normal Uinversity,Changsha 410006,China;2.College of Chemistry and Chemical Engineering,Hunan Normal Uinversity,Changsha 410081,China)
TS255.1
A
1002-0306(2010)08-0353-05
2009-07-08 *通讯联系人
阎政礼(1966-),男,研究生,主要从事食品卫生研究。

