人肺腺癌TLE1 N端Q结构域片段在原核系统表达纯化及其多克隆抗体的制备
王苏 徐志飞 唐华 魏凌云 赵学维
TLE是Groucho蛋白家族在哺乳类动物中的同源物,作为转录共抑制分子,通过与Hairy、Tcf/Lef1、Runt等蛋白家族作用,形成转录抑制复合物,调控基因表达[1-4]。人TLE1基因定位于第9号染色体,全长2 310 bp,编码770个氨基酸。TLE1蛋白是Notch信号通路下游重要调控蛋白,也可参与其它多个细胞信号通路传导,如Shh、EGFR等,成为多种信号通路间相互影响、相互作用的重要靶点[5,6]。TLE1蛋白通过介导细胞的分化和发育,在胚胎发育、造血细胞发育分化、神经肿瘤尤其是恶性肿瘤生成等生理病理过程中起重要作用[7-9]。Allen等[8]通过组织芯片筛选实验证实TLE1在肺腺癌中表达显著增加,又在转基因大鼠模型中发现Grg1过表达对肺腺癌生成有促进作用,因此认为TLE1与肺腺癌发生发展有密切关系。
在Groucho蛋白家族中,TLE1-4四种蛋白均在氨基端含有富含谷氨酰胺的Q结构域,在羧基端含有高度保守的特征WD40样重复的结构域,此外TLE1还有3个保守性较低的结构域,分别是GP、SP和CcN。Q结构域作为TLE1蛋白两个高度保守的特征性结构域之一,主要发挥两部分生物学作用:寡聚化作用使TLE1形成四聚体,Q结构域关键基序点突变可导致寡聚化作用失败,从而使其转录抑制功能失活[10,11];Q结构域通过直接与蛋白分子如Tcf/Lef1、PRDI结合,形成转录共轭复合物,影响下游信号蛋白表达,调控信号通路,从而发挥生物学活性[12,13]。本实验通过对人TLE1 N端Q结构域的表达纯化,得到高纯度的Q结构域蛋白片段TLE1-Q(1-136),并成功制备其多克隆抗体,为解析TLE1-Q结构域蛋白结构、明确TLE1-Q结构域在Notch信号通路的作用方式、了解TLE1调控多条信号通路机理、理解TLE1促进肺癌生成机制打下基础。
1 材料和方法
1.1 菌株和表达载体 人肺腺癌cDNA文库(由本室前期保存);大肠杆菌E.coli BL21 condon plus及pGEX-4T-1载体由中科院上海生命科学院结构生物学平台杜嘉木博士提供。
1.2 主要试剂 DNA胶回收试剂盒和质粒抽提试剂盒购自天根生化科技(北京)有限公司;KOD plus DNA聚合酶、dNTP、限制性内切酶BamHI和XholI连接酶购自宝生物工程(大连)有限公司;Ligation High DNA连接酶购自东洋纺(上海)生物科技有限公司;Glutathion Sepharose 4B Fast Flow亲和层析凝胶、快速蛋白液相色谱(FPLC)、Thrombin酶购自GE公司;纯种新西兰大白兔6只(雄性)购自第二军医大学实验动物中心。
1.3 引物设计 根据GenBank中人类TLE1基因序列(NM_005077),Omiga 2.0设计引物,选取TLE1 N端第1-136氨基酸残基,设计以BamHI、XholI为酶切位点。引物序列为:tle5’: ata gga tcc atg ttc ccg cag agc和tle3’: tat ctc gag tca gcc atg aga aag atg。
1.4 基因扩增 以人肺腺癌cDNA库为模板,以tle5’和tle3’作引物,KOD plus DNA聚合酶扩增。PCR反应参数设置为94oC预变性5 min,94oC变性30 s,55oC退火30 s,68oC延伸30 s,30个循环后,68oC延伸10 min,4oC孵育20 min。
1.5 重组表达载体的构建及鉴定 人类TLE1 N端Q区基因PCR扩增产物以1%琼脂糖凝胶电泳检测,以QIANGEN胶回收试剂盒,按标准说明书回收。回收产物及质粒载体pGEX-4T-1以BamHI和XholI限制性内切酶37oC酶切过夜。回收的酶切产物TLE1 N末端基因与pGEX-4T-1质粒以Ligtion High DNA连接酶16oC连接过夜。重组表达载体转化感受态细胞E.coli BL21 condon plus,Amp抗性筛选重组阳性菌,命名为pGEX-4T1-TLE1-Q,PCR及BamHI、XholI双酶切鉴定,送上海博尚生物公司测序。
1.6 TLE1 N端Q结构域的表达纯化 pGEX-4T1-TLE1-Q菌株于LB 37oC培养至OD≈0.8,以0.5 mmol/L IPTG,16oC诱导过夜。离心收集菌体,以PBS(pH8.0)为破菌缓冲液,超声波破菌。高速离心收集上清液,与Glutathion Sepharose 4B Fast Flow beads混合3 h,PBS(pH8.0)洗脱未结合蛋白,10 mmol/L还原性谷胱甘肽洗脱融合目的蛋白GST-TLE1-Q(1-136)。100 U Thrombin 4oC,酶切16 h,透析至PBS(pH8.0),再次亲和纯化,去除GST-tag。以PBS 0.1%Chaps(pH8.0)洗脱目的蛋白TLE1-Q(1-136),FPLC纯化,SDS-PAGE分析纯度。
1.7 多克隆抗体的制备 以纯化蛋白分别免疫新西兰大白兔,将300 μg TLE1-Q(1-136)蛋白与完全弗氏佐剂等体积混合充分乳化后,背部皮下多点注射初次免疫,21 d后200 μg TLE1-Q(1-136)蛋白与等体积的不完全弗氏佐剂混合乳化后,颈背部皮下多点加强免疫,加强免疫2次后,采心脏血,制备抗血清分离血清,分装储存于-20oC保存。间接ELISA法检测多克隆抗体效价。
1.8 Western blot分析 以pGEX-4T-1空载体转化的E.coli BL21 condon plus为阴性对照,纯化的TLE1-Q(1-136)蛋白经SDS-PAGE电泳,电转移(100 V,2 h,冰水浴)至硝酸纤维膜上,5%脱脂奶粉封闭,将制备的多克隆抗体(1:1 000稀释),4oC孵育过夜。1‰TBST洗膜,10 min/次,共3次,加入带HRP标记的羊抗兔二抗(1:2 000稀释),室温下孵育1 h,1‰TBST洗膜,15 min/次,共3次,最后加入化学荧光试剂,压片,曝光,拍照。
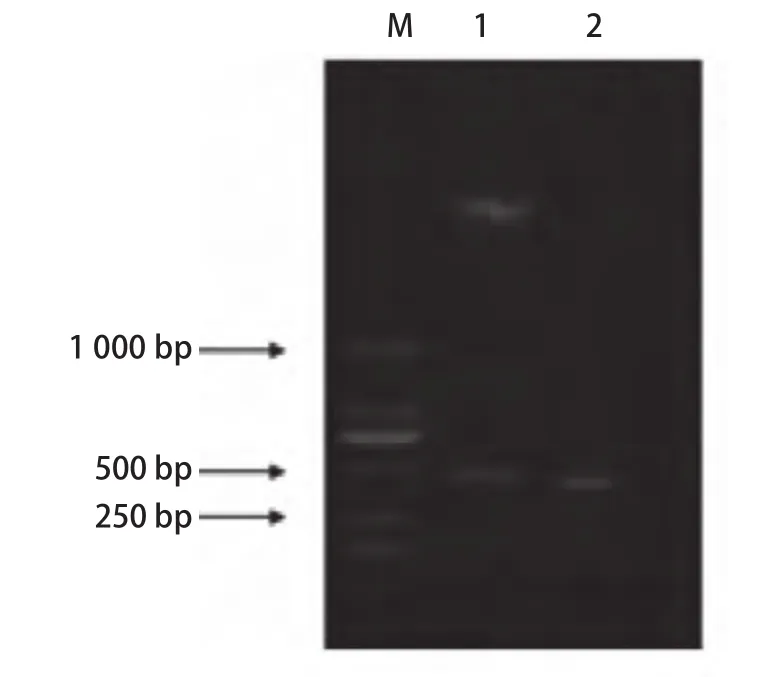
图1 重组质粒pGEX-4T1-TLE1-Q的PCR及双酶切鉴定Fig 1 Identification of vector pGEX-4T1-TLE1-Q by PCR and digested with BamHI and Xho1I
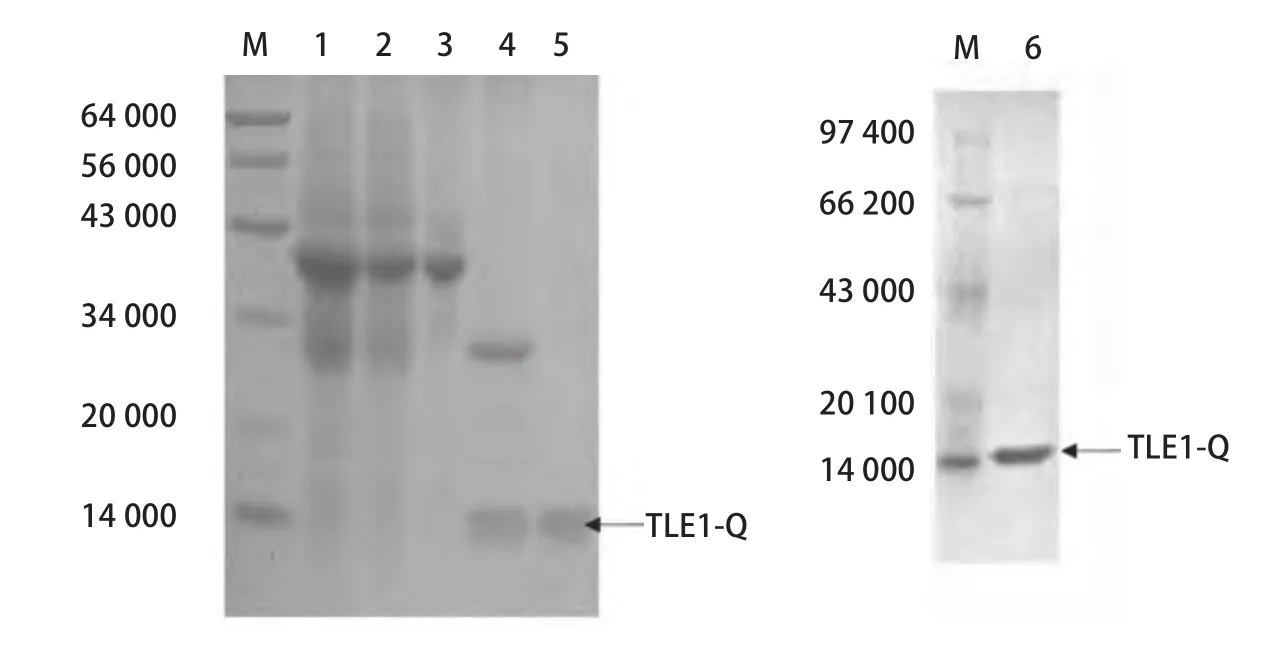
图2 重组蛋白GST-TLE1-Q(1-136)的SDS-PAGE 鉴定Fig 2 SDS-PAGE of recombinant protein GST-TLE1-Q(1-136)
2 结果
2.1 TLE1 N端Q区基因扩增鉴定 以构建的pGEX-4T1-TLE1-Q质粒载体为模板,以tle3’及tle5’为引物PCR扩增,双酶切后分别出现大小约408 bp的特异性条带,与目的大小片段相一致(图1)。测序结果显示所获得的TLE1第1-136位氨基酸残基样品序列编码框架完整,编码区为408 bp,编码136个氨基酸残基。经Pubmed网站Blast分析,与人类基因组TLE1基因序列同源性为100%,编码TLE1蛋白N末端第1-136个氨基酸。
2.2 重组人TLE1 N端Q结构域蛋白的表达及纯化结果 目的TLE1-Q(1-136)蛋白表达纯化后,以13.5%SDS-PAGE对全菌,上清,洗脱、酶切及纯化产物蛋白行鉴定分析。SDS-PAGE表明经一步亲和纯化,还原型谷胱甘肽洗脱,可以得到分子量约为41 000 Da左右的重组蛋白GST-TLE1-Q(1-136)。Thrombin酶切后,41 000 Da目的条带切开成为大小约26 000 Da和14 000 Da两条条带。再次经亲和、FPLC纯化,可得到大小约14 000 Da的目的蛋白TLE1-Q(1-136) (图2)。
2.3 TLE1 N端Q结构域蛋白多克隆抗体效价及特异性测定 纯化的TLE1 N端Q结构域蛋白TLE1-Q(1-136)以(0.1 μg/mL)每孔100 μL包被,ELISA法检测多克隆抗体效价,制备的抗血清效价达1:20 000。对TLE1-Q(1-136)蛋白经自制抗体行免疫印迹检测,可见一条分子量约14 000 Da的清晰条带,与预期结果相符,阴性对照未见明显条带,证明制备的抗体特异性较好(图3)。

图3 TLE1-Q(1-136)多克隆抗体的Western blot鉴定Fig 3 Identification of polyclonal antibody by Western blot
3 讨论
Gro/TLE家族作为转录共抑制分子,本身不与DNA直接结合,通过结合转录抑制蛋白形成复合物,对靶基因起“长程”转录抑制作用[4,14]。Groucho/TLE蛋白分子中具有两个高度保守的特征性结构域,分别是:位于羧基端的含有多个色氨酸-天门冬氨酸二肽序列的WD40结构;位于氨基端的由130个氨基酸组成、富含谷氨酰胺的Q结构域。前期研究认为TLE1通过WD结构域与WRPW、Eh基序结合形成复合物,该复合物经N-末端由第1-136位氨基酸组成的Q结构域来发挥其转录抑制活性,可能机制为TLE1通过位于Q结构域的2个亮氨酸拉链状的α螺旋,形成四聚体抑制转录活性[10]。实验证实将亮氨酸突变后,TLE/Gro无法形成四聚体,失去转录抑制活性,分析认为TLE分子中第50-110位氨基酸残基对四聚体的形成起到关键作用[11]。近来亦有研究[13,15]表明Q结构域不仅介导TLE及其家族蛋白之间的四聚化作用,也可直接结合Tcf/Lef1、gp130等转录调控因子,参与信号通路调控。本实验即选取TLE1第1-136位氨基酸残基TLE1-Q(1-136)即Q结构域所在片段进行表达纯化研究。
在原核系统中表达真核蛋白,蛋白的正确折叠是难点之一。蛋白的可溶性是由蛋白结构的空间折叠方式决定的,不同的折叠方式也可影响到蛋白分子上抗原决定簇,进而影响抗体的特异性与效价[16]。由于富含谷氨酰胺的蛋白在溶液中的可溶性较差[17],我们通过16oC低温诱导,控制蛋白生成速度,使目的蛋白以合适的速度转录、翻译,从而使其正确折叠,并借助GST-tag的助溶性,在上清中形成可溶的重组蛋白;同时GST-tag也为蛋白的纯化提供了亲和位点。SDS-PAGE电泳证实获得较高纯度的可溶重组蛋白GST-TLE1-Q(1-136),相对分子质量约为41 000 Da。由于无GST-Tag的TLE1蛋白的Q结构域性状更接近体内真实天然状态,并利于后期研究;且GST标签(26 000 Da)较Q结构域(14 000 Da)更大,用重组蛋白在制备抗体过程中可能会造成抗体的特异性和效价降低。我们尝试以Chaps为去垢剂,帮助维持蛋白在溶液中的稳定溶解状态,并以Thrombin酶切去除GST标签,最终得到相对分子质量约为14 000 Da、纯度高、特异性强、稳定可溶的TLE1N端Q结构域蛋白TLE1-Q(1-136)。用该纯化蛋白免疫家兔,成功制备该蛋白的多克隆抗体,ELISA检测效价为1:20 000,经Western blot与纯化蛋白TLE1-Q(1-136)免疫杂交出现条带,与预期结果一致,证实我们抗体制备成功,且具有高度的特异性。
TLE/Gro参与Shh、EGFR、Notch等多个信号通路的活化后调控,在信号通路活化、高等动物胚胎发育等生理病理过程中起到重要作用[4,6]。TLE1作为以上信号通路的关键调控点,重要机制之一就是通过TLE1 N端Q结构域结合Tcf/Lef1、FoxA、c-Myc、PRDI等相关蛋白而引起转录调节因子活性的改变,或介导四聚体形成转录抑制复合物,实现对目的基因转录的调控,引起胚胎发育,肿瘤增殖等一系列病理生理变化,但其具体分子作用机制尚不十分明晰。本实验研究成功制备可溶TLE1 N端Q结构域蛋白TLE1-Q(1-136)及其多克隆抗体,为下一步开展针对TLE1 Q结构域的蛋白结构功能研究,了解TLE1参与信号通路调控机制,探讨TLE1在肺癌的发生发展中的作用奠定了前期研究基础。

