切除肾上腺对大鼠自身免疫性脑脊髓炎敏感性的影响
寿旗扬,陈方明,贾临超,方明笋,周卫民,陈民利
(1.浙江大学动物科学学院,杭州 310029;2.浙江中医药大学动物实验研究中心,杭州 310053)
研究报告
切除肾上腺对大鼠自身免疫性脑脊髓炎敏感性的影响
寿旗扬1、2,陈方明2,贾临超2,方明笋2,周卫民2,陈民利2
(1.浙江大学动物科学学院,杭州 310029;2.浙江中医药大学动物实验研究中心,杭州 310053)
目的研究肾上腺切除导致下丘脑-垂体-肾上腺(HPA)轴功能缺陷对W istar大鼠诱发的实验性自身免疫性脑脊髓炎(EAE)的敏感性的影响。方法W istar大鼠单、双侧肾上腺切除后,用GPSCH-CFA诱导各组大鼠产生EAE,并观察临床评分、MBP抗体、皮质醇、Th1细胞因子和脑组织Bcl-2/Bax蛋白表达的变化,并与Lewis大鼠的EAE模型进行比较。结果GPSCH-CFA诱导后,双侧切除肾上腺的W istar大鼠平均神经症状评分最高为4.60分,发病率为100%,血清中皮质醇水平明显降低和MBP抗体水平明显升高,IFN-γ、TNF-α和IL-2水平均明显升高,大脑皮层和下丘脑中Bcl-2蛋白表达均明显降低和Bax蛋白表达均明显升高。结论双侧肾上腺切除导致HPA功能缺陷能显著增加W istar大鼠诱发EAE的敏感性。
实验性自身免疫性脑脊髓炎;W istar大鼠;肾上腺切除;皮质醇;Th1细胞因子
实验性自身免疫性脑脊髓炎(EAE)是由T淋巴细胞介导的,以中枢神经系统(CNS)血管周围单核细胞浸润和白质脱髓鞘为特征的自身免疫性疾病[1,2],由于Lewis、DA大鼠和PL/J小鼠的价格昂贵、不易获得或无来源等因素,致使国内的研究者以各种途径寻求价格低、易获得、而对EAE诱发并非敏感的W istar大鼠研究EAE模型的制作,但其成功率和敏感性较低[3,4]。而Lewis大鼠体内存在下丘脑-垂体-肾上腺轴功能(HPA)缺陷,血浆中皮质类固醇水平较低,这是Lewis大鼠易感EAE的主要原因[5],实验通过切除W istar大鼠肾上腺损伤HPA功能,使其体内皮质类固醇下降,以Lewis大鼠作对照,对W istar大鼠在切除肾上腺后GPSCH诱发的EAE症状、体征等进行评价,研究肾上腺切除导致HPA缺陷对W istar大鼠诱发的EAE的敏感性的影响。
1 材料和方法
1.1 实验动物
SPF级雄性W istar大鼠60只,体质量为240~260 g,中国科学院上海实验动物中心/上海斯莱克实验动物有限公司[SCXK(沪)2007-0005];SPF级雄性Lewis大鼠15只,体质量为180~200 g,北京维通利华实验动物技术有限公司[SCXK(京)2007-0001],无菌手术在浙江中医药大学动物实验研究中心屏障动物实验设施进行[SYXK(浙)2008-0115]。普通级雄性DHP白色豚鼠8只,体质量为300~340 g,湖州城区西风洋特种经济动物养殖场[SCXK(浙)2008-0037]。以上实验动物使用按3R原则给予人道的关怀。
1.2 试剂
不完全弗氏佐剂(WDY20080421,Biobasic Inc.),卡介苗(0809,Biobasic Inc.),大鼠皮质醇(Cortisol)ELISA试剂盒(R&D,E0900042),髓鞘碱性蛋白抗体(MBP-Ab)ELISA试剂盒(R&D,E0900043),γ-干扰素(IFN-γ)ELISA试剂盒(R&D,0902281),α-肿瘤坏死因子(TNF-α)ELISA试剂盒(R&D,0903031),白介素-2(IL-2)ELISA试剂盒(R&D,0902251);一抗:兔抗Bcl-2、Bax(Santa Cruz进口分装,H2208、H2446);二抗:鼠两步法试剂盒(中杉金桥,8557);DAB显色试剂盒(中杉金桥,457500A)。
1.3 仪器设备
Varioskan Flash多功能酶标仪(美国Thermo); 725型-86℃低温冰箱(美国Forma);AG204-电子分析天平(瑞士Mettler);HM 335E型轮转切片(德国Microm);染色机(德国Leica);AP280组织包埋机(德国Microm);脱水机(德国Microm);Axiovert 200荧光倒置显微镜(德国Zeiss)。
1.4 W istar大鼠肾上腺切除
取220~240 g W istar大鼠45只,预饲养7 d后,腹腔注射3.0%戊巴比妥钠(45 mg/kg),剃去腹部被毛,在中线肋角处横向切口,切除双侧或单侧肾上腺各15只大鼠,其余15只大鼠行假手术。术后以5%生理盐水(含1%葡萄糖)代饮水,恢复7 d后实验。
1.5 GPSCH-CFA的配制
用3%戊巴比妥钠麻醉豚鼠,放血后迅速取出脊髓,用生理盐水制成50%的豚鼠全脊髓匀浆(GPSCH),与等量的含1mg/m L卡介苗的完全弗氏佐剂(CFA)混合,用注射器抽打至GPSCH-CFA油包水乳剂。
1.6 GPSCH-CFA诱导EAE实验
将0.4 m L GPSCH-CFA注入单、双侧肾上腺切除的大鼠和Lewis大鼠双后脚掌进行免疫。设单侧肾上腺切除组、双侧肾上腺切除组、假手术组、Lewis大鼠组,每组15只。另取15只正常W istar大鼠做正常组,实验期间隔天记录体重和进行神经功能评分。免疫23 d后,大鼠EAE症状进行评价和病理学观察和细胞因子的测定。
1.7 神经功能评分
大鼠EAE神经功能评分,评分标准:无任何临床症状为0分,尾部张力消失为1分,后肢无力为2分,后肢瘫痪为3分,后肢瘫痪伴前肢无力为4分,全身瘫痪或濒临死亡为5分。
1.8 皮质类固醇、M BP抗体和Th1细胞因子测定
免疫23 d后,各组大鼠取血,3000 r/m in离心10 min,分离血清,参照ELISA试剂盒说明书,用竞争法测定血清中MBP抗体和皮质醇,用双抗体夹心法测定血清中IFN-γ、TNF-α和IL-2。
1.9 免疫组织化学法检测Bcl-2/Bax蛋白表达
大鼠用3%戊巴比妥钠麻醉,从心脏灌注4%多聚甲醛进行在体固定,取脑组织,保存于4%多聚甲醛48 h后,取材、脱水、包埋,行4 μm切片,切片经脱腊至水,3m L/L H2O2室温孵育10 min,高压修复5 m in,一抗1∶100稀释,4℃过夜,二抗37℃孵育30 m in,DAB室温显色3~10 m in(显微镜下控制显色程度)。各步骤间用0.01 mol/LPBS(pH 7.2)充分洗涤3 m in×3次。苏木素复染,常规脱水、透明、封片。对照实验用PBS代替一抗。应用图像分析系统Image-Pro-Plus5.0进行大脑皮层和下丘脑Bcl-2和Bax的阳性细胞面积分析,在10×40倍光学显微镜下各个组织随机选取6个不重复的视野,计算阳性细胞的面积,并取均值进行统计分析。
1.10 统计学分析
2 结果
2.1 一般观察和体重变化
Lewis大鼠在免疫后9~10d出现临床症状和体重明显下降,双侧切除肾上腺的W istar大鼠在免疫后12~15 d出现临床症状和体重明显下降,表现为尾部无力、拖垂、活动明显减少,后肢无力、麻痹,伴有大小便失禁,严重者四肢麻痹,瘫痪,其中双侧切除肾上腺的W istar大鼠死亡1只。单侧切除肾上腺的Wistar大鼠和假手术的W istar大鼠在免疫后12~15d出现轻微临床症状和体重略有下降,但免疫后21d体重有所恢复。各组体重变化见图1。

图1 各组大鼠平均体重变化Fig.1 Changes of the mean weight of rats in each group
2.2 神经症状评分和发病率
Lewis大鼠在免疫后9~10 d均出现临床神经症状,平均神经症状评分最高为3.10分,发病率为100%;双侧切除肾上腺的W istar大鼠在免疫后12~15 d均出现临床神经症状,平均神经症状评分最高为4.60分,发病率为100%;单侧切除肾上腺的W istar大鼠和假手术的W istar大鼠在免疫后12~15 d部分出现临床神经症状,平均神经症状评分最高分别为1.19分和0.83分,发病率分别为73.33%和 58.33%。各组神经症状评分变化见图2。

图2 各组大鼠平均神经症状评分变化Fig.2 Change of the mean clinical scores of rats in each group
2.3 皮质醇和M BP抗体水平的变化
与正常组比较,Lewis大鼠和单、双侧切除肾上腺W istar大鼠血清中皮质醇水平明显降低(P<0.05,P<0.01);与假手术和单侧切除肾上腺大鼠比较,Lewis大鼠和双侧切除大鼠血清中皮质醇水平明显降低(P<0.05,P<0.01)。与正常组比较,假手术与单、双侧切除肾上腺W istar大鼠和Lewis大鼠免疫后血清中MBP抗体水平明显升高(P<0.01);与假手术组大鼠比较,双侧切除肾上腺W istar大鼠和Lewis大鼠血清中MBP抗体水平明显升高(P<0.05)。见表1。
表1 各组大鼠的血清中皮质醇和MBP抗体水平的变化(±s)Tab.1 Changes in the levels of serum cortisol and MBPAb in rats of each group(±s)

表1 各组大鼠的血清中皮质醇和MBP抗体水平的变化(±s)Tab.1 Changes in the levels of serum cortisol and MBPAb in rats of each group(±s)
注:与正常组比较,aP<0.05,aaP<0.01;与假手术组比较,bP<0.05,bbP<0.01;与单侧切除组比较,cP<0.05,ccP<0.01.Note:Compared with the control group,aP<0.05,aaP<0.01; Compared with the sham-operation group,bP<0.05,bbP<0.01; Compared with the unilateral adrenalectomy group,cP<0.05,ccP<0.01.
组别Group皮质醇(ng/m L) Cortisol MBP抗体(ng/m L) MBP-Ab正常组Control group 360.5±29.6 9.94±3.77假手术组Sham-operation group 336.6±37.1 15.99±2.37aa单侧切除组Unilateral adrenalectomy group 315.6±36.9a16.34±3.20aa双侧切除组Bilateral adrenalectomy group 193.5±49.7aabbcc18.81±2.23aabLewis大鼠组Lewis rat group 233.1±69.7aabbc20.12±3.48aab
2.4 Th1细胞因子水平的变化
与正常组比较,Lewis大鼠和单、双侧切除肾上腺Wistar大鼠血清中IFN-γ、TNF-α、IL-2水平均明显升高(P<0.05,P<0.01);与假手术组比较,Lewis大鼠和双侧切除大鼠血清中IFN-γ水平明显升高(P<0.05),Lewis大鼠血清中TNF-α水平明显升高(P<0.05);Lewis大鼠和双侧切除肾上腺的Wistar大鼠血清中IFN-γ、TNF-α、IL-2水平均高于单侧切除肾上腺W istar大鼠,但差异无显著性(P>0.05)。见表2。
表2 各组大鼠的血清中γ-干扰素、α-肿瘤坏死因子和白介素-2水平的变化(±s)Tab.2 Changes in the levels of serum IFN-γ,TNF-α and IL-2 in rats of each group(±s)
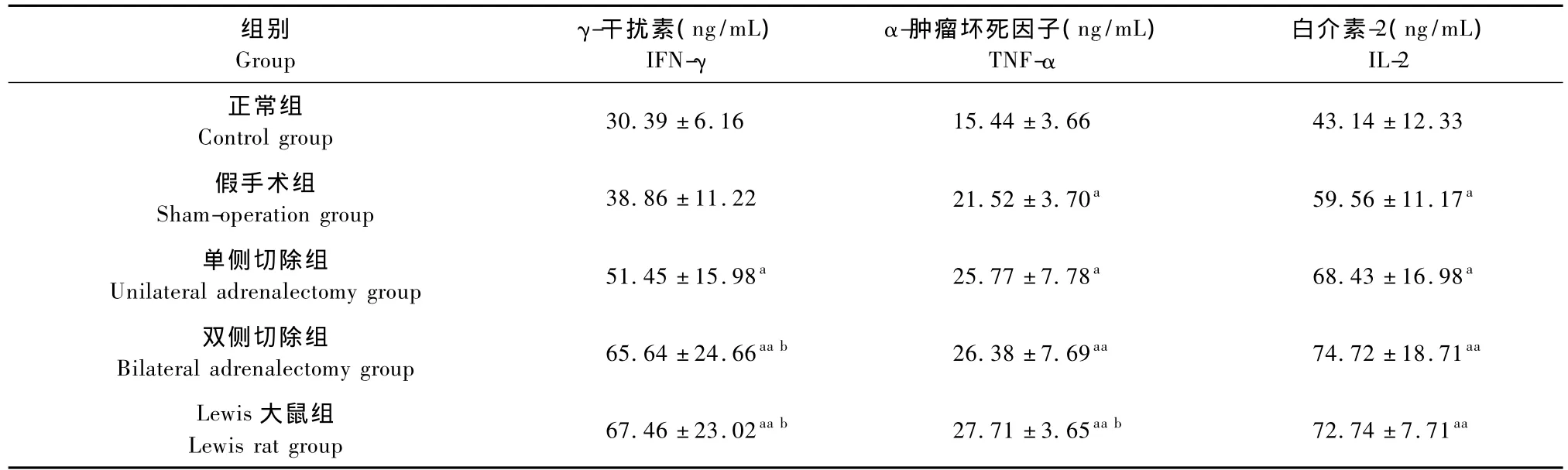
表2 各组大鼠的血清中γ-干扰素、α-肿瘤坏死因子和白介素-2水平的变化(±s)Tab.2 Changes in the levels of serum IFN-γ,TNF-α and IL-2 in rats of each group(±s)
注:与正常组比较,aP<0.05,aaP<0.01;与假手术组比较,bP<0.05,bbP<0.01;与单侧切除组比较,cP<0.05,ccP<0.01.Note:Compared with the control group,aP<0.05,aaP<0.01;Compared with the sham-operation group,bP<0.05,bbP<0.01;Compared with the unilateral adrenalectomy group,cP<0.05,ccP<0.01.
组别Group γ-干扰素(ng/mL) IFN-γ α-肿瘤坏死因子(ng/mL) TNF-α白介素-2(ng/mL) IL-2正常组Control group 30.39±6.16 15.44±3.66 43.14±12.33假手术组Sham-operation group 38.86±11.22 21.52±3.70a59.56±11.17a单侧切除组Unilateral adrenalectomy group 51.45±15.98a25.77±7.78a68.43±16.98a双侧切除组Bilateral adrenalectomy group 65.64±24.66aab26.38±7.69aa74.72±18.71aaLewis大鼠组Lewis rat group 67.46±23.02aab27.71±3.65aab72.74±7.71aa
2.5 大脑皮层和下丘脑Bcl-2/Bax蛋白表达的变化
与正常组比较,Lewis大鼠和单、双侧切除肾上腺Wistar大鼠大脑皮层和下丘脑中Bcl-2蛋白表达均明显降低(P<0.05,P<0.01);双侧切除肾上腺的Wistar大鼠大脑皮层和下丘脑中Bcl-2蛋白表达明显低于假手术组大鼠(P<0.05,P<0.01),且低于单侧切除肾上腺的大鼠,但差异无显著性(P>0.05)。Lewis大鼠和双侧切除肾上腺W istar大鼠大脑皮层和下丘脑中Bax蛋白表达均明显高于正常组、假手术组和单侧切除肾上腺组的大鼠(P<0.05,P<0.01)。见表3。
表3 各组大鼠的大脑皮层和下丘脑Bcl-2/Bax蛋白表达的变化(±s,μm2)Tab.3 Changes of the expression of Bcl-2/Bax in the cerebral cortex and hypothalamus in rats of each group(±s,μm2)

表3 各组大鼠的大脑皮层和下丘脑Bcl-2/Bax蛋白表达的变化(±s,μm2)Tab.3 Changes of the expression of Bcl-2/Bax in the cerebral cortex and hypothalamus in rats of each group(±s,μm2)
注:与正常组比较,aP<0.05,aaP<0.01;与假手术组比较,bP<0.05,bbP<0.01;与单侧切除组比较,cP<0.05,ccP<0.01.Note:Compared with the control group,aP<0.05,aaP<0.01;Compared with the sham-operation group,bP<0.05,bbP<0.01;Compared with the unilateral adrenalectomy group,cP<0.05,ccP<0.01.
组别Group大脑皮层(Cerebral cortex)下丘脑(Hypothalamus) Bcl-2 Bax Bcl-2 Bax正常组Control group 5356.4±1986.9 344.9±129.7 6310.9±1532.6 304.4±106.1假手术组Sham-operation group 3142.4±728.5a358.1±90.4 4560.4±1206.7a380.7±111.7单侧切除组Unilateral adrenalectomy group 2665.9±590.2a404.7±142.6 2702.3±284.6aab423.9±156.2双侧切除组Bilateral adrenalectomy group 1847.2±504.7aab632.4±135.2abc2357.6±287.7aabb811.5±162.3aabbccLewis大鼠组Lewis rat group 1700.0±672.1aabbc657.4±101.3aabbc2507.2±537.1aabb1095.1±317.8aabbcc
3 讨论
研究报道,Lewis大鼠体内存在HPA缺陷,血浆中检测到的皮质类固醇水平很低,这可能是Lewis大鼠易感EAE的主要原因之一。因为机体在正常应激时,HPA是免疫调节的负反馈环路,HPA功能低下时机体易患自身免疫性疾病;皮质类固醇能抑制Th1细胞的产生,Th1分泌IL-2、TNF-γ和TNF-α,这些细胞因子刺激B淋巴细胞产生大量的自身抗体,从而引发EAE疾病;皮质类固醇还可诱导TGF-β生成,而大量研究证明TGF-β、IL-10可以预防EAE的复发[6]。
本实验通过切除W istar大鼠的肾上腺来损伤HPA功能,使其体内皮质类固醇下降,Th1细胞因子增多,免疫应答提高。实验中发现Wistar大鼠切除肾上腺后,大鼠血清皮质醇水平显著降低,但切除两侧肾上腺的大鼠血清皮质醇水平降低至正常W istar大鼠的50%,略低于正常Lewis大鼠的皮质醇水平。各组大鼠通过GPSCH-CFA诱导后,双侧、单侧切除肾上腺的W istar大鼠和假手术的W istar大鼠在平均神经症状评分最高分别为4.60、1.19和0.83分,发病率分别为100%、73.33%和58.33%。W istar大鼠两侧肾上腺切除后,临床评分高于Lewis大鼠的评分,说明两侧肾上腺切除的W istar大鼠对诱发EAE的敏感性增加。
辅助性T细胞亚群(Th)及其细胞因子在MS和EAE的发病机制及治疗中有重要的作用。根据细胞因子分泌模式,CD4+T细胞可分为Thl和Th2亚群,Thl主要分泌IL-2,TNF-γ和TNF-α,称为Th1型细胞因子;Th1介导细胞免疫、细胞毒性T细胞(CTL)和巨噬细胞活化以及迟发型超敏反应(DTH)[7-9]。实验中发现单、双侧切除肾上腺W istar大鼠血清中IFN-γ、TNF-α、IL-2水平均高于假手术组的大鼠,且Lewis大鼠和双侧切除肾上腺的Wistar大鼠血清中IFN-γ、TNF-α、IL-2水平均高于单侧切除肾上腺W istar大鼠。
细胞凋亡是普遍存在于组织细胞内的细胞死亡的形式之一,是不同于坏死的正常生理性的程序性细胞死亡,Bcl-2家族蛋白在调节细胞凋亡过程中起重要作用,Bcl-2是抑制细胞凋亡的基因,而Bax作为Bcl-2的同源体其作用是抑制Bcl-2发挥作用,Bax的过度表达能诱导细胞凋亡[10]。双侧切除肾上腺的W istar大鼠大脑中Bcl-2蛋白表达明显低于假手术大鼠和单侧切除肾上腺的大鼠。双侧切除肾上腺W istar大鼠大脑皮层和下丘脑中Bax蛋白表达均明显高于正常组、假手术组和单侧切除肾上腺组的大鼠,且与Lewis大鼠的Bcl-2/Bax蛋白表达相当。
肾上腺切除导致HPA功能缺陷能显著增加Wistar大鼠诱发的EAE的敏感性。为EAE模型的建立提供了一种新的制作方法,并为人类多发性硬化症的预防治疗研究和药物筛选与评价研究提供理论基础。
[1]Johs LD,Flanders KC,Ranges GE,et al.Successful treatment of experimental allergic encephalomyelitis with transforming growth factor-β1[J].Immunology,1991,147:1792.
[2]Kuhahaann T,Lingfeld G,Bitsch A,et al.Acute axonal damage in multiple sclerosis is most extensive in early disease stages and decreased over time[J].Brain,2002,125:2202-2212.
[3]周璟,张家胜,马宝骊,等.实验性自身免疫性脑脊髓炎大鼠模型的建立[J].上海第二医科大学学报,2002,22(1): 16-19.
[4]邢清和,郑荣远,王永铭,等.W istar大鼠过敏性脑脊髓炎动物模型的建立[J].上海第医科大学学报,2000,27(6): 471-477.
[5]Roitt I,Brostoff J,Male D.免疫学[M].人民卫生出版社. 2002,181-183.
[6]Hofstetter HH,Shive CL,Forsthuber TG.Pertussis toxin modulates the immune response to neuroantigens injected in incomplete Freund's ad juvant:induction of Th1 cells and experimental autoimmune encephalomyelitis in the presence of high frequencies of Th2 cells[J].Immunology.2002,169(1): 117-25.
[7]Liblau RS,Singer SM,Dicdevitt HO.Thl and Th2 CD4+T cells in the pathogenesis of organ-specific autoimmune disease[J]. Immunol Today,1995,16:383-384.
[8]刘俊铎,刘志红.Th1/Th2细胞与自身免疫性疾病[J].肾脏病与透析肾移植杂志,1997,6(6):555-560.
[9]吴抒见,陈娟,朱高发,等,豚鼠实验性变态反应性神经炎模型的建立及电生理、免疫等指标的观察[J].中华神经精神科杂志,1995,28(6):366-369.
[10]Condorelli G,Morisco C,Stassi C,et al.Increased cardiomyocyte apoptosis and changes in proapoptotic and antiapoptotic genes bax and bcl-2 during left ventricular adaptation to chronic pressure overload in therat[J].Circulation 1999,99:3071-3078.
In fluence of Excision of Adrenal G land on the Sensitivity to Experim ental Autoimm une Encephalom yelitis in Rats
SHOU Qi-yang1、2,CHEN Fang-ming2,JIA Lin-chao2,FANG M ing-sun2,ZHOU Wei-m in2,CHEN Min-li2
(1.Zhejiang University College of Animal Sciences,Hangzhou 310029,China; 2.Zhejiang Chinese Medical University Laboratory Animal Research Center,Hangzhou 310053)
ObjectiveTo study the effect of dysfunction of the hypothalamus-pituitary-adrenal(HPA)axis induced by excision of adrenal gland on the sensitivity to experimental autoimmune encephalomyelitis(EAE)in rats.MethodsThe EAE was induced by GPSCH-CFA after the removal of adrenal gland in W istar rats.The clinical scores,MBP antibody and cortisol were tested and the change of Th1 cytokines and Bcl-2/Bax expression in brain was assayed. The results were compared with that in Lewis rat EAE models.ResultsThe highest nervous symptom score of W istar rats after adrenalectomy was 4.6 and incidence rate was 100%.The serum cortisol level decreased and MBP antibody level increased significantly(P<0.05,P<0.01),the level of IFN-γ,TNF-α and IL-2 increased significantly(P<0.05,P<0.01),and the Bcl-2 expression was significantly decreased and Bax expression was significantly increased in the cerebral cortex and hypothalamus(P<0.05,P<0.01).ConlusionExcision of adrenal gland causes dysfunction of hypothalamus-pituitary-adrenal axis and increases the sensitivity to experimental autoimmune encephalomyelitis in W istar rats.
W istar Rats,Adrenalectomy,Cortisol,Th1 Cytokines;Experimental autoimmune encephalomyelitis,EAE
2010-01-18
浙江省医药卫生科学研究基金(2007B152);“浙江省卫生高层次创新人才培养工程项目”资助。
寿旗扬(1979-),男,研究方向:动物实验和比较医学,E-mail:sqy133@126.com
陈民利(1963-),女,教授,研究方向:比较医学,E-mail:minlichen01@yahoo.com.cn
R593.2
A
1005-4847(2010)04-0350-05

