合成4(2)-溴代甲苯的新工艺研究
张书文,侯林艳,潘雪静,柏雪
(河北大学化学与环境科学学院,河北保定071002)
合成4(2)-溴代甲苯的新工艺研究
张书文,侯林艳,潘雪静,柏雪
(河北大学化学与环境科学学院,河北保定071002)
研究了以水为溶剂,以甲苯和Br2为原料,在合成4-溴甲苯和2-溴甲苯的同时也回收了HBr的新工艺。通过实验确定并优化了反应条件,其最佳工艺条件为:反应物的摩尔比为n(甲苯)∶n(溴)=1∶1;反应温度为20~25℃;溴代反应时间为2.5h;4-溴甲苯的收率可达66.4%,邻溴甲苯的收率可达24.7%;氢溴酸的含量为44.7%~45.1%,收率达80%以上。与重氮盐法相比,本工艺方法的特点是:原料价格低廉,一次反应可得到3种产品,原子利用率几乎达到100%,一次加入的水、H2SO4和Fe可以反复循环使用,整个工艺过程基本实现了零排放,从而大大降低了原料成本,极大地提高了经济效益;对环境无污染,符合节能减排的要求,属于环境友好的绿色化学工艺;工艺操作方便,设备简单,适合于规模化生产。
4-溴甲苯;2-溴甲苯;氢溴酸;原子经济性;环境友好
4-溴甲苯、2-溴甲苯及HBr都是十分重要的有机合成中间体,广泛用于染料、医药、农药及香料等诸多领域,如对溴甲苯是合成农药物溴螨酯的重要原料[1],氢溴酸是合成各种无机、有机溴化物的基本原料,如在医药工业用于合成镇静剂和麻醉剂、止咳药等医药用品[2]。两种溴代甲苯主要是通过甲苯的直接溴代[3]和对甲苯胺重氮盐的Sandmeyer反应[4-6]两种方法合成的。多年来,人们一直认为甲苯直接溴代法所得到的两种溴甲苯的邻对位异构体分离比较困难,而作为医药原料的4-溴甲苯需要较高的纯度,因此,目前工业上都是以4(2)-甲苯胺为原料先进行重氮化再采用sandmeyer反应来合成4(2)-溴甲苯。此法虽然所的产物的纯度较高,但其缺点也是非常突出的,首先,该工艺所用的主要原料4(2)-甲苯胺并非基本的化工原料,追其来源仍需用甲苯经硝化、还原合成,而且硝化产物中对硝基甲苯的比例很低[7],也导致用其合成的对甲苯胺价格昂贵;另外该反应工艺操作复杂,除重氮化反应需要低温外,主要体现在制备溴代试剂CuBr-HBr溶液的过程,该过程不仅操作繁琐、耗时较长而且还要使用CuSO4或Cu、NaBr、(Na)2SO3、以及H2SO4等多种反应原料。因此,无论从原料成本、原子经济性、工艺操作、环境保护、节能减排以及生产成本等各方面考虑此合成方法均非合理。随着精细化工领域的不断发展、环境保护以及节能减排的要求,研究开发新的工艺方法是十分必要的。
本文首次提出了用水做溶剂,通过甲苯的溴代、磺化、水解等简单步骤合成并分离得到了溴代甲苯的两种异构体4-溴甲苯和2-溴甲苯,同时也回收了氢溴酸,而且所得4-溴甲苯的纯度达到97.98%,2-溴甲苯的纯度则达到99.4%,完全达到或超过了重氮盐法产品的质量。本方法的特点是工艺路线简短,原料价廉,操作方便,对环境无污染,用作溶剂的水可以吸收甲苯溴代反应过程中产生的HBr使成为氢溴酸,无需格外进行HBr的吸收,即可回收恒沸氢溴酸,不仅简化了装置,避免了HBr外泄对设备的腐蚀和环境破坏同时也制得了氢溴酸,提高了经济效益。

1 实验部分
1.1 仪器与试剂
VG-7070E型质谱仪(英国VG公司);VECTOR 22红外光谱仪(德国Bruker公司);GC4000A气相色谱仪(北京东西电子);2WAJ阿贝折光仪(上海索光);XT-4型双目显微熔点测定仪(北京泰克仪器有限公司);温度计(未校正)。
甲苯(工业品);Br2、98%H2SO4、还原铁粉均为市售化学纯。
1.2 合成方法
三口烧瓶上安装搅拌器、温度计、滴液漏斗和装有回流冷凝管的分水器,烧瓶外用冷水浴。向烧瓶中加入0.3g铁粉、46g(0.5mol)甲苯和60mL水,滴液漏斗中加入80g(0.5mol)Br2,再加入10mL水覆盖在Br2的表面以减少溴的挥发。将反应物搅拌均匀并保持温度在20~25℃之间,缓慢滴加Br2,反应物溶液颜色由起初Br2的红色变为浅黄色,随着Br2的不断滴加,溶液颜色变为红棕色,控制反应温度并保持滴入的溴迅速褪色,直至全部滴加完。最后用滴液漏斗中覆盖Br2的水将Br2全部洗入反应烧瓶中,继续搅拌0.5h使溴代反应完全,即得到对溴甲苯、邻溴甲苯和氢溴酸3种产物的混合物,然后按照下列步骤进行分离。
1.2.1 氢溴酸的分离将上述反应混合物加热进行蒸馏,馏出液进入分水器中。当温度达到122℃时蒸出的馏液中除大部分水以外还有溴代甲苯和极少量的HBr,打开分水器阀门将沉于分水器底部的溴甲苯放回烧瓶,并将上层废水放出。继续蒸馏收集122~126℃馏分于分水器中(其中仍有溴甲苯沉于底部,待蒸馏结束将其放回烧瓶)共得到馏出液74g,经0.5mol·L-1NaOH溶液滴定,溶液中氢溴酸的含量为45.4%,收率为81%。
1.2.24 (2)-溴甲苯的分离通过滴液漏斗向已蒸除氢溴酸的烧瓶中加入27.6g(0.28mol)98%H2SO4,充分搅拌下加热烧瓶使烧瓶内温度达到110℃,彻底蒸除烧瓶中剩余的水,然后小心升温并维持温度在110~120℃搅拌反应2 h。然后冷却至40℃以下加入75mL水,充分搅拌后分出下面油层为4-溴甲苯粗品。将分出油层后的水层加入烧瓶中加热蒸馏除水,此时又蒸出对溴甲苯粗品2.5g,将其与前述油层合并。继续加热烧瓶至180℃,然后进行水蒸气蒸馏,蒸出邻溴甲苯,分离除水,干燥后再进行蒸馏,收集181~182℃馏分(lit:179~182℃)得到邻溴甲苯20.4g,收率24%(以甲苯计)。IR(KBr)ν:3016、2962、1597、1381、745 cm-1;MS m/z(%):170(M+,36),172(M++ 2,35.4)。
再将油层4-溴甲苯用水洗涤二次至中性,分离干燥后常压蒸馏收集183~185℃馏分,得到4-溴甲苯56.6g,产率为66.2%(以甲苯计),产物冷却至27℃(lit:27~28℃)凝固成白色结晶。IR(KBr)ν:3026、2961、1626、1487、1379、801cm-1;MSm/z(%):170(M+, 39.2),172(M++2,38.1)。
2 结果与讨论
2.1 反应中水的作用其循环利用
在传统的溴代反应中一般不使用溶剂而直接进行溴代,由于溴代反应为放热反应,如果温度控制不好往往会产生二取代产物,本实验中加入了水作为溶剂可以吸收部分热量,使温度升高不明显,可以很方便地控制反应的温度在20~25℃之间。此外,水的存在可以随时吸收溴代产生的HBr气体,不仅免除了格外安装的吸收装置,也避免了HBr的外溢带出Br2的蒸气而导致溴的损失以及对环境和设备的破坏,同时也回收了HBr制得了产品氢溴酸,原料Br2的利用也更加充分。
蒸馏制取氢溴酸时在122℃以前产生的馏分中主要是水和少量HBr,而经水蒸汽蒸出2-溴甲苯后的最终残液中主要是水、溴化铁(起初加入的铁已与氢溴酸反应成为FeBr3)及H2SO4,为了充分利用其中各种物料,本实验将其二者合并后直接转入下批合成反应,效果与第一次投料完全相同,从而使H2SO4和Fe始终循环使用,使整个工艺过程基本实现了零排放。
2.2 Br2的用量、反应温度与反应时间
本实验中的反应属于芳环上的亲电取代反应,用铁作为催化剂,由于甲基的供电子性使反应很易发生,在室温下即可顺利进行,故对反应的温度无需特别考察。该反应为放热反应,为了使反应不产生二溴代物以保证产品的纯度,本实验将甲苯与溴的投料量确定为1∶1摩尔,并在反应开始阶段用冷水冷却烧瓶以控制反应温度保持在20~25℃。由于该反应在常温下即可顺利进行,因此,也应该适当控制Br2的滴加速度,为此本实验考察了在不同的时间内加完Br2对收率的影响,结果列于表1中。

表1 Br2的滴加时间对收率的影响*Tab.1Effect of bromine addition time on the yield
由表1可见,滴加Br2的速度对产率有一定影响,滴加Br2的时间应在2h以上,滴加过快可导致Br2的浓度过大而产生二溴代物,也会导致Br2蒸气溢造成出损失,从而导致产率较低。本实验采取2h内加完,并保持烧瓶中的Br2都能及时褪色即可,全部Br2加完后继续搅拌反应0.5h。经多次反应证明,按此条件进行反应,各种产物的收率是稳定的,实验结果见表2。
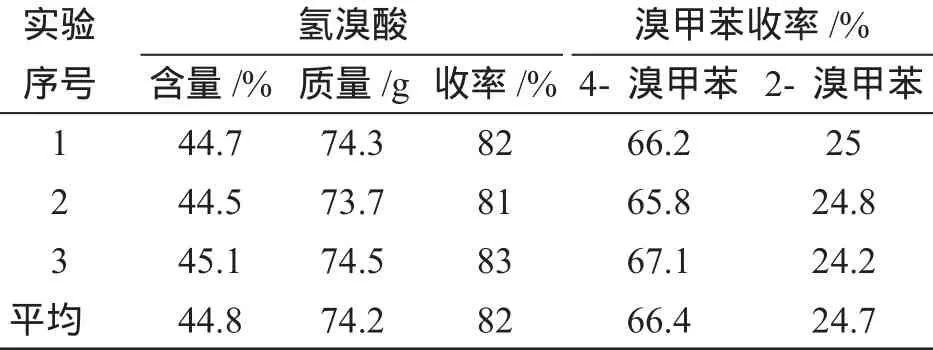
表2 反应收率的稳定性Tab.2Stability of reaction yield
2.3 各种产物的质量问题
本实验中的氢溴酸是通过普通蒸馏收集122~126℃的馏分得到的恒沸物,由表2中的数据可见,仅此一次蒸馏其浓度就已达到并稳定在45%左右,已能满足一般工业使用。
甲苯溴代时可生成邻位和对位两种异构体,其中以对位为主。从表2中可见,对位和邻位异构体的比例平均在2.69∶1。两种产物的纯度也较高,本实验仅经过一次普通蒸馏所得的4-溴甲苯和2-溴甲苯通过GC4000A气相色谱仪分析(SE30色谱柱,氢火焰离子化验检测器,柱温130℃,面积归一化法)其纯度分别为97.98%和99.40%,折光率分别为1.5475和1.5561。
3 结论与展望
以水为溶剂用溴作溴化剂,通过甲苯的溴代反应,高收率合成了4-溴甲苯、2-溴甲苯和氢溴酸3种产物,其溴代反应的最佳工艺条件为:n(甲苯)∶n(溴)= 1∶1,反应温度为室温,溴代反应时间为2.5 h。4-溴甲苯和2-溴甲苯的收率均分别为66.4%和24.7%,其纯度分别为97.98%和99.40%,氢溴酸的含量达到44.7%~45.1%,收率可达81%(以HBr计)。与重氮盐法相比,本工艺方法具有以下特点:原料来源丰富,价格低廉;不使用任何有机溶剂和无机试剂,原子利用率几乎达到100%,对环境无污染,属于环境友好的绿色化学工艺;溴代反应在常温下进行无需加热,用作溶剂的水、H2SO4和Fe可以循环使用,大大降低原料成本;最大程度的满足了资源节约型和环境友好型的现代化工节能、减排的要求;工艺操作方便,设备简单,适合于规模化生产,与重氮盐法相比具有显著的优势。
[1]张正红,吕亮.制备溴螨酯的新工艺[J].合成化学,2009,17(3): 392-393.
[2]牛福水,欧育湘,高富业,等.回收溴化氢生成溴的两种新工艺[J].化工进展,1997,(5):53-55.
[3]Christophe-Henrl Plerre Lusson.Process for the preparation of p-Bromotoluene[P].U.S.:5974659,1999-02-23.
[4]高春香,杨希越,张静,等.对溴甲苯的合成工艺研究[J].辽宁化工, 2007,36(2):73-74.
[5]李斌栋,吕春绪.溶剂法合成对溴甲苯[J].淮海工学院学报, 2000,9(4):25-26.
[6]章思规.精细有机化学品技术手册(上册)[M].北京:科学出版社,1992.335-336.
[7]章思规.实用精细化学品手册有机卷(下)[M].1869-1870.
A new synthetic technics of 4(2)-bromotoluene
ZHANG Shu-wen,HOU Lin-yan,PAN Xue-jing,BAI Xue
(College of Chemistry and Environment Science,Hebei University,Baoding 071002,China)
Using water as solvent,4-Bromotoluene and 2-bromotoluene were synthesized which were prepared with bromum and toluenel.Hydrobromic acid was also recovered.The optimum reaction condition is under a 1∶1 molar ratio of n(Toluenel)∶n(Bromum)=1∶1 at 20~25℃for 2.5 h,under which the yield of 4-Bromotoluene is 66.4%,the yield of 2-Bromotoluene is 24.7%,hydrobromide content is 44%~46%,the yield is 80%.Compared with the diazonium salt,the process method is characterized by low-priced raw materials,and the atomic use factor achieves 100%nearly,and the water,the sulfuric acid and the iron can be recycled repeatedly,the entire technological process realize zero emission basically,thus reduce the cost of material greatly,raised the economic efficiency greatly;it do not pollute the environment,which belongs to the environment friendly green chemical technology;The craft is easy,the equipment is simple,suits in the formalization production.
p-bromotoluene;o-bromotoluene;hydrobromic acid;atom economy;environment friendly
book=2010,ebook=272
TQ244.4
A
1002-1124(2010)11-0015-03
2010-09-16
张书文(1952-),男,教授,主要从事精细有机合成研究。

