不同负荷间歇负重跑训练对老龄大鼠骨骼肌MG29蛋白的影响
李文惠,赵 斌,闫万军
不同负荷间歇负重跑训练对老龄大鼠骨骼肌MG29蛋白的影响
李文惠,赵 斌,闫万军
目的:研究不同负荷负重跑训练对老龄大鼠骨骼肌内MG29蛋白(Mitsugumin29)表达的影响,探寻衰老性肌肉丢失(Sarcopenia)及其可训练性的机理。方法:32只17月龄的雄性Wistar大鼠被随机分为较大负荷运动组(HG)、中等负荷运动组(MG)和较小负荷运动组(L G)和对照组(CG),运动组各鼠分别负重其最大负荷的30%、50%和60%进行跑台训练8周,每周6次,周日休息,每次跑2 min,间隔2 min为1组,共训练6组。每周称量所有大鼠体重,8周后取材,光镜下观测骨骼肌的一般形态,测定各鼠股直肌中段的匀浆脂褐质浓度、钙浓度,并采用Western Blot法测定股直肌中段的MG29蛋白的表达水平。结论:1)较小或中等强度的间歇负重跑运动对于延缓老龄大鼠骨骼肌的衰老来说是比较适宜的运动刺激,它能够有效提高骨骼肌内MG29蛋白的表达水平,从而使骨骼肌维持正常的兴奋收缩偶联结构,并促进胞外钙流入,从而保持或增强骨骼肌的正常收缩功能,相对降低细胞内的自由基水平,从而延缓了因衰老所致肌肉萎缩、丢失。2)较大强度的间歇负重跑运动是不适宜的运动刺激,该强度下运动使MG29蛋白水平减低,可能使骨骼肌的收缩功能减弱,且骨骼肌内的自由基水平显著升高,脂褐质大量蓄积。
衰老;衰老性肌肉丢失;钙稳态;MG29蛋白;负重跑;鼠;动物实验
骨骼肌组织是有机体内最复杂的组织之一,人类成年后,随着年龄的增长,骨骼肌的功能和结构便逐渐发生退行性变化(Sarcopenia)[32],这也加速了心血管系统、神经系统及内分泌等其他各器官系统的衰老[16,38]。因此,研究骨骼肌的衰老问题也是延缓整个机体衰老的重点,只有使骨骼肌维持正常的兴奋收缩耦联功能,才有助于其他器官功能的正常发挥。
骨骼肌的肌浆膜垂直内陷入肌纤维形成了横管系统,横管系统与其两侧的纵管系统(即肌浆网在靠近横管处的膨大部分)共同构成的复合机构又被称为三联管,三联管和肌浆网共同作为骨骼肌内兴奋收缩耦联的结构基础,对骨骼肌的功能发挥起着关键作用[2]。Mitsu gumin 29 (MG29)蛋白是新发现的位于三联管复合结构的横管膜上的小分子蛋白[25],学者们研究发现,该蛋白对三联管和肌浆网的早期发育[19]以及成年后正常形态的维持[29]均起重要作用。研究发现,MG29蛋白与骨骼肌衰老关系密切[5],衰老大鼠骨骼肌中的MG29蛋白与正常青年鼠相比减少了约50%[26],Zhao[39]等人将正常青年鼠的MG29蛋白基因敲除,MG29缺失的青年鼠的骨骼肌出现了类似衰老鼠的特征,如肌力衰退,易疲劳,以及电镜下观察发现的三联管结构和功能的严重破坏:横管系统肿胀,肌浆网出现空泡或者碎裂,钙火花的动态活性降低,出现隔离的钙池等。因MG29蛋白的氨基酸序列类似突触素[26],学者们推测该蛋白可能对横管系统和肌浆网间的信号传导起重要作用,研究表明,该蛋白可直接调控兴奋收缩耦联的关键蛋白I型兰诺丁受体(RYR1),因而,促使肌浆网内的钙离子释放入胞浆,增强肌肉收缩功能,同时,该蛋白也能够探测肌浆网内的钙储存,具有当肌浆网内钙浓度降低时,调动肌细胞外的钙流入胞浆以补充亏空的钙库的功能[24]。
诸多实验已经证实了Sarcopenia肌肉的可训练性[23,34],但其内在机理尚须探讨,运动训练与老龄肌肉的MG29蛋白表达之间是否有相关性,其相关性如何,目前尚未发现相关研究。本研究旨在探寻不同参数的间歇负重跑运动训练与老龄骨骼肌的MG29蛋白表达之间的相关性,探讨运动干预Sarcopenia问题的可能机制,从而为后续进行运动抗衰老的研究提供新的思路和科学依据,为延缓衰老提供理论依据,并期望为老年人进行健身锻炼提供指导和理论依据,为延长个人健康寿命和推动整个社会的进步尽绵薄之力。
1 材料与方法
1.1 实验动物与分组
17月龄的雄性Wistar健康大鼠32只,平均体重500~520 g,均为清洁级,由河北省动物实验中心提供。大鼠购回后在河北师范大学体育学院动物房内进行分笼饲养,每笼4只,室温控制在22℃±2℃,相对湿度45%~55%,每天自然光照,自由饮水摄食,动物饲料选用国家标准啮齿类动物混合饲料,饲养笼垫料使用高压灭菌消毒垫料,每周更换2次,饲料和垫料亦由河北省动物实验中心提供。
大鼠购回后适应性饲养一周,称量体重,随机分为4组,每组8只,各组间动物的体重无显著性差异(表1)。
表1 本研究实验动物分组情况一览表Table 1 G roups of the Animals (只)
1.2 训练方法
1.无负重适应性训练1周,所有运动组大鼠参加,在跑台上进行跑速为10 m/min,每天30 min的适应性训练,跑台坡度设置为0°。
2.负重适应性训练1周,所有运动组大鼠参加,在跑台上进行跑速为10 m/min,每天30 min的负重适应性训练,跑台坡度设置为0°,负重形式采用在大鼠的腰背部绑缚条形负荷(图1),负重量为其最大负重的10%,其最大负重的获取参考Bedford等和闫万军[13]等人的方法,在大鼠的腰背部施加重物,逐级增加重量,直至其不能正常站立行走,将此时的负重确定为其最大负重强度。
图1 施加负荷方式图Figure 1 The Load-exerted Mode
图2 跑台训练图Figure 2 T readmill T raining
3.正式负重跑训练8周。所有运动组大鼠在跑台上进行为期8周的正式负重跑训练,跑台设置为跑速15 m/ min,坡度0°,以跑2 min,休息2 min为1组,共训练6组,每日1次,周日休息,共训练8周;对各鼠施加的负重量是通过预实验获取各鼠的最大负重,再通过计算其百分比来确定(表2)。
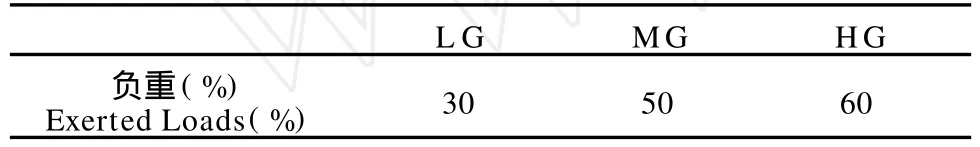
表2 本研究各运动组大鼠负重占其最大负重比一览表T able 2 The Exerted Loads for the EGs Taking the Percentage of Their Maximum Bearing Loads(%)
4.对于安静对照组(CG)的所有大鼠,令其正常饮水摄食,不施加任何运动干预。
1.3 取材
在正式负重跑训练的第8周末,最后一次运动之后,所有大鼠禁食、禁水12 h,称量体重后进行取材。对各鼠腹腔注射1%的戊巴比妥钠溶液进行麻醉,剂量为50 mg/ kg体重,待翻正反射消失后,解剖大鼠,取左侧中段股直肌,去除脂肪,在4℃冰水中清洗,用滤纸吸干表面水分,液氮冻干后,放入-80℃冰箱保存,待测各项指标。
1.4 指标的测试
1.4.1 测量体重和观察一般指标
每周测量大鼠的体重,每天记录摄食量,同时观察大鼠的毛色,精神状态和行为等外观变化。
1.4.2 骨骼肌的形态学指标
组织学方法在临床医学和生物学领域占有十分重要的地位,在光学显微镜下能够直观地了解衰老肌细胞的特征。肌组织苏木精和伊红染色(HE染色)是重要的肌组织染色方法,可将肌细胞的胞浆染为红色,将细胞核染为蓝紫色,从而能够在光学显微镜下清晰地观察肌细胞的一般形态[1]。
本实验取适量骨骼肌组织,制作常规冰冻横切片后,进行HE染色,具体操作步骤:1)将苏木精0.5 g,硫酸铝胺0.3 g和50%乙醇100 ml混合后加热,至开始沸腾后取氧化汞0.6 g,每次少量加入,再沸腾20 min,冷却后放置一夜,过滤后保存。使用时每20 ml原液中加入硫酸铝胺饱和溶液80 ml稀释;2)染色时将载玻片放入苏木精液中10 min后,水洗5~10 min,再放入1%伊红溶液中30 s~1 min,经乙醇脱水后用加拿大树脂封片;3)使用OL YMPUS CX21光学显微镜分别在放大100倍、200倍和400倍时观察每张切片,使用Leica IM50 image manager V1.20分析软件对所选视野进行抓图、存储。
1.4.3 骨骼肌的匀浆指标
1.匀浆脂褐质:脂褐质是不饱和脂肪酸过氧化反应产生的分解物,细胞排泄不出,随年龄增长在体内积聚而增多,被作为组织衰老的重要标志物,常用其在组织中的沉积量来判别组织的衰老程度[37]。在本实验中分别取300 mg左右冻存的骨骼肌组织块,匀浆后采用荧光比色法[37],使用F-4500荧光分光光度计测定各样本脂褐质(LF)的含量。
2.匀浆钙:钙是神经兴奋和肌肉收缩之间的重要耦联因子,肌浆内的钙含量能够直接反应肌肉的收缩功能[14]。本实验采用甲基百里香酚蓝比色法,使用紫外分光光度计测定匀浆肌组织中的钙含量,以期间接反映肌浆内的钙量变化。具体操作步骤按照试剂盒的说明进行。
3.MG29蛋白:本实验中MG29蛋白在骨骼肌内的表达水平采用蛋白免疫印迹法(Western Blot)进行测试,具体测定方法:1)抽提蛋白:在20 mg冷冻肌组织中加入蛋白裂解液后,于冰上匀浆使蛋白充分裂解,而后离心10 min,将离心后的上清-20℃冻存;2)检测蛋白浓度:按照BCA蛋白定量试剂盒的使用说明操作;3)Western Blot:分电泳、转膜、封闭、一抗孵育、二抗孵育、显色/曝光6个步骤,下文详述;4)使用Lab Works软件对图像进行灰度分析,并用Image J软件将灰度值数字化;5)以靶蛋白的灰度值除以内参β-actin的灰度值,从而校正误差,其结果即为该样品靶蛋白的相对含量。
Western Blot的具体操作步骤:1)电泳:分别配制浓度为10%~12%的分离胶和浓度为4%的浓缩胶,加入凝结剂TEMED,灌胶,待胶凝固。上样,开始电泳,浓缩胶电压为80 V,分离胶电压为120 V,待溴酚蓝电泳至胶底部时终止电泳;2)转膜:使用转膜仪转膜约45~90 min将靶蛋白转移至PVDF膜,转膜完毕后放入TBS-T中洗5 min;3)封闭:用TBST配制5%脱脂奶粉,将膜浸入后,室温放置1 h;4)一抗孵育:用封闭液将一抗稀释后将膜与一抗一起孵育,4℃过夜。孵育结束后用TBS-T洗3次,每次5 min; 5)二抗孵育:用封闭液稀释以HRP标记的二抗(Santa cruz)后,将稀释后的二抗与膜共同孵育2~3 h。孵育结束,TBS-T洗3次,每次5 min;6)显色/曝光:用DAB显色试剂盒经适当显色后,用水终止显色;使用ECL化学发光显色液曝光。
数据统计:结果数据采用均数±标准差(X±SD))表示,使用Excel 2003进行数据汇总和绘图,使用统计学软件SPSS 11.5进行统计分析,多组间数据如方差齐就进行单因素方差分析(One Way ANOVA),若有显著性差异则用SNK-q检验进行比较。CG组与运动组的比较则采用Dunnett-t检验。P<0.05为具有显著性差异,P<0.01为非常显著性差异。
2 结果
2.1 老龄大鼠的一般行为表现及其体重变化
大鼠在购回后,精神状态良好,饮食积极,毛色稍有发黄,并伴有不同程度的脱毛现象。训练初期运动组大鼠的饮食积极性稍差,随着时间的推移,其饮食量渐渐增加,乃至明显超过对照组。MG和HG组大鼠在每次训练间歇期和训练后均出现不同程度的疲劳现象,尤以HG组为甚,表现为运动间歇时呼吸急促,俯卧于跑台,不愿活动,但次日再训练时已恢复正常;L G组鼠的疲劳表现则不明显,部分大鼠在运动间歇时站立、张望、继续活动。训练后,运动组大鼠的精神状态明显好于CG组,表现为自主活动较多,对外界刺激的反应更敏感。训练前,各组大鼠的体重无显著性差异,但经过8周的训练,与训练前相比,L G、MG和HG组的体重显著降低,其中,HG组最为明显(P< 0.01)。与训练前相比,安静组大鼠的体重明显增长,训练后各组对比,运动组的体重均显著低于CG组(表3)。整个训练过程中,各组大鼠的体重变化曲线如下:
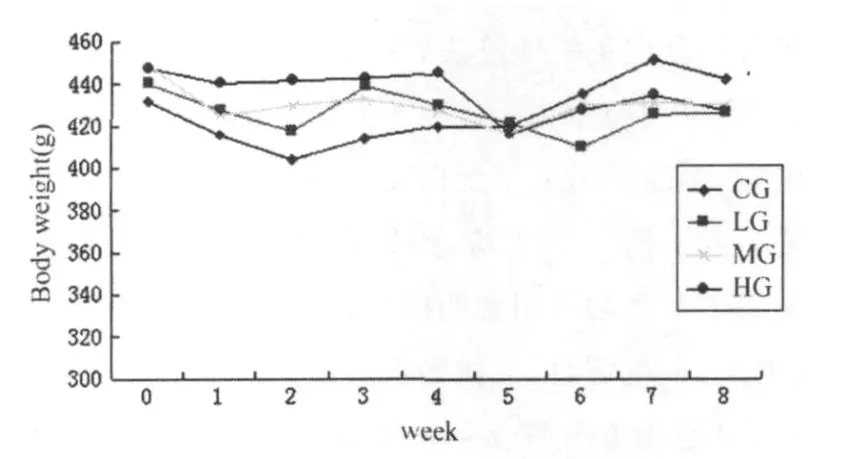
图3 本研究各组大鼠训练前、后体重变化曲线图Figure 3 Curve of the Changing Weights Throughout the T raining
2.2 骨骼肌细胞形态学的变化
2.2.1 前人前期研究结果:青老对比
在光学显微镜下观察老龄鼠的骨骼肌细胞形态,可发现老龄鼠的肌细胞趋向于圆形,且细胞核有向细胞中央移动的趋势,此外还有一些小的呈角状的纤维[6]。本课题组成员[4,13]等对比成年鼠和老龄鼠在光镜下的形态学特征,也证实了上述:在光镜下观察正常成年鼠的骨骼肌组织,肌纤维细胞膜清晰,呈多边形,各个肌纤维大小均匀,且排列致密、整齐,其细胞核位于细胞边缘的肌内膜处;衰老鼠的肌纤维大小不一,排列不齐,细胞间隙增大,中间有白色组织填充,部分肌纤维呈现圆形化,细胞核出现中心化。
2.2.2 本实验研究结果
本实验研究发现,各组老龄大鼠的肌纤维均出现不同程度的圆形化现象,细胞大小不一,排列不齐,且细胞间隙加大,中间有白色组织填充。4组对比,以CG组最为明显,HG组次之,L G和MG组的肌纤维较之其他两组排列更紧密。MG组和HG组的部分肌细胞的直径较大。
表3 本研究各组大鼠训练前、后体重比较一览表T able 3 Comparison of the Weights before and after the Training±SD)(单位:g,各组n=8)

表3 本研究各组大鼠训练前、后体重比较一览表T able 3 Comparison of the Weights before and after the Training±SD)(单位:g,各组n=8)
注:*P<0.05,**P<0.01,与训练前相应组对比;▲P<0.01,★P<0.05,与训练后对照组对比。*P<0.05,**P<0.01,Compared with the corresponding groups before the training;▲P<0.01,★P<0.05, Compared with CG after the training.
CGL GMGHG训练前Before the Training431.50±20.16440.00±37.81448.75±33.57447.50±31.51训练后After the training442.00±31.89*426.67±33.20*▲430.00±32.86*★427.25±39.33**▲
1.光学显微镜下将HE染色样本切片放大100倍时观察(图4)。
2.将HE染色样本切片放大200或400倍时观察(图5)。
2.3 股直肌匀浆脂褐质含量的测定结果与分析
过量的自由基是细胞和组织的危险杀手,它引起机体损伤,使不饱和脂肪酸氧化成超氧化物,形成脂褐质。因机体细胞排泄不出该分解物,所以,随着年龄的增长,脂褐质在体内慢慢积聚而增多。脂褐质常常被作为组织衰老的重要标志物,研究者们常用其在组织中的沉积量来判别衰老程度[37]。本实验的研究结果显示,对照组(CG)和较大负荷运动组(HG)的股直肌的脂褐质浓度相比,无明显差异,较小负荷运动组(L G)和中等负荷运动组(MG)的脂褐质浓度亦无显著差异,但CG组和HG组的脂褐质沉积均显著高于LG组和MG组(表4)。
2.4 股直肌匀浆钙浓度的测定结果
肌肉收缩时调用钙的能力直接反映肌肉的功能,随着年龄的增长,肌肉的内部结构发生变化,使老龄肌肉更多地依赖胞外钙进行收缩[36],本实验测定的静息状态下的匀浆肌肉的钙含量是有机体分配给骨骼肌的总钙量,是肌细胞内外钙量的总和。在本实验中,研究结果显示,运动组各老龄鼠股直肌的钙浓度均高于对照组(CG),尤其是较小负荷运动组即L G组的钙浓度升高得尤为明显(表5)。
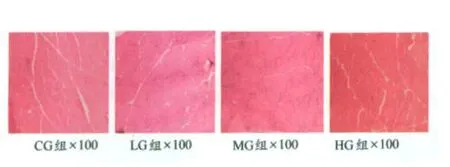
图4 HE染色样本组织切片图Figure 4 Samples of HE Staining×100
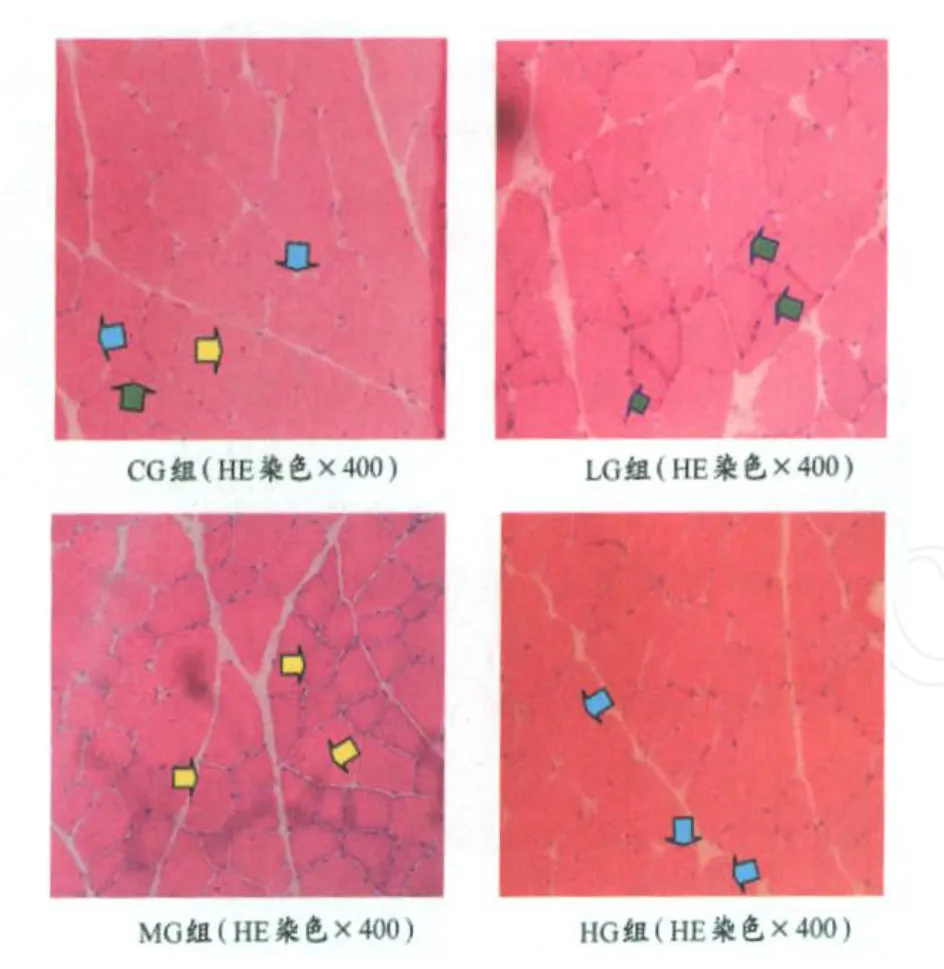
图5 HE染色样本组织切片图Figure 5 Samples of HE Staining
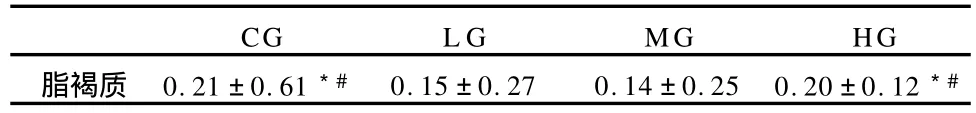
表4 本研究股直肌脂褐质浓度测定结果一览表(单位:μg/g,各组n=8)Table 4 Results of Lipofuscin Detection of Msculi Rectus Femoris
表5 本研究股直肌钙浓度测定结果一览表±SD)(单位:nmol/gprot,n=8)Table 5 Concentrations of Calcium
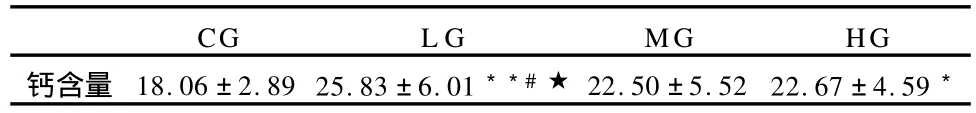
表5 本研究股直肌钙浓度测定结果一览表±SD)(单位:nmol/gprot,n=8)Table 5 Concentrations of Calcium
注:*P<0.05,与CG组相比,**P<0.01,与CG组相比;#P<0.05,与MG组相比;★P<0.05,与HG组相比。*P<0.05,Compared with the CG,**P<0.01,Compared with the CG; #P<0.05,Compared with the MG;★P<0.05,Compared with the HG.
CGL GMGHG钙含量18.06±2.89 25.83±6.01**#★22.50±5.5222.67±4.59*
2.5 股直肌MG29蛋白表达的测定结果
MG29蛋白是维持骨骼肌三联管膜结构的重要蛋白,对胞外的钙流入起着重要的正性调控作用。老龄肌肉的功能衰退可能与MG29蛋白减少有关,适宜负荷的运动能不能刺激该蛋白的表达水平呢?本实验采用Western Blot法测试其表达水平。本实验中,股直肌的MG29蛋白表达水平采用蛋白免疫印迹法(Western Blot)测试,各样本的测试结果如下。
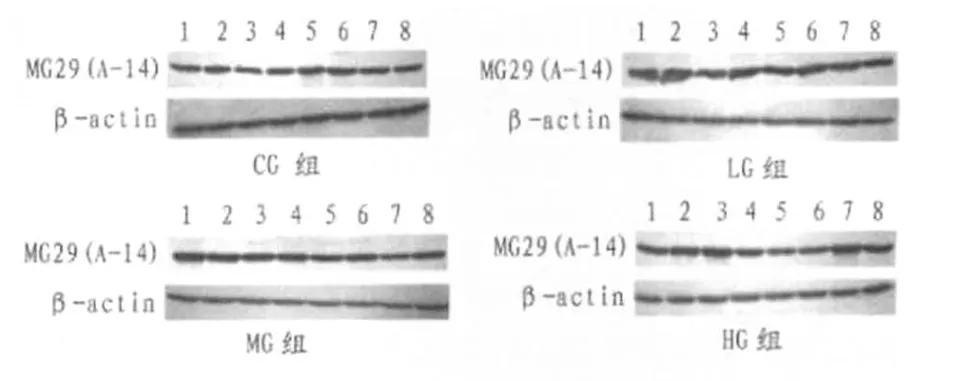
图6 用蛋白免疫印迹法测试MG29蛋白表达水平电泳图Figure 6 Results of Western Blot
使用Image J软件将各样本的上述灰度实验结果数字化,再用靶蛋白的灰度值除以内参蛋白β-actin的灰度值,即可得到各样本MG29蛋白的相对含量。
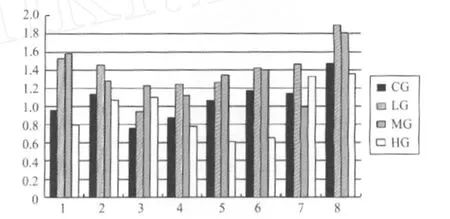
图7 各样本MG29(A-14)/β-actin柱状分析图Figure 7 Histograms of MG29(A-14)/β-actin
用SPSS 17.0经单因素方差分析进行差异检验,结果显示:L G组和MG组相比,其MG29蛋白水平无明显差异;CG和HG组的MG29蛋白水平亦无显著性差异;但LG组和MG组均显著高于CG组和HG组(P<0.01,表6)。
表6 本研究股直肌MG29蛋白的相对含量一览表(±SD)Table 6 Relative Expressions of MG29
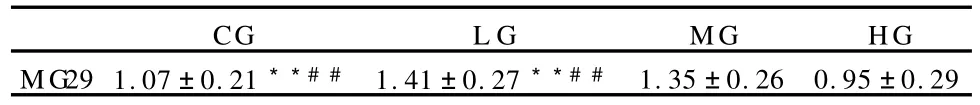
表6 本研究股直肌MG29蛋白的相对含量一览表(±SD)Table 6 Relative Expressions of MG29
注:**与CG组相比P<0.01;##与HG组相比P<0.01。**P<0.01,Compared with the CG,##P<0.01,Compared with the HG.
CGL GMGHG MG29 1.07±0.21**##1.41±0.27**##1.35±0.260.95±0.29
3 小结与讨论
3.1 有关运动负荷的讨论
诸多研究已经证实了间歇运动对心肌的保护作用[7,10],以及对骨骼肌的能量供应的积极作用[12],考虑到老龄鼠心血管系统等的功能衰退,因此,本实验采用了跑2 min,休息2 min的间歇运动的训练方式。此外,跑台速度的设置和以及训练组数、次数的设置均通过预实验,以安全有效为原则。运动组大鼠的运动负荷除负重外均相同,因此,本实验中的30%、50%和60%最大负重的分组,可间接反映负荷强度的大小。
3.2 有关间歇负重跑训练改善老龄大鼠一般状态的讨论
运动组大鼠饮食积极、乐于活动、精神矍铄、毛色较鲜亮且有光泽,L G组大鼠的表现尤为突出。生理性衰老是正常生物体发育成熟后,随着年龄增加而发生的神经肌肉系统、血液循环系统、内分泌系统等各系统的结构、功能发生退行性变化的自然进程,是诸多因素作用的综合结果。本研究中的老龄鼠均出现了毛色枯黄、脱毛、行动迟缓等现象,正是老龄鼠各系统功能退化的所致。与CG组相比,运动组饮食积极、乐于活动、精神矍铄、毛色鲜亮而有光泽,脱毛量较少,这说明间歇负重跑运动干预了自然衰老进程,使神经肌肉等系统的功能趋向于积极化[8]。而L G组大鼠的表现更为积极则暗示着这种负荷对于这些老龄鼠的各器官来说可能是一个比较适宜的运动刺激。
运动组大鼠的体重先降后升,后又下降。自然衰老过程中,机体的体重呈现不同程度的增长,这可能是增龄的脂代谢紊乱,体内脂肪和结缔组织蓄积所致[34],本实验中CG组的体重增长线图证实了此观点。本实验中,8周的不同负荷间歇跑运动干预了上述线图,使之呈现先降低、后升高,而后又下降的曲线。运动训练开始后的1~2周,体重曲线是下降的,分析原因可能是运动鼠对运动训练不适应,其饮食等生活规律受到影响所致,此外,汗液等体内水分的排出也可能是另一因素;在运动后的3~4周,运动组的体重曲线呈现升高趋势,这可能是运动鼠适应了运动训练,饮食、饮水量增加所致;大约在运动4周后,体重曲线又开始下降,这可能是该运动刺激影响了体内的脂类代谢,机体的脂肪和结缔组织减少所致[3]。但体重数据是一个宏观指标,影响因素较多,需要结合其他指标来说明问题。
3.3 间歇负重跑训练与骨骼肌的形态学特征
在正常衰老进程中,机体细胞需要对抗各种各样的外界刺激,如自由基或病原菌入侵、损伤、运动等。细胞膜作为一道坚固的防御屏障,战斗在最前沿,它最先感受到刺激,并做出反应。本研究中发现的大量的圆形肌纤维可能就是细胞膜对刺激做出反应的结果[6],自然衰老的安静组大鼠的肌纤维圆形化程度最为严重,这使相邻肌纤维间间隙增大,光镜下发现的增大细胞间隙中的白色组织可能是老龄骨骼肌增多的脂肪组织或(和)结缔组织在其中填充[22],这大大影响了骨骼肌的正常功能,进一步影响了骨骼肌的内部形态,使本来位于细胞膜下的细胞核向细胞中央移动,类似于未成熟肌细胞的形态。部分小肌群的肌细胞因功能受到严重影响,胞质减少而萎缩,呈角化的肌纤维,甚而整个小肌群萎缩,由脂肪和结缔组织替代[15,18]。
与安静对照组相比,L G和MG组大鼠的肌组织圆形化程度低,肌细胞排列较整齐,较紧密,细胞间隙的脂肪滴、结缔组织大大减少,这可能是30%最大负重和50%最大负重的间歇负重跑这两种运动刺激使大部分肌纤维继续保持运动功能而又不产生过度损伤[17],从而延缓了肌细胞的正常衰老进程,减少了脂滴和结缔组织在肌纤维间的替代和蓄积;而HG组的肌纤维圆形化程度高,脂肪和结缔组织多可能是由于强度过大的运动对细胞产生了损伤。此外,在MG和HG组的切片中还发现了部分比L G组和CG组的直径粗很多的肌纤维,这说明可能该强度运动能够刺激某些肌纤维使其加粗[21]。
3.4 间歇负重跑训练与老龄大鼠的匀浆脂褐质指标
机体组织在自然衰老过程中需要不断对抗各种自由基的攻击,脂褐质就是体内不饱和脂质在对抗自由基的攻击时产生过氧化反应的产物[37],因体内任何细胞、细胞器或其他超微结构都离不开由大量不饱和脂肪酸构成的胞质膜,所以,脂褐质被作为反映组织衰老的重要标志物[37]。在自然衰老过程中,骨骼肌组织不断对抗自由基的攻击,使脂褐质在胞浆内逐渐增多[37],本实验采用荧光比色法在安静大鼠的肌组织中检测出的大量脂褐质证实了这点。
本研究结果显示,L G和MG组的股直肌的平均脂褐质含量远远少于其他2组,这可能是由于和其他2组相比,该强度下的间歇负重跑运动能够更加有效地减少骨骼肌内自由基的生成,或者能够更有效地促进自由基的清除,从而使自由基在肌组织内的蓄积减少,减少了自由基对胞质膜的攻击[20],延缓了骨骼肌的衰老进程。
尽管运动时的氧耗增加,自由基产生的速率也随之升高[20],但由于耐力训练促使骨骼肌线粒体的数目增多且功能增强[35],因而,在适宜强度的耐力训练情况下,相对氧耗是降低的,产生自由基的相对速率是降低的[35]。但是如果运动干预的强度不适宜,就会使体内自由基蓄积显著增加[17],甚至会超过自然衰老状态。在本研究中,HG组的平均脂褐质含量显著高于CG组,这可能是该强度下的运动不能有效地刺激骨骼肌线粒体的数目增多或增多不明显,从而使骨骼肌组织内自由基的生成速率远远大于清除速率,造成自由基在肌组织内大量蓄积,大量胞质膜受到攻击所致,因而,该强度下运动实际上加速了骨骼肌的衰老进程。而50%最大负重运动组的平均脂褐质含量与安静对照组相比无显著差异,这可能是该强度下运动产生的自由基量和清除的自由基量大致相等,从而相互抵消,因而对骨骼肌的自然衰老进程未产生明显影响。
本实验研究结果表明,30%和50%最大负重的间歇负重跑运动可以有效降低肌组织中的脂褐质含量,而60%最大负重的间歇负重跑运动可能是一种超负荷,对自由基的代谢产生了负面影响。
3.5 间歇负重跑训练与老龄大鼠的匀浆钙水平
钙是骨骼肌收缩和舒张的重要耦联因子,肌肉收缩时动员钙的速率直接决定了肌肉的收缩功能[14]。生理情况下,细胞外液的Ca2+浓度约是细胞内的10 000倍[9],因此,微量的胞外钙流入即对骨骼肌纤维产生巨大的影响。老龄鼠因肌肉本身结构的变化造成肌浆网钙库耗空[27],从而更加依赖胞外钙[31],如不能有效地动员外部钙,其肌肉功能会进一步衰退。
本实验采用甲基百里香酚蓝比色法测定的股直肌肌腹匀浆肌组织的钙量,是肌细胞内外钙量的总和,可直接反映老龄大鼠机体对该骨骼肌所分配的钙量,亦可能间接反映调运钙入肌细胞内的程度。4组对比,运动各组的钙含量显著高于CG组,这可能是因运动需要机体为骨骼肌分配了较多的钙量[28],同时,也可能反映了运动组各鼠因运动需要而动员了更多的外部钙[36]。将各运动组进行对比,可发现L G组的钙含量又明显高于其他2组,这可能说明该强度下的负重跑运动是比较适宜的运动刺激,可能能够刺激机体给骨骼肌分配较多的钙量,同时动员更多的外部钙流入肌细胞,使肌肉保持较好的运动功能。MG和HG组的钙含量对比不具有显著性差异,其一,可能是此两种强度下运动调运钙的能力无差异,其二,亦可能存在肌内膜因高强度的运动而产生损伤[17],胞外钙涌入细胞内,虽然钙浓度升高,但收缩功能却受到损伤,具体原因尚须结合其他指标综合分析。
肌肉收缩后,胞浆内的钙还要被快速有效地回收,这样才能保持正常的收缩舒张功能,否则,胞浆长时蓄积高浓度的钙会触发细胞凋亡机制,加速肌细胞萎缩、凋亡[31]。因此,本研究中测试的钙指标还要结合其他指标进行综合分析。
3.6 间歇负重跑训练与老龄大鼠的MG29蛋白表达
MG29蛋白是调控胞外钙流入的重要蛋白,它通过打开骨骼肌横管膜上的SOCE通道,而促进外部钙流入胞浆[24]。此外,MG29蛋白对维持骨骼肌的正常的三联管结构也起着非常重要的作用[19]。本研究采用Western Blot法测试骨骼肌内的MG29蛋白水平,结果显示,L G和MG组的MG29蛋白水平显著高于其他2组,也许是此2种强度的运动刺激是比较适宜的运动刺激,它们直接或间接导致了骨骼肌内MG29蛋白水平升高。然而,本研究也发现, L G组的MG29蛋白表达水平远远低于CG组,笔者推测这可能是该强度下运动负向影响了骨骼肌的收缩机制,直接或间接导致了MG29蛋白减少。
3.7 不同负荷间隙负重跑训练对老龄大鼠骨骼肌MG29蛋白影响的综合思考
综上所述,适宜强度的间歇负重跑训练能够有效提高老龄大鼠骨骼肌细胞内的MG29蛋白水平,有效地改善骨骼肌细胞的形态和功能,从而可能在一定程度上延缓因增龄所致的肌肉萎缩、丢失,延缓Sarcopenia进程。
30%最大负荷的间歇负重跑运动对于老龄骨骼肌来说是比较适宜的运动刺激,它通过力的机械刺激,提高骨骼肌横管膜上的MG29蛋白的表达水平,从而维持骨骼肌正常的三联管膜结构[19],减缓了其因衰老所致的退行性变化,保证了正常的收缩机制;同时,增多的MG29蛋白也能够促进较多的胞外钙流入胞浆[24],改善衰老骨骼肌胞浆内的收缩钙匮乏的现象,此外,该强度下运动还刺激机体为骨骼肌分配较多的钙量,从而可能使骨骼肌的兴奋收缩耦联功能得到保持或增强。这种正常的收缩结构的维持和正常的收缩功能的保持使骨骼肌处于良性循环状态,从而可能减缓正常衰老进程中因肌肉失能导致的肌肉萎缩,肌肉丢失以及结缔组织和脂肪组织的替代,相对降低了体内的自由基水平。因而,30%最大负荷的间歇负重跑运动组的衰老指征不明显,肌细胞形态学上显示,各肌纤维间排列较整齐而紧密,脂褐质的蓄积也远远少于其他组,大鼠精神矍铄,饮食积极,活动积极,毛色有光泽,脱毛也较少。
50%最大负荷负重跑运动也能够有效地改善MG29蛋白的表达水平,维持三联管膜的正常结构,使胞外钙流入增加,同时,该强度的运动刺激亦能使机体为骨骼肌分配较多的钙量,从而保持肌肉正常的收缩功能,因而,该组的钙水平也较高,减缓了正常衰老过程中的肌肉萎缩、丢失及结缔组织和脂肪组织替代。此外,本研究还发现,该强度下运动刺激还可能使部分肌纤维的横径增加。
60%最大负荷间歇负重跑运动对于老龄鼠来说可能不是一个适宜的运动刺激,该强度下运动可能导致自由基水平在骨骼肌内显著升高,因而,脂褐质蓄积显著高于其他3组。这种过大强度的运动刺激虽然也可能使有机体为骨骼肌分配较多的钙量,但同时可能导致了肌细胞膜的破坏,钙从胞外涌入,因而钙水平较高,MG29蛋白水平却较低。在光镜下观察该组的骨骼肌圆形化严重,出现角化肌纤维和过多的脂肪和结缔组织等可能就是部分肌纤维萎缩、丢失的表现。此外,该强度运动也使部分肌纤维横径增加,可能是体内代偿机制发挥作用,也可能有其他因素。总之,本实验中,60%最大负荷的间歇负重跑运动不能有效地提高骨骼肌MG29蛋白水平,其确切机理尚期待后续研究。
4 总结
1.较小或中等强度的间歇负重跑运动对于老龄大鼠来说,可能是比较适宜的运动刺激,它能够有效地提高骨骼肌内的MG29蛋白的表达水平,从而使骨骼肌维持正常的兴奋收缩偶联结构,并促进胞外钙流入,同时,促进有机体为骨骼肌分配较多的钙量,可能有助于保持或增强骨骼肌的正常收缩功能,相对降低细胞内的自由基水平,从而延缓了因衰老所致肌肉萎缩、丢失。
2.较大强度的间歇负重跑运动对于老龄大鼠来说可能是不适宜的运动刺激,因该强度下运动反而使MG29蛋白减少,使骨骼肌的收缩功能减弱,且骨骼肌内自由基水平显著升高,脂褐质大量蓄积,该强度下运动可能加速骨骼肌衰老进程。
[1]陈璐,马恒辉,金邦荃.骨骼肌组织石蜡制片技术的改进[J].临床与实验病理学杂志,2008,24(2):233-234.
[2]冯炜权.运动生物化学原理[M].北京:北京体育大学出版社, 1995:23-25.
[3]何玉秀,张海峰,焦广发.运动减肥机制探析——酰化刺激蛋白的作用及其调节[J].天津体育学院学报,2006,21(4):319-322.
[4]刘丰彬.负重训练和补充大豆多肽干预大鼠骨骼肌衰老效果及机制研究[D].河北师范大学博士学位论文,2009.
[5]李文惠,赵斌,闫万军.骨骼肌衰老与MG29蛋白[J].中国组织工程研究与临床康复,2009,13(50):9950-9953.
[6]里中征哉[日].临床肌肉病理学[M].吴士文,马维娅译.北京:人民军医出版社,2007.
[7]彭峰林,陈建文,任琦.间歇运动训练对心脏缺血再灌注损伤大鼠心肌抗氧化酶的影响[J].中国运动医学杂志,2008,27(1): 97-99.
[8]瞿惠芳,张文忠,闫万军.老年人肌肉功能的重建及其可训练性[J].中国组织工程研究与临床康复,2010,14(2):325-328.
[9]苏静怡.病理生理学[M].北京:北京医科大学、中国协和医科大学联合出版社,2001:36-37.
[10]孙永平,刘伟光.运用高强性间歇训练法对机体各供能系统能源物质代谢的影响[J].哈尔滨体育学院学报,2005,23(6): 118-119.
[11]苏艳红.不同磷脂补充对运动小鼠骨骼肌细胞膜损伤的影响研究[J].中国体育科技,2009,45(2):120-124.
[12]徐玉林.间歇性训练和持续性训练对大鼠腓肠肌ATP酶活性的影响[J].体育与科学.2004,25(1):64-65.
[13]闫万军.负重跑训练改善老龄大鼠肌肉丢失的效果与机理[D].河北师范大学,2008.
[14]AD A G M,BENDERS ARIE OSTERHOFL.Excitation-contraction coup-ling of cultured human skeletal muscle cells and the relation between basal cytosolic Ca2+and excitability[J]. Cell Calcium,1997,21(1):81-91.
[15]ANNA M,KAMINSKA,ANNA FIDZIANSKA,et al.Ultrastructural changes in the skeletal muscle of senile rats with significant age-dependent motor deficits[J].Basic Appl Myol, 1998,8(3):185-190.
[16]FIGUEIREDO P A,MOTA M P,APPELL H J,et al.Ceasing of muscle function with aging:Is it the consequence of intrinsic muscle degeneration or a secondary effect of neuronal impairments[J].Rev Aging Phys Act,2006,3(2):75-83.
[17]JAMIE M HIGHTON,CRAIG TWIST,ROGER G ESTON,et al.The effects of exercise-induced muscle damage on agility and sprint running performance[J].Exe Sci Fit,2009,7(1):24-30.
[18]KOHSHIRO FUJ ISAWA.Some observations on the skeletal musculature of aged rats-histological aspects[J].J Neurologic Sci,1974,22(3):353-366.
[19]KOMAZAKI S,NISHI M,KANGWA K,et al.Immunolocalization of mitsugumin 29 in developing skeletal muscle and effects of the protein expressed in amphibian embryonic cells [J].Dev Dyn,1999,215(2):87-95.
[20]LI LI J I.Modulation of skeletal muscle antioxidant defense by exercise:Role of redox signaling[J].Free Radical Biology Med, 2008,(44):142-152.
[21]MARK D,PETERSON,MATTHEW R,et al.Resistance exercise for muscular strength in older adults:A meta-analysis[J]. Ageing Res Rev,2010,(9):226-237.
[22]MAURO ZAMBONI,GLORIA MAZZALI,FRANCESCO FANTIN,et al.Sar-copenic obesity:A new category of obesity in the elderly[J].Nutrition,Metabolism&Cardiovascular Diseases,2008,(18):388-395.
[23]MELOW S,TARNOPOLSKY M A,BECKMAN K,et al.Resistance exercise reverses aging in human skeletal muscle[J]. PLoS ONE,2007,2(5):465-467.
[24]NAGOMI KUREBAYASHI,HIROSHI TAKESHIMA, MIYUKI NISHI,et al.Changes in Ca2+handling in adult MG29-de?cient skeletal muscle[J].Biochemic Biophysic Res Communicat,2003(310):1266-1272.
[25]NEIL R,BRANDT,ANTHONY H,et al.Localization of mitsugumin 29 to transverse tubules in rabbit skeletal muscle.[J]. Archives Biochemistry Biophysics,1999,371(2):348-350.
[26]NOAH WEISLEDER,HIROSHI TAKESHIMA.Immunoproteomic approach to excitation contraction coupling in skeletal and cardiac muscle:Molecular insights revealed by the mitsugumins[J].Cell Calcium,2008,43(1):1-8.
[27]NOAH WEISLEDER,MARCO BROTTO,SHINJ I KOMAZAKI,et al.Muscle aging is associated with compromised Ca2+spark signaling and segregated intracellular Ca2+release[J].J Cell Biology,2006,174(5):639-645.
[28]NOAH WEISLEDER,JIANJ IE M A.Altered Ca2+sparks in aging skeletal and cardiac muscle[J].Ageing Res Rev,2008, (7):177-188.
[29]PAN Z,D YANG R Y.Dysfunction of store-operated calcium channel in muscle cells lacking mg29[J].Nat Cell Biol,2002,( 4):379-383.
[30]PAYNE A M.Role of Ca2+,membrane excitability,and Ca2+stores in failing muscle[J].Exp Gerontol,2009,44(4):261-273.
[31]PAYNE A M,ZHENG Z.External Ca2+-dependent excitation coupling in a population of ageing mouse skeletal muscle fibres [J].Physiol,2004,560:137-155.
[32]ROSENBERG I H.Sarcopenia:origins and clinical relevance [J].Nutr,1997,127(5):990s-991s.
[33]SALLINEN J,PAKARINEN A,FOGEL HOLM M,et al.Dietary intake,serum hormones,muscle mass and strength during strength training in 49-73 years old men[J].Int J Sports Med, 2007,28(12):1070-1076.
[34]SO-YOUNG PARK,YONG-WOON KIM,J I-EUN KIM,et al. Age-associated changes in fat metabolism in the rat and its relation to sympathetic activity[J].Life Sci,2006(9):2228-2233.
[35]S SERVAIS K,COUTURIER,H KOUBL,et al.Effect of Voluntary Exercise on H2O2release by subsarco,emmal and intermy of iberillar mitochondria[J].Free Radical Biol Med,2003, 35(1):24-32.
[36]THORNTON,ANGELA M.Regulation of store-operated calcium channel by mitsugumin29 in skeletal muscle aging[D]. Rutgers the State University of New Jersey New Brunswick, 2009.
[37]ULF T.BRUNK,ALEXEI TERMAN.Lipofuscin:mechanisms of age-related accumulation and influence on cell function[J]. Free Radical Biol Med,2002,5(33):611-619.
[38]VAN DEN BELD A W,DE JONG F H,GROBBEE D E,et al. Measures of bio-available serum testosterone and estradiol and their relationships with muscle strength,bone density,and body composition in elderly men[J].Clin Endo Metab,2000,(85): 3276-3282.
[39]ZHAO X,WEISLEDER N,THORNTON A,et al.Compromised store-operated Ca2+entry in aged skeletal muscle[J]. Aging Cell,2008,(7):561-568.
Effects of Different Load-bearing Interval Running on Protein MG29 in Aged Skeletal Muscles of Rats
LI Wen-hui,ZHAO Bin,YAN Wan-jun
Objective:To investigate the correlation between different load-bearing interval running and MG29 level in aged body of rats.Methods:32 Wistar rats aged at 17-months were chosen as the subjects of this experiment.They were grouped into 4 randomly.Of the 4 groups,one was control group(CG)and the other 3 were exercise training groups(EG), which were respectively low load group(L G),medium load group(MG)and high load group (HG)and were respectively burdened with 30%、50%and 60%the weights of their maximum loads.For the exercise training groups they were exerted interval run training on treadmill with the above burdens separately for 8 weeks.One set of training consisted of running 2 minutes and resting 2 minutes and 6 sets of this continuous training were exerted,one time for every day and 6 times for every week with Sunday resting.All the rats were weighed one time a week,their hair color and mental status were observed every day.At the end of the eighth training week and after the last training,the left mid-rectus femoris muscles of the subjects were cut up.Routine frozen sections were made with HE staining and afterwards an optical microscope was used to watch the histologic morphology determinations.After homogenation,in muscles the content of lipofuscin was assayed by fluorimetry colorimetry,the concentration of calcium was assayed by methylthymol blue colorimetry and MG29 level was assessed by western blot analysis.Conclusions:1)Low and medium intensity of interval load-bearing running may be a proper motor stimulation for delaying the aging process of skeletal muscles in rats.It can elevate the MG29 level in skeletal muscles effectively,consequently keep the normal structures of excitation contraction coupling,thus promote extracellular calcium entry,and hold even boost up the functions of skeletal muscles.As a result,the free radicals in fibers reduce relatively,muscular atrophy and lost decreases,and it happens that the process of sarcopenia delays.2)Maybe high intensity of interval load-bearing running is not a proper motor stimulation for aging skeletal muscle in rats,under this motor stimulation,the MG29 level falls significantly,thus the functions of skeletal muscles shrink greatly,and the free radical level rise apparently,the cumulation of lipofusion grows largely.
aging;Sarcopenia;calcium homeostasis;MG29;load-bearing running;rat
G804.7 文献标识码:A
1000-677X(2010)09-0073-09
2010-07-23;
2010-08-25
河北省自然科学基金资助项目(C2008000177)。
李文惠(1973-),女,河北南宫人,在读硕士研究生,主要研究方向为运动保健、运动延缓骨骼肌衰老、运动伤病防治理论与实践,E-mail:liwenhui3061563@163.com;赵斌(1956-),男,河北张家口人,教授,博士研究生导师,主要研究方向为运动保健学、运动伤病防治的理论与实践、运动延缓骨骼肌衰老;闫万军(1965-),男,山西祁县人,研究员,博士,硕士研究生导师,主要研究方向为运动促进健康的理论与应用。
河北师范大学体育学院,河北石家庄050016 Hebei Normal University,Shijiazhuang 050016,China.

