单核巨噬细胞铁代谢相关蛋白的表达调控
孔卫娜,张彩云,段相林,常彦忠
1.河北师范大学铁代谢分子生物学研究室,石家庄050016;
2.河北化工医药职业技术学院,石家庄050026
单核巨噬细胞铁代谢相关蛋白的表达调控
孔卫娜1,2,张彩云1,段相林1,常彦忠1
1.河北师范大学铁代谢分子生物学研究室,石家庄050016;
2.河北化工医药职业技术学院,石家庄050026
人类机体的铁代谢表现为受限制的对外界铁的吸收和有效的机体内的铁的再循环利用,单核巨噬细胞系统通过吞噬衰老的红细胞,储存和释放铁,在机体铁的循环再利用方面起到了重要的作用。因此,单核巨噬细胞系统对整个机体铁稳态的维持非常重要。近年来,随着转铁蛋白受体1(transferrin receptor 1,TfR1)、铁蛋白(ferritin,Fn)、二价金属离子转运蛋白1(divalent metal transporter 1, DMT1)、 膜铁转运蛋白 1(ferroportin1, FPN1), 以及铁调素(hepcidin)等在单核巨噬细胞系统中功能和调控机制研究的不断深入,日益加深了人们对单核巨噬细胞系统的铁代谢过程和调控机制的了解。该文综述了铁水平、NO以及炎症等因素对单核巨噬细胞系统TfR1、Fn、DMT1、FPN1、hepcidin等蛋白表达的调控及其机制研究的最新进展。
单核巨噬细胞系统;铁调素;血红素加氧酶;铁蛋白;膜铁转运蛋白1
0 引 言
单核巨噬细胞系统 (mononuclear phagocyte system,MPS)是由单核细胞、巨噬细胞及其前体细胞构成。单核巨噬细胞可以通过吞噬衰老的红细胞,并在血红素加氧酶 (heme oxygenase,HO)的作用下降解血红素而获得铁,还可以通过转铁蛋白受体1(transferrin receptor 1,TfR1)介导的途径来获取转铁蛋白 (transferrin,Tf)结合的铁[1]。二价金属离子转运蛋白1(divalent metal transporter 1,DMT1)[2],又称作天然抵抗力相关巨噬细胞蛋白2(natural resistance-associated macrophage protein 2,Nramp2),可将内吞小体或溶酶体中已解离的铁转入胞质中,在巨噬细胞铁摄取方面也可能起着重要的作用。单核巨噬细胞中的大部分铁会以铁蛋白 (ferritin,Fn)的形式储存起来,一部分会在膜铁转运蛋白1(ferroportin1,FPN1)[3]的作用下被转运出细胞。被转运出的Fe3+会与Tf相结合,经血液运输到机体各组织器官。在单核巨噬细胞系统中,铁的摄取、储存和释放都会受到各种因素的调节,而这些调节过程基本上都是通过调节这些铁代谢相关蛋白[4]的表达来实现的。我们将与单核巨噬细胞铁代谢相关的分子及其可能的调控分子列于表1中,在后面将对具体的代谢机制和过程进行总结。
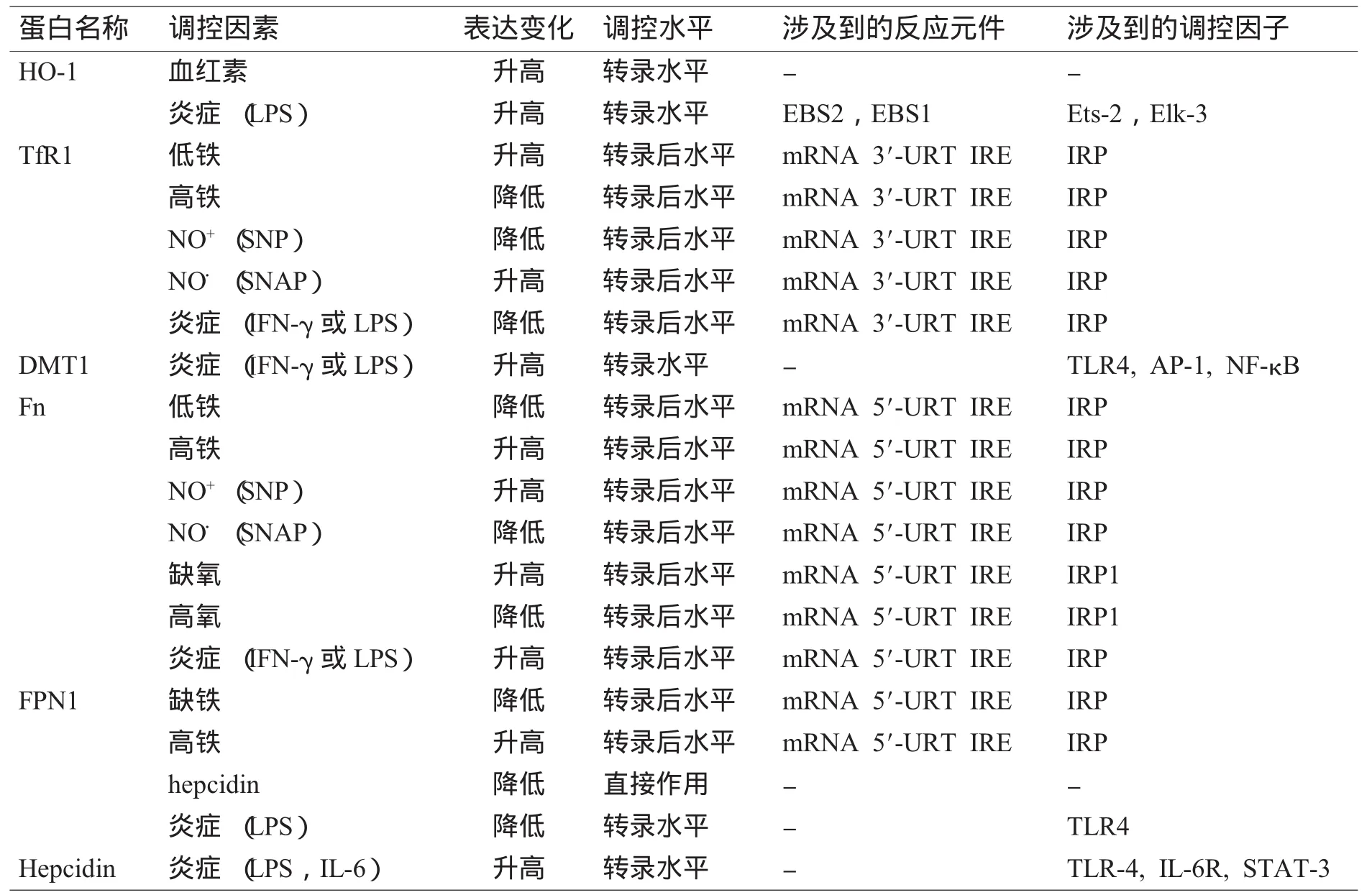
表1 单核巨噬细胞铁代谢相关蛋白的表达与调控Table 1 The regulation of iron-related proteins in the mononuclear phagocyte system
1 单核巨噬细胞铁吸收相关蛋白的表达调控
1.1 单核巨噬细胞HO-1的表达调控
哺乳动物中存在三种形式的HO,虽然HO-1的本底表达水平较低,但是在巨噬细胞吞噬红细胞的诱导下,HO-1的表达量会显著地增加,进而降解血红素生成胆绿素、CO和铁。研究表明,血红素诱导HO-1基因的表达可能主要发生在转录水平。在HO-1 5′末端非翻译区(untranslated region,UTR),即基因启动子区,包含一些增强子和调节片段,其中就包括血红素反应片段。
HO-1对血红素的降解不仅可以促进铁的回收利用,HO-1还是一种保护蛋白,可以预防在各种应激状况下,过多的血红素或铁对巨噬细胞产生毒害作用。例如,在炎症情况下,HO-1的表达也会上调,加速血红素的降解,降低血红素的毒性反应,代谢产生的胆绿素进一步经胆绿素还原酶作用生成胆红素,胆红素作为一种强效的抗氧化剂,能清除体内过量的自由基,保护细胞对抗氧化应激的损伤作用。HO-1降解血红素生成的CO也可以通过cGMP/P38MAPK/NF-κB途径来抑制细胞凋亡和炎症反应的发生。此外,HO-1降解血红素形成的铁离子还能诱导Fn的合成,Fn作为铁的生理性螯合剂,封闭隔离游离铁与活性氧分子的反应,从而起到了抗氧化损伤和细胞保护的功能[5~7]。
体外细胞研究揭示了炎症诱导HO-1表达的机制。用致炎因子细菌脂多糖(lipopolysaccharide,LPS)处理巨噬细胞,可增强HO-1的表达。LPS诱导巨噬细胞HO-1的表达通过两条途径:第一条途径是LPS诱导巨噬细胞转录因子Ets-2的表达,Ets-2与HO-1基因启动子区相结合后可诱导HO-1的转录[8];第二条途径是,在正常情况下,转录因子Elk-3与HO-1基因启动子区相结合,从而抑制巨噬细胞HO-1的转录,而LPS可以抑制Elk-3的表达并降低其DNA结合活性,进而提高HO-1的转录效率。研究进一步发现,在小鼠HO-1基因启动区的下游区域有两个可能的Ets绑定位点(EBS1和EBS2),Ets-2和EBS2的亲和力高,而Elk-3和EBS1有着更高的亲和力[9]。综上所述,在正常情况下,Elk-3和EBS1位点相结合,抑制HO-1的转录,使HO-1的表达维持在一个相对较低的水平;而当细胞受到炎症刺激时,Elk-3的表达降低且EBS1的亲和力也降低,导致Elk-3对HO-1基因转录的抑制作用消弱,与此同时,Ets-2的表达增加,Ets-2和EBS2结合,激活HO-1的转录,最终导致HO-1表达的增加。
1.2 单核巨噬细胞TfR1的表达调控
1.2.1 铁水平对单核巨噬细胞TfR1表达的调控及其机制
在单核巨噬细胞中,细胞内铁水平的改变可以调控TfR1的表达。例如,用铁的螯合剂(desferrioxamine,DFO)处理巨噬细胞,导致TfR1的表达增加;相反,铁剂(ferric ammonium citrate,FAC)导致TfR1的表达降低[10,11]。同样,分别用高铁或低铁处理单核细胞也出现了上述的变化[12]。
研究表明,细胞内铁水平调控TfR1的表达主要是通过铁反应元件(iron-responsive element,IRE)和铁调节蛋白(iron-regulatory protein,IRP)介导的转录后水平的调控来调节的。IRP能够感受细胞内游离铁水平的变化,通过与IRE的结合或解离来调节具有IRE结构的铁代谢相关蛋白mRNA的稳定性,进而调节蛋白的表达量。TfR1 mRNA 3′-UTR含有5个IREs,当细胞内铁缺乏时,IRP与TfR1 mRNA 3′-URT的IRE结合,减少了TfR mRNA的降解,TfR表达量增加。反之,当细胞内铁水平增加时,则出现相反的结果[13]。
1.2.2 NO对单核巨噬细胞TfR1表达的调控及其机制
在巨噬细胞中,NO也可以通过影响IRE/IRP的亲和力进而调控TfR1的表达。但是,NO的供体不同,产生的结果也不同。SNP(sodium nitroprusside)作为一种NO供体,可以产生亚硝翁离子(NO+)。NO+促使IRP的半胱胺酸生成二硫键,从而抑制IRP与IRE的结合。因此,用SNP孵育巨噬细胞,降低了TfR1的表达[14]。NO的另一种供体SNAP(S-nitroso-N-acetylpenicillamine)可以产生NO·。NO·可以增强IRP与IRE的结合活性,增强巨噬细胞TfR1蛋白的表达[15]。
此外,IRP根据其结构的不同又分为两种:IRP1和IRP2。IRP1与线粒体中的顺乌头酸酶有30%的同源性,当铁缺乏时,细胞质中的IRP1缺乏铁硫簇(4Fe-4S)及顺乌头酸酶活性,对IRE有高亲和力;在铁充足时,IRP1可与一个铁硫簇结合,并具有顺乌头酸酶活性,反而对IRE的亲和力降低。IRP2的氨基酸序列与IRP1有62%的同源性。IRP2对IREs同样具有高亲和力,不同的是IRP2不含铁硫簇也没有顺乌头酸酶活性。但是,IRP2的N末端有一段富含半胱氨酸的序列,这段序列是IRP1所没有的,这段序列在高铁介导的蛋白酶体对IRP2的水解过程中起着重要作用。因此,IRP2是一种不稳定的蛋白,随着细胞内铁水平的升高,IRP2的降解增加,IRP2的水平减少[13,16]。研究发现,SNP处理巨噬细胞降低TfR1表达的过程中[14],IRP2对TfR1的表达起到了更为重要的调控作用。NO+会首先和IRP2发生作用,导致IRP2与IRE的亲和力降低并伴随有IRP2的降解,而在此现象出现数小时后,NO+才影响到IRP1与IRE的结合活性。
1.2.3 炎症因子对单核巨噬细胞TfR1表达的调控及其机制
炎症因子也可以影响IRP和IRE的结合活性,进而在转录后水平调控TfR1的表达。研究显示,单核巨噬细胞在γ干扰素(interferon gamma,IFN-γ)和LPS的作用下,IRP1的mRNA及蛋白水平均显著降低,IRP2与IRE的结合活性降低,蛋白降解加剧,导致TfR1表达降低。研究进一步发现,IFN-γ和LPS是通过诱导NO的分泌、进而影响IRP/IRE的亲和力来调控TfR1的表达。IFN-γ和LPS可使巨噬细胞NO合酶(nitric oxide synthase,NOs)的生成增加,NO的分泌增多;相反,用NOs抑制剂可阻碍IFN-γ和LPS对IRP/IRE结合活性的抑制作用[15,17~19]。
1.3 单核巨噬细胞DMT1的表达调控
1.3.1 铁水平对单核巨噬细胞DMT1表达的调控及其机制
铁摄取蛋白DMT1的mRNA存在2种形式:“+IRE”和“-IRE”型。“+IRE”型的3′-UTR含有1个IRE结构,“-IRE”型不含有此元件[20]。与TfR1不同,在单核巨噬细胞系统,DMT1(+IRE)的表达不受IRE/IRP系统的调控。研究显示,在巨噬细胞系RAW264.7细胞中,铁鏊合剂DFO对DMT1 mRNA的水平没有影响;铁剂FAC甚至造成DMT1 mRNA水平的显著升高[10]。我们的研究结果也显示,注射rHuEPO造成巨噬细胞铁水平下降,DMT1的表达却也呈现降低趋势[21]。这其中的具体机制还不是十分清楚,但需要指出的是,铁水平对DMT1的表达调控具有组织细胞特异性,例如,低铁可以使肠道细胞DMT1的表达升高,高铁可以使肠道细胞DMT1的表达下降[22,23]。
1.3.2 炎症对单核巨噬细胞DMT1表达的调控及其机制
细菌感染[24]或用致炎因子[10,25,26]IFN-γ和LPS处理巨噬细胞,均使DMT1的表达升高,并伴随有铁摄取量的增加。用LPS和IFN-γ处理单核细胞,同样能够增强DMT1的表达,促进铁摄取;同时,降低TfR1的表达及59Fe-Tf的摄取[18]。综合上面的结果,虽然在DMT1和TfR1 mRNA的3′-UTR均含有IRE序列,炎症抑制TfR1的表达,却使DMT1的表达增加。因此,在单核巨噬细胞中,不管是铁水平的改变还是炎症对DMT1的表达调控,都是不依赖于IRP/IRE系统的。
那么,致炎因子究竟通过什么机制来调控DMT1的表达呢?LPS与LPS结合蛋白(LBP)、LPS受体CD14形成复合物,再与单核巨噬细胞表面LPS的受体Toll-like receptor 4(TLR4)结合,进而触发胞内多种级联信号传导反应,诱导特定基因的转录[27]。LPS诱导的转录因子中就包括NF-κB和AP-1[28]。而在人的DMT1 5′端调控区域就存在AP-1和NF-κB的结合位点[20]。研究还发现,在这段调控区域内还存在IFN-γ的结合位点[20],因此,IFN-γ就有可能进入细胞直接对DMT1的表达进行调控。综上所述,在单核巨噬细胞中,致炎因子可能在转录水平直接对DMT1的表达进行调控。但是,我们还不确信在其他物种中DMT1的启动子区是否也存在类似的调控区域,IFN-γ或LPS对DMT1的具体的调节通路还需进一步的研究。
2 单核巨噬细胞Fn的表达调控
2.1 铁水平对单核巨噬细胞Fn表达的调控及其机制
Fn mRNA也含有IRE结构,因此细胞内铁水平也可以通过IRE/IRP系统来调节Fn的表达。但与TfR1不同,Fn仅含有一个IRE,且其在Fn mRNA的5′-URT。当细胞内铁缺乏时,IRP与Fn mRNA 5′-URT的IRE结合,抑制了Fn mRNA的翻译,细胞内的Fn水平减少。反之,当细胞内铁水平增加时,IRP与IRE亲和力降低,Fn的表达水平升高[13]。研究结果也证实了上述推论,例如,用DFO处理单核巨噬细胞,细胞内铁水平降低,Fn的表达降低;相反,用铁剂FAC处理单核巨噬细胞造成细胞内铁水平增加,Fn的表达增加[10~12]。
2.2 NO对单核巨噬细胞Fn表达的调控及其机制
在单核巨噬细胞中,NO也可以通过IRE/IRP系统调控Fn的表达。例如,用SNP孵育巨噬细胞系RAW 264.7细胞,SNP产生的NO+使IRP/IRE的亲和力降低,促使Fn的表达升高[14]。在SNP处理巨噬细胞的同时用MG132抑制IRP2的降解,SNP处理造成的Fn升高受到抑制,因此,IRP2在SNP增强Fn表达的过程中起到了重要的作用。相反,用SNAP处理RAW 264.7细胞,SNAP生成的NO·增强IRP与IRE的结合活性,促使Fn蛋白的表达降低[29]。
2.3 氧气含量对单核巨噬细胞Fn表达的调控及其机制
在巨噬细胞中,缺氧可以造成IRP1与IRE的亲和力减弱,Fn合成升高;相反,在氧气含量升高的情况下,IRP1的活性增加,Fn的合成受到抑制[30]。因此,在巨噬细胞中,细胞内铁水平和细胞内氧含量对IRP1活性的调节正好是相反的。因此,增加氧气含量可以削弱高铁对IRP1亲和活性的抑制;相反,即使是在低铁状态下,缺氧也可以抑制IRP1/IRE的亲和活性[30]。通过对人的胚胎肾细胞HEK293细胞的研究结果显示,氧气含量对IRP1和IRP2活性的调控是相反的:缺氧造成IRP2与IRE结合活性增加,高氧环境造成IRP2与IRE结合活性的降低[31]。这其中的机制还不是十分清楚。氧气含量对巨噬细胞IRP2亲和活性的调控是否与HEK293细胞相同,这也有待于进一步研究。
2.4 炎症对单核巨噬细胞Fn表达的调控及其机制
炎症因子也是通过调节IRP和IRE的亲和力来调控Fn的表达。例如,用IFN-γ和LPS处理RAW 264.7细胞,导致IRP2的降解加剧,Fn的合成增加。研究还发现,与TfR1相同,IFN-γ和LPS也是通过影响NO的分泌,进而影响IRP/IRE的结合力来调控Fn的表达。在IFN-γ和LPS处理RAW 264.7细胞的同时,用NOs抑制剂抑制NO的分泌,IRP2的降解减少,IFN-γ和LPS诱导的Fn的合成受到抑制[29]。
3 单核巨噬细胞FPN1的表达调控
3.1 铁水平对单核巨噬细胞FPN1表达的调控及其机制
FPN1[32]作为巨噬细胞的铁输出蛋白,其mRNA的5′-URT也含有IRE序列。那么,根据IRP/IRE介导的转录后调控理论,缺铁应该使FPN1的水平下降,铁释放降低;高铁应该使巨噬细胞FPN1的水平升高,铁释放增加。Knutson MD等的实验正好证实了上述推论,用铁的螯合剂(DFO及SIH)处理小鼠巨噬细胞系J774细胞20 h后,FPN1 mRNA的水平显著降低;相反,用铁剂Fe-NTA处理J774细胞20 h后,FPN1 mRNA的水平则显著升高[33]。但是,FPN1受IRP/IRE系统的调控同样具有组织细胞特异性。例如,在结肠癌细胞系Caco-2细胞中,高铁促使FPN1 mRNA的水平降低[22]。
3.2 炎症对单核巨噬细胞FPN1表达的调控及其机制
炎症可以显著降低单核巨噬细胞铁输出蛋白FPN1的表达。例如,用LPS处理小鼠,造成小鼠急性炎症模型,可以检测到脾脏、肝脏及骨髓等部位巨噬细胞FPN1表达量的降低。经Leishmania donovani感染造成慢性炎症模型,在巨噬细胞中也检测到了FPN1的减少[34,35]。
在体情况下,炎症造成FPN1降低的原因是多方面的。一方面,炎症可以诱导肝脏hepcidin的大量分泌,hepcidin经血液循环,和单核巨噬细胞的FPN1发生直接的相互作用,引发FPN1的内化降解,造成FPN1表达的显著降低,进而导致细胞内铁输出的减少[36~38]。另一方面,炎症因子还可以独立于hepcidin直接调控单核巨噬细胞FPN1的表达。例如,用LPS直接处理巨噬细胞,同样可以降低FPN1的表达[18,26,34]。并且LPS对巨噬细胞FPN1的下调并不是LPS诱导产生的细胞因子作用的结果,因为用LPS处理interleukin 1(IL-1)、IL-6或tumor necrosis factor-alpha(TNF-α)等细胞因子基因缺失的小鼠时,FPN1的表达仍然能够降低[35]。但若LPS的受体TLR4发生缺失(称为C3H/HeJ小鼠),LPS便不能对FPN1的表达产生影响[34]。因此,LPS是通过TLR4途径,直接调控单核巨噬细胞FPN1的表达。除LPS外,其他致炎因子也可以调控FPN1的表达,如用松节油(turpentine)或IFN-γ处理单核巨噬细胞,均可造成FPN1表达的降低[18,34]。炎症因子可以调控FPN1的表达,但其具体通路还不是十分清楚,有待于进一步的研究。
4 单核巨噬细胞hepcidin的表达调控
Hepcidin作为一种极为重要的铁调节激素,精确地调控着机体的铁吸收、铁储存和铁释放过程,保证机体铁代谢维持在一个相对稳态的水平[39~41]。肝脏是合成hepcidin的主要部位,与肝细胞相比,单核巨噬细胞也可以表达低水平的hepcidin[42]。那么,单核巨噬细胞自身表达的hepcidin是否和肝细胞合成的hepcidin具有同样的生物学作用呢?研究显示,将FPN1/EmGFP融合蛋白基因,转染THP-1单核细胞并诱导其表达,再用LPS处理THP-1细胞诱导hepcidin的表达,显微镜观察检测到FPN1发生内化并降解;相反,用siRNA抑制单核细胞hepcidin的表达,可以逆转这一作用[43]。因此,炎症诱导单核细胞自身分泌的hepcidin也可以和细胞膜表面的FPN1发生直接的相互作用,促进其内化降解,使单核巨噬细胞的铁释放受阻。
炎症能够诱导肝脏迅速产生大量的hepcidin释放入血液,参与炎症反应并调控机体的铁代谢。与肝细胞相比,尽管单核巨噬细胞表达的hepcidin量很少,但是在细菌、LPS或IFN-γ等炎症刺激下,其hepcidin的表达量可以被诱导升高20~80倍[26,35,43,44]。这对于某些血液循环不畅、肝脏分泌的hepcidin不能及时运输到炎症部位的铁代谢的调控起到了重要的辅助作用。
虽然,炎症可使巨噬细胞、单核细胞、肝细胞hepcidin的分泌增加,并且它们分泌的hepcidin也具有同样的生物学作用,但其在具体的表达调控上还存在一些差异。LPS对肝细胞、单核细胞以及巨噬细胞的hepcidin表达均有诱导作用[26,43,45],但细胞因子IL-6只可以上调肝细胞[45]和单核细胞[43]hepcidin的表达,对巨噬细胞hepcidin的表达没有影响[26]。这可能是由于单核细胞和巨噬细胞在分化过程中产生了不同的免疫反应或代谢机制而造成的。此外,LPS和IL-6也是通过不同的通路调控hepcidin的表达:LPS诱导巨噬细胞hepcidin的表达是通过TLR-4受体依赖的途径[35,44];而IL-6和IL-6受体(IL-6R)结合后,与二个gp130分子结合,使之发生同二聚体化,导致细胞浆内Jak激酶的活化,进而诱导STAT-3的磷酸化,磷酸化的STAT-3进入到细胞核内与hepcidin基因启动子区的STAT-3结合位点相结合,启动hepcidin基因的表达[46~48]。
5 单核巨噬细胞系统铁代谢调控失衡与相关疾病
5.1 遗传性血色素沉着症
遗传性血色素沉着症(hereditary hemochromatosis,HH),又称原发性(或特发性)血色素沉着症,该病主要由于胃肠道铁吸收增加,造成体内铁沉积,从而导致皮肤黑色素沉积、肝硬化、糖尿病、关节炎等严重并发症。研究发现HFE、HJV、TfR2、FPN1、Fn、hepcidin等基因突变均可引发HH,并具有不同的临床症状。
其中,FPN1基因突变可引发Ⅳ型HH。FPN1基因突变主要是使肝脏、脾和骨髓的巨噬细胞铁释放减少,储铁增加。因此,虽然病人在早期肝脏出现铁超载现象,但血清转铁蛋白饱和度却处于正常水平,但随着肝脏铁积累的继续增加,血清转铁蛋白饱和度水平也随着增长。临床症状主要为关节痛和早期的关节病症状。放血治疗的作用并不显著[49]。
Hepcidin基因突变引发的HH主要发生在20~30岁的青少年,因此又称为青少年血色素沉着病(juvenile hemochromatosis,JHH)。Hepcidin的作用主要是抑制肠道铁吸收和抑制单核巨噬细胞系统铁释放,因此,hepcidin基因发生突变,肠道铁吸收和单核巨噬细胞系统铁释放异常性的升高,导致了机体的铁沉积。患者转铁蛋白饱和度和血清铁蛋白的浓度均升高,临床症状表现为严重的铁沉积、肝脏纤维化或硬化、性腺机能减退和原发性心肌症,放血治疗能够使病人的临床症状得到改善[49]。
5.2 慢性炎症性贫血(ACD)
慢性炎症性贫血(anemia of chronic disease,ACD)的特征为红细胞寿命缩短,骨髓铁水平降低,但单核巨噬细胞系统的铁积累却异常增高,进而影响机体对铁的利用,造成贫血。
那么,在ACD中,巨噬细胞铁超载的原因又是什么呢?通过上述炎症对巨噬细胞铁代谢相关蛋白的表达调控,我们可以看出,在炎症情况下,肝脏迅速合成了大量的hepcidin并释放入血液循环,进而降低单核巨噬细胞系统FPN1的表达;此外,炎症因子本身又可以在转录水平直接下调FPN1的表达,同时上调DMT1的表达。因此,炎症造成单核巨噬细胞系统铁摄取增加,铁释放减少,细胞铁储存增加,进入循环系统的铁量减少,进而减少对入侵的病源微生物的铁供应,抑制其生长。但与此同时,循环铁量的减少也造成了铁利用部位——骨髓的铁缺乏,红细胞的正常生成受到抑制,从而诱发了ACD。
6 总结及展望
单核巨噬细胞不仅可以通过吞噬衰老的红细胞或受体介导的途径回收利用铁,还可以作为过量铁的贮存库,在机体需铁时将其释放到血液中,对维持机体铁稳态起到了十分重要的作用。随着单核巨噬细胞铁代谢相关蛋白HO-1、TfR1、Fn、DMT1、FPN1、hepcidin等的结构、功能及调节等方面的研究不断取得突破,人们对其生物学功能的认识也日益加深。铁水平、NO以及炎症刺激等因素可以直接在转录水平或通过IRP/IRE系统调控铁代谢相关蛋白的表达,进而调节单核巨噬细胞的铁摄取、铁贮存、铁释放,以达到对外界刺激的适应。当然,单核巨噬细胞铁代谢的影响因素还有很多,例如,我们以往的研究发现,注射rHuEPO造成大鼠红细胞的生成显著增加,机体铁水平显著降低,肝脏hepcidin表达下降,巨噬细胞DMT1的表达降低,铁摄取减少,FPN1表达升高,铁释放增加,巨噬细胞铁储存降低,从而使更多的铁被用来生成红细胞[21]。另外,某些基因表达异常引起的铁代谢改变,也会影响hepcidin的表达,进而对巨噬细胞的铁代谢产生影响,改变铁在体内各器官间的分布[50]。总之,巨噬细胞会对各种外界或内在的刺激做出反应,使机体的铁代谢维持在一个平衡状态,当这种平衡被打破时,便诱发了各种铁代谢相关疾病。因此,对单核巨噬细胞系统铁代谢及其调控机制的深入研究,将为人和动物铁代谢紊乱疾病的治疗带来新的思路。但机体任何一个代谢过程都非常复杂,受到诸多因素的影响,单核巨噬细胞的铁代谢也是如此,其中许多作用机制尚不太清楚,需进一步加以研究和揭示。尽管如此,相信在不久的将来,随着研究技术的不断发展,单核巨噬细胞铁代谢的研究也将会取得更多的突破和进展。
1. 常彦忠,袁其朋,钱忠明.转铁蛋白-转铁蛋白受体系统在药物运输和定向给药中的应用.科学通报,2003,48(3):213~218 Chang YZ,Yuan QP,Qian ZM.Effects of transferrin and transferrin receptor system on targeted drug delivery.Chinese Science Bulletin,2003,48(3):213~218
2.于 鹏,钱忠明,段相林,常彦忠.DMT1的结构及其基因表达调控.神经解剖学杂志,2004,20(2):205~209 Yu P,Qian ZM,Duan XL,Chang YZ.Thestructure,expression and regulation of divalent metal transporter 1.Chinese Journal of Neuroanatomy,2004,20(2):205~209
3.李 静,钱忠明,常彦忠,段相林.膜铁转运蛋白Ferroportin 1的研究进展.生理科学进展,2004,35(4):349~351 Li J,Qian ZM,Chang YZ,Duan XL.Progress of the study of ferroportin 1.Progress in Physiological Sciences,2004,35(4):349~351
4.Kong WN,Duan XL,Shi ZH,Chang YZ.Iron metabolism in the mononuclear phagocyte system.Prog Nat Sci,2008,18(10):1197~1202
5. Otterbein LE,Soares MP,Yamashita K,Bach FH.Heme oxygenase-1:unleashing the protective properties of heme.Trends Immunol,2003,24(8):449~455
6. Pae HO,Kim EC,Chung HT.Integrative survival response evoked by hemeoxygenase-1 and hememetabolites.J Clin Biochem Nutr,2008,42(3):197~203
7. Chung HT,Choi BM,Kwon YG,Kim YM.Interactive relations between nitric oxide(NO)and carbon monoxide(CO):heme oxygenase-1/CO pathway is a key modulator in NO-mediated antiapoptosis and anti-inflammation.Methods Enzymol,2008,441:329~338
8. Chung SW,Chen YH,Perrella MA.Role of Ets-2 in theregulation ofheme oxygenase-1 by endotoxin. J Biol Chem,2005,280(6):4578~4584
9. Chung SW,Chen YH,Yet SF,Layne MD,Perrella MA.Endotoxin-induced down-regulation of Elk-3 facilitates heme oxygenase-1 induction in macrophages.J Immunol,2006,176(4):2414~2420
10. Wardrop SL,Richardson DR. Interferon-gamma and lipopolysaccharide regulate the expression of Nramp2 and increase the uptake of iron from low relative molecular mass complexes by macrophages.Eur J Biochem,2000,267(22):6586~6593
11.Piñero DJ,Li N,Hu J,Beard JL,Connor JR.The intracellular location of iron regulatory proteins is altered as a function of iron status in cell cultures and rat brain.J Nutr,2001,131(11):2831~2836
12.Cairo G,Recalcati S,Montosi G,Castrusini E,Conte D,Pietrangelo A.Inappropriately high iron regulatory protein activity in monocytes of patients with genetic hemochromatosis.Blood,1997,89(7):2546~2553
13. RouaultTA. The role ofiron regulatory proteins in mammalian iron homeostasis and disease.Nat Chem Biol,2006,2(8):406~414
14.Kim S,Ponka P.Control of transferrin receptor expression via nitric oxide-mediated modulation of iron-regulatory protein 2.J Biol Chem,1999,274(46):33035~33042
15.Kim S,Ponka P. Effects of interferon-gamma and lipopolysaccharide on macrophage iron metabolism are mediated by nitric oxide-induced degradation of iron regulatory protein 2.J Biol Chem,2000,275(9):6220~6226
16.Volz K.The functional duality of iron regulatory protein 1.Curr Opin Struct Biol,2008,18(1):106~111
17.Recalcati S,Taramelli D,Conte D,Cairo G.Nitric oxidemediated induction of ferritin synthesis in J774 macrophages by inflammatory cytokines:role of selective iron regulatory protein-2 downregulation.Blood,1998,91(3):1059~1066
18.Ludwiczek S,Aigner E,Theurl I,WeissG.Cytokinemediated regulation of iron transport in human monocytic cells.Blood,2003,101(10):4148~4154
19.Oliveira L,Drapier JC.Down-regulation of iron regulatory protein 1 gene expression by nitric oxide.Proc Natl Acad Sci USA,2000,97(12):6550~6555
20.Lee PL,Gelbart T,West C,Halloran C,Beutler E.The human Nramp2 gene: characterization of the gene structure,alternative splicing,promoter region and polymorphisms.Blood Cells Mol Dis,1998,24(2):199~215
21.孔卫娜,段相林,常彦忠.促红细胞生成素对大鼠机体铁状态及腹腔巨噬细胞铁代谢的影响.自然科学进展,2007,17(5):595~602 Kong WN,Duan XL,Chang YZ.Effects of erythropoietin on iron statusand iron metabolism in macrophagesof rats.Progress in Natural Science,2007,17(5):595~602
22.Martini LA,Tchack L,Wood RJ.Iron treatment downregulates DMT1 and IREG1 mRNA expression in Caco-2 cells.J Nutr,2002,132(4):693~696
23.Zoller H,Koch RO,Theurl I,Obrist P,Pietrangelo A,Montosi G,Haile DJ,Vogel W,Weiss G.Expression of the duodenal iron transporters divalent-metal transporter 1 and ferroportin 1 in iron deficiency and iron overload.Gastroenterology,2001,120(6):1412~1419
24.Zhong W,Lafuse WP,Zwilling BS.Infection with Mycobacterium avium differentially regulates the expression of iron transport protein mRNA in murine peritoneal macrophages.Infect Immun,2001,69(11):6618~6624
25.Wardrop SL,Wells C,Ravasi T,Hume DA,Richardson DR.Induction of Nramp2 in activated mouse macrophages is dissociated from regulation of the Nramp1,classical inflammatory genes,and genes involved in iron metabolism.J Leukoc Biol,2002,71(1):99~106
26.Nguyen NB,Callaghan KD,Ghio AJ,Haile DJ,Yang F.Hepcidin expression and iron transport in alveolar macrophages.Am J Physiol Lung Cell Mol Physiol,2006,291(3):L417~425
27.Guha M,Mackman N.LPS induction of gene expression in human monocytes.Cell Signal,2001,13(2):85~94
28.Han KY,Kwon TH,Lee TH,Lee SJ,Kim SH,Kim J.Suppressive effects of Lithospermum erythrorhizon extracts on lipopolysaccharide-induced activation of AP-1 and NF-kappaB via mitogen-activated protein kinase pathways in mouse macrophage cells. BMB Rep,2008,41(4):328~333
29.Kim S,Ponka P.Nitrogen monoxide-mediated control of ferritin synthesis:implications for macrophage iron homeostasis.Proc Natl Acad Sci USA,2002,99(19):12214~12219
30.Kuriyama-MatsumuraK,Sato H,Suzuki M,Bannai S.Effects of hyperoxia and iron on iron regulatory protein-1 activity and the ferritin synthesis in mouse peritoneal macrophages.Biochim BiophysActa,2001,1544(1-2):370~377
31.Schneider BD,Leibold EA.Effects of iron regulatory protein regulation on iron homeostasis during hypoxia.Blood,2003,102(9):3404~3411
32.Donovan A,Brownlie A,Zhou Y,Shepard J,Pratt SJ,Moynihan J,Paw BH,Drejer A,Barut B,Zapata A,Law TC,Brugnara C,Lux SE,Pinkus GS,Pinkus JL,Kingsley PD,Palis J,Fleming MD,Andrews NC,Zon LI.Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter.Nature,2000,403(6771):776~781
33.Knutson MD,Vafa MR,Haile DJ,Wessling-Resnick M.Iron loading and erythrophagocytosis increase ferroportin 1(FPN1)expression in J774 macrophages.Blood,2003,102(12):4191~4197
34.Yang F,Liu XB,Quinones M,Melby PC,Ghio A,Haile DJ.Regulation of reticuloendothelial iron transporter MTP1(Slc11a3)by inflammation.J Biol Chem,2002,277(42):39786~39791
35.Liu XB,Nguyen NB,Marquess KD,Yang F,Haile DJ.Regulation of hepcidin and ferroportin expression by lipopolysaccharide in splenic macrophages.Blood Cells Mol Dis,2005,35(1):47~56
36.Chung B,Chaston T,MarksJ,Srai SK,Sharp PA.Hepcidin decreasesiron transporter expression in vivo in mouse duodenum and spleen and in vitro in THP-1macrophagesand intestinal Caco-2 cells.JNutr,2009,139(8):1457~1462
37.王书敏,于 鹏,段相林,常彦忠.膜铁转运蛋白1,铁调素的靶分子.生物物理学报,2006,22(1):13~18 Wang SM,Yu P,Duan XL,Chang YZ.Ferroportin 1,the target of hepcidin.Acta Biophysica Sinica,2006,22(1):13~18
38.Stoian I,Manolescu B,Atanasiu V,Lupescu O,Bu u C.IL-6-STAT-3-hepcidin:linking inflammation to the iron metabolism.Rom J Intern Med,2007,45(3):305~309
39.常彦忠,段相林,钱忠明.Hepcidin和铁稳态.中华内分泌代谢杂志,2003,19(6):501~504 Chang YZ,Duan XL,Qian ZM. Hepcidin and iron homeostasis. Chinese Journal of Endocrinology and Metabolism,2003,19(6):501~504
40.Kong WN,Chang YZ,Wang SM,Zhai XL,Shang JX,Li LX,Duan XL.Effect of erythropoietin on hepcidin,DMT1 with IRE,and hephaestin gene expression in duodenum of rats.J Gastroenterol,2008,43(2):136~143
41.Liu YQ,Duan XL,Chang YZ,Wang HT,Qian ZM.Molecular analysis of increased iron status in moderately exercised rats.Mol Cell Biochem,2006,282(1-2):117~123
42.Kong WN,Zhao SE,Duan XL,Yang Z,Qian ZM,Chang YZ. Decreased DMT1 and increased ferroportin 1 expression is the mechanisms of reduced iron retention in macrophagesby erythropoietin in rats. JCell Biochem,2008,104(2):629~641
43.Theurl I,Theurl M,Seifert M,Mair S,Nairz M,Rumpold H,Zoller H,Bellmann-Weiler R,Niederegger H,Talasz H,Weiss G. Autocrine formation of hepcidin induces iron retention in human monocytes.Blood,2008,111(4):2392~2399
44. Peyssonnaux C,Zinkernagel AS,DattaV,LauthX,Johnson RS,Nizet V.TLR4-dependent hepcidin expression by myeloid cells in response to bacterial pathogens.Blood,2006,107:3727~3732
45.Lee P,Peng H,Gelbart T,Beutler E.TheIL-6-and lipopolysaccharide-induced transcription of hepcidin in HFE-,transferrin receptor 2-,and beta 2-microglobulin-deficient hepatocytes.Proc Natl Acad Sci USA,2004,101(25):9263~9265
46.Wrighting DM,Andrews NC.Interleukin-6 induces hepcidin expression through STAT3.Blood,2006,108:3204~3209
47.Verga Falzacappa MV,Vujic Spasic M,Kessler R,Stolte J,Hentze MW,Muckenthaler MU.STAT3 mediates hepatic hepcidin expression and its in-flammatory stimulation.Blood,2007,109:353~358
48.Pietrangelo A,Dierssen U,Valli L,Garuti C,Rump A,Corradini E,Ernst M,Klein C,Trautwein C.STAT3 is required for IL-6-gp130-dependent activation of hepcidinin vivo.Gastroenterology,2007,132:294~300
49.孔卫娜,赵书娥,段相林.遗传性血色素沉着症的分子机制.中华内科杂志,2006,45(4):331~333 Kong WN,Zhao SE,Duan XL.The molecular mechanism of Hereditary hemochromatosis.Chinese Journal of Internal Medicine,2006,45(4):331~333
50.Guo P,Cui R,Chang YZ,Wu WS,Qian ZM,Yoshida K,Qiao YT,Takeda S,Duan XL.Hepcidin,an antimicrobial peptide is downregulated in ceruloplasmin-deficient mice.Peptides,2009,30(2):262~266
This work was supported by grants from The National Natural Science Foundation of China(10979025,30871260),Doctoral Fund of Ministry of Education of China(20070094004)and 100 Talents Program of The Hebei Provence
Regulation of Iron-Related Proteins in Mononuclear Phagocyte System
KONG Weina1,2,ZHANG Caiyun1,DUAN Xianglin1,CHANG Yanzhong1
1.The Laboratory of Molecular Iron Metabolism,Hebei Normal University,Shijiazhuang 050016,China;
2.Hebei Chemical&Pharmaceutical College,Shijiazhuang 050026,China
Dec 8,2009 Accepted:Mar 30,2010
CHANG Yanzhong,Tel:+86(311)86267215,E-mail:chang7676@163.com
Iron metabolism in humans is characterized by limited externalexchange and by efficient reutilization of iron from internal sources.The mononuclear phagocyte system (MPS)recyclesiron from senescent red blood cellsand servesasa large storage depot for excessiron. MPS isimportant to maintain iron homeostasis.Recent studies characterizing the function and regulation of transferrin receptor 1(TfR1),ferritin(Fn),divalent metal transporter 1(DMT1),ferroportin1(FPN1),and hepcidin arerapidly expanding our knowledge base on the molecular level of MPS iron handling. Thisreview summarizes regulation of TfR1,Fn,DMT1,FPN1,hepcidin by iron level,NO,or inflammation in the MPS.
Mononuclear phagocyte system;Hepcidin;Heme oxygenase;Ferritin;Ferroportin1
2009-12-08;接受日期:2010-03-30
国家自然科学基金项目(10979025,30871260),高等学校博士学科点专项科研基金项目(20070094004),河北百名优秀创新人才支持计划 (SPRC045)
常彦忠,电话:(0311)86267215,E-mail:chang7676@163.com
R329
- Biophysics Reports的其它文章
- 内源性超氧阴离子自由基介导的莱茵衣藻光系统Ⅱ蛋白组分损伤
- 众志成城
- Induction of Apoptosis in HL60 Cells by Selenosulfate
——Cytotoxicity of Selenium Anion - 香青兰总黄酮对大鼠离体胸主动脉的舒张作用
- Hypertensive Nephropathy Treatment by Atorvastatin
——A Study of Anti-Inflammation Therapy for Target Organ Damage of Hypertension - 电子顺磁共振测量蛋白质分子内选定位点之间距离的方法及应用

