湿地植物根系泌氧及其在湿地处理中的应用
刘志宽,马青兰,牛快快
(1.太原理工大学环境科学与工程学院,山西 太原 030024;2.昆明理工大学环境科学与工程学院,云南 昆明 650093)
湿地植物根系泌氧及其在湿地处理中的应用
刘志宽1,马青兰1,牛快快2
(1.太原理工大学环境科学与工程学院,山西 太原 030024;2.昆明理工大学环境科学与工程学院,云南 昆明 650093)
湿地植物的根系泌氧能够使植物根际溶解氧及其微生物分布发生变化,并对湿地中污染物的去除具有一定的积极意义.本文综述了水生植物根系泌氧的特点、原理、影响因素,对目前根系泌氧的测定方法进行了介绍并做了相应的对比,阐述了根系泌氧在湿地处理中的应用.
湿地植物;根系泌氧;人工湿地
近年来,人工湿地系统净化污水和修复污染土壤已经成为热点话题[1-2],作为人工湿地的重要组成部分的水生植物在人工湿地净化污水的过程中起着至关重要的作用.目前湿地植物的筛选指标主要集中于植物的生物量、净化能力和景观效果等方面[3-4].由于水生植物的根系泌氧能够使植物根际溶解氧及其微生物分布发生变化,并对污水中污染物的去除具有一定的积极意义,故水生植物的根系泌氧越来越受到人们的关注.
1 水生植物根系泌氧的概念及原理
植物间歇或长期生长于水渍的土壤环境中,会给其带来诸多不利.由于氧气在液相中的扩散速率远小于在气相中的扩散速率,所以水渍环境会导致土壤中的氧气量的迅速削减[5],对于不适应根部缺氧环境的植物,根部氧气的缺失被认为是影响渍水植物生长和生存的最为不利的因素[6-7].根系泌氧(ROL)是水生植物在长期的水渍缺氧环境中自然选择的结果,是通过植物组织内部强大的通气组织来实现的[8].通气组织是具有巨大空间的海绵组织,它能够在植物组织内部为气体存储和交换提供一个方便的内部通道,使其传送的氧气被邻近组织细胞消耗或扩散到根尖和根际土壤中[9-11].植物的生存以及在缺氧介质中的根的生长取决于植物通过通气组织所传送的氧气[12].ROL就是指水生植物通过根、茎等通气组织将光合作用产生的氧气运输到根部,并通过根轴径向释放到根际土壤的过程[13].
2 ROL影响因素
影响湿地植物根部泌氧的因素主要有两类:一是内部因素,如植物的结构(通气组织、皮层细胞排列方式)[14]、植物体内氧浓度[15]、根系生物量[16]等.通气组织越发达,泌氧速率相对就越大[17];二是外部环境条件,如光照强度[18]、营养液氧化还原强度、有机酸、温度[6]等.Christine Laskov[19]等研究表明,水生植物MyriophylluMspicatum在光照及水溶液氧饱和的条件下,根系泌氧量最大;在黑暗及水溶液氧饱和的条件下,根系泌氧量次大;而在黑暗及水溶液氧缺乏的条件下,根系泌氧量最小.光照强度对ROL也有影响,对湿地植物,其主要根部泌氧速率的影响体现在:植物经光合作用会产生大量的O2,其中一部分O2会经茎内通气组织传输到根部释放,增加根部的泌氧量.这一事实也揭示出生物量和叶片的比表面积对植物根部泌氧速率有影响.B.K.SORRELL[17]的研究表明,培养液的氧化还原性对根部泌氧速率有影响,在适度的还原性强度下,根部以恒定的速率释放氧气,而在完全氧化的营养液中,根部则不释放氧气.JEAN ARMSTRONG等[20]研究发现有机酸对根部泌氧速率影响明显,培养液经有机酸处理后,根部的泌氧速率大幅度下降,ROL甚至接近为0.Norio Tanaka[21]考察了温度对植物泌氧的影响,证明了温度对植物根部泌氧有消极的影响,温度升高,泌氧速率下降.
3 ROL测定方法比较
目前水生植物根系泌氧速率测定方法有多种,其种类及优缺点见表1.

表1 植物根系泌氧测定方法比较[22]Tab.1 Comparison of ROL Measurement Methods
4 根系泌氧的应用研究展望
湿地土壤长期被水浸没会导致氧化还原电势降低,还原性物质(Fe2+,Mn2+,NO-2,S2-,HS-,H2S,CH4等)积累多.这些还原性物质的大量积累会对植物产生毒害作用,严重影响植物的生长[23].目前国内外对于泌氧水生植物的研究主要集中在农业作物上.Armstrong.J和Armstrong.W[24]研究了水稻的根系泌氧,表明了ROL能够氧化根部土壤长期缺氧所形成的有害成分.Kirk G J D等[25]则发现水稻根部泌氧能够引起根际pH的变化,使土壤中的一些营养物质更易于被植物吸收.正如Kirk GJD[26]研究表明:在NH+4占有绝对优势的情况下,水稻根部的泌氧能有效地吸收NO3-.章永松[27]等研究证明,在土壤中磷有效性明显降低的情况下,水稻根系的泌氧作用是从土壤中获取磷的重要机制之一.
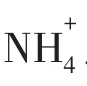
[1]吴建强,黄沈发,阮晓红,等.江苏新沂河河漫滩表面流人工湿地对污染河水的净化试验 [J].湖泊科学,2006,18(3):238-242.
[2]付融冰,杨海真,顾国维,等.潜流人工湿地对农村生活污水氮去除的研究[J].水处理技术,2006,32(1):18-22.
[3]蒋跃平,葛滢,岳春雷,等.人工湿地植物对观赏水中氮磷去除的贡献[J].生态学报,2004,24(8):1718-1723.
[4]廖新,骆世明,吴银宝,等.人工湿地植物筛选的研究[J].草业学报,2004,13(5):39-45.
[5]BloMCWP M.Adaptations to flooding stress:froMplant community to molecule[J].Plant Biol.1,1999:261-273.
[6]Colmer T D.Long-distance transport of gases in plants:a perspective on internal aeration and radial oxygen loss froMroots[J].Plant Cell Environ,2003,26:17-36.
[7]Voesenek L A C J,R ijnders J H G M,Peeters A J M,et al.Plant hormones regulate fast shoot elongation under water:froMgenes to communities[J].Ecology,2004,85:16-27.
[8]Visser E J W,Colmer T D,BloMC WP M,et al. Changes in groWth,porosity,and radial oxygen loss froMadventitious roots of selected mono-and dicotyledonous wetland species With contrasting types of aerenchyma[J]. Plant Cell Environ,2000,23:1237-1245.
[9]Evans D E.Aerenchyma formation[J].NeWPhytol. 2003,161:35-49.
[10]Visser E J W,Nabben R H M,BloMC WP M,et al. Elongation by primary lateral roots and adventitious roots during conditions of hypoxia and high ethylene concentrations[J].Plant Cell Environ,1997,20:647-653.
[11]Armstrong W.Aeration in higher plants,Advances in Botanical Research[M].London:AcadeMic Press,1979:225-332.
[12]Armstrong J,Armstrong W,Beckett P M.PhragMites australis:Venture-and huMidity-induced pressure flows enhance rhizome aeration and rhizosphere oxidation[J]. NeWPhytol,1992,120:197-207.
[13]Armstrong W,Armstrong J,Beckett P M,et al.Convective gas-flows in wetland plant aeration,Plant Life Under Oxygen Deprivation[M].Netherlands:AcadeMic Press,1991:283-302.
[14]Justin S H F W,Armstrong W.The anatoMical characteristics of roots and plant response to soil flooding[J]. NeWPhytologist,1987,106:465-495.
[15]Christine L,O liver H,Michael H.Environmental factors regulating the radial oxygen loss froMroots of MyriophylluMspicatuMand Potamogeton crispus[J].Aquatic Botany,2006(84):333-340.
[16]Caffrey J M,Kemp WM.Seasonal and spatial patterns of oxygen production,respiration and root-rhizome release in Potamogeton perfoliatus L.and Zostera marina[J]. Aquat Bot,1991,40:109-128.
参考文献
[1]Zhang Z H,Yu S Z,Wang Z T.Scavenging effects of tetramethylpyrazine on active oxygen free radicals[J].Acta Pharmacologica Sinica,1994,15(3):229-231.
[2]黄蔷,李顺意,徐顺清.吡嗪酰胺抗结核杆菌作用机制的研究进展[J].Central China Medical Journal,2006,30(1):72-73.
[3]殷彩霞,徐长德,张苏,等.吡嗪类化合物的合成研究[J].云南化工,1992(2):7-8.
[4]李晓娟,戴立言,王晓钟,等.2-氨基-3-甲基吡啶的合成新方法[J].化学世界,2006(2):105-107.
责任编辑:毕和平
[10]张天荫.动物胚胎学[M].济南:山东科学技术出版社,1996:143-158.
[11]殷名称.鱼类早期生活史研究及其进展[J].水产学报,1991,15(4):348-358.
[12]刘基,詹宝华,苏展.赤点石斑鱼胚胎及仔鱼发育的初步观察[J].福建水产,1986(4):16-22.
[13]丁天喜.石斑鱼人工育苗技术进展 [J].浙江水产学院学报,1990,9(1):43-50.
[14]陆忠康.石斑鱼养殖研究的现状及面临的问题 [J].现代渔业信息,1996,11(1):8-12.
[15]雷霁霖,卢继武.美洲黑石斑鱼的品种优势和养殖前景[J].海洋水产研究,2007,28(5):110-115.
责任编辑:黄 澜
Prospect on Radial Oxygen Loss of Wetland Plants in the Wetland
LIU Zhikuan1,MA Qinglan1,NIU Kuaikuai2
(1.Faculty of Environmental Science and Engineering,Taiyuan University of Technology,Taiyuan 030024,China;
2.Faculty of Environmental Science and Engineering,Kunming University of Science&Technology,Kunming 650093,China)
Radial Oxygen Loss of Aquatic plants can make the distribution of dissolved oxygen and the microorganisMchange in the plant rhizosphere,and has certain positive sense to for the pollutant elimination in the wetland.The characteristics,principles and influencing factors of secreting oxygen by aquatic plant roots were reviewed in this paper,the current determination methods of oxygen secreted froMthe root were introduced and compared,finally the application of root secretion of oxygen and prospect of handling the wetland were explained.
wetland plants;ROL;constructed wetland
Q 945.1 2
A
1674-4942(2010)01-0084-03
2009-11-28

