清肺口服液对呼吸道合胞病毒感染人胚肺成纤维细胞TGF-β1mRNA基因表达的影响*
李 琳 袁 斌 于希忠 徐建亚 赵长江 吴琴琴
清肺口服液对呼吸道合胞病毒感染人胚肺成纤维细胞TGF-β1mRNA基因表达的影响*
李 琳1袁 斌2△于希忠3徐建亚1赵长江4吴琴琴1
目的探讨清肺口服液含药血清对呼吸道合胞病毒(RSV)感染的人胚肺成纤维细胞(HELF)转化生长因子-β1(TGF-β1)基因表达的影响。方法RSV攻击体外培养的HELF细胞后,以清肺口服液含药血清、利巴韦林含药血清及空白血清干预,采用实时荧光定量PCR法测定各组HELF TGF-β1表达变化。结果 病毒对照组较正常细胞组TGF-β1下降至1/3,清肺口服液含药血清组可显著升高TGF-β1水平至RSV感染细胞的2倍。利巴韦林含药血清和空白血清作用相似,对TGF-β1表达有一定的影响。结论RSV感染可使HELF细胞TGF-β1mRNA表达水平显著下降;清肺口服液可调节TGF-β1mRNA表达,减缓RSV感染后细胞的异常变化,这可能是其抗病毒作用机制之一。
清肺口服液 呼吸道合胞病毒 转化生长因子β1实时荧光定量PCR
1南京中医药大学(南京210029)
2南京中医药大学附属医院(南京210029)
3南京师范大学(南京210097)
4江苏省江阴市人民医院(江阴214400)
*江苏省自然科学基金项目(No.BK2005219);江苏省六大人才高峰项目(No.2008022D)
△通信作者
肺炎是儿科临床常见病、多发病,据报道,全世界5岁以下儿童每年200~300万死于肺炎。我国每年死于肺炎的小儿约30~40万,本病己成为我国小儿发病的第1位病因及第1位死因[1]。呼吸道合胞病毒(RSV)是世界范围内小儿呼吸道感染最重要的病毒病原,引起的肺炎症状较重,严重影响小儿的生命健康。RSV感染后主要表现为毛细支气管炎,血管炎和间质性肺炎。相关发病学机制研究表明,多种生长因子同时参与肺的炎症反应,其中转化生长因子β1(TGF-β1)对调控肺成纤维细胞分裂、增殖及胶原蛋白的合成与降解起十分重要的作用[2]。我们前期临床研究表明清肺口服液对RSV肺炎具有较好的疗效[3],而体外实验研究发现,清肺口服液对感染RSV后人胚肺成纤维(HELF)细胞TGF-β1蛋白水平的降低,具有一定的调节作用。为进一步探讨TGF-β1在本病发病中的作用,阐明清肺口服液的疗效机理,我们采用实时荧光定量PCR法(Real Time-PCR),从基因水平观察了各组RSV感染后人胚肺成纤维细胞TGF-β1mRNA表达变化。
1 材料
1.1 动物及试剂 健康大耳白兔9只,雌雄各半,体质量2.5~3kg,由南京中医药大学实验动物中心提供,许可证号:SCXK(苏)2005-0009。DMEM 培养基(美国 Gibico公司),新生牛血清 (杭州四季青公司),胰蛋白酶 (美国Gibico公司),Trizol试剂(美国Invitrogen公司,批号:1392923),M-MLV反转录酶(美国 Promega);SYRB Green I(美国 Stratagene); 人 TGF-β1、β-actin引物由上海生工生物工程技术服务有限公司合成。
1.2 细胞及病毒株 HELF、人喉癌上皮细胞Hep-2均由凯基生物科技发展有限公司提供,本实验采用第5~30代细胞。呼吸道合胞病毒A亚型Long株,由广州博特生物工程有限责任公司提供,在人喉癌上皮细胞(Hep-2)上增殖活化。
1.3 药品制备 清肺口服液:主要药物为麻黄、葶苈子、虎杖等,由南京中医药大学附属医院制剂室负责制剂和质量控制,每剂含生药1mg/mL。利巴韦林颗粒(新博林):四川百利药业有限责任公司生产,批号080335。含药血清及空白血清的制备:将动物随机分为3组;A组灌服清肺口服液,给药剂量48g/(kg·d),分两次给予(相当于临床等效剂量的4倍);B组灌服利巴韦林溶液,剂量31mg/(kg·d);C组给相应体积的生理盐水。连续给药3d,末次给药前12h禁食不禁水。末次给药1h后,颈动脉分离取血,血液静置30min后,离心取血清,56℃水浴30min灭活,在超净工作台上过滤除菌,分装于1.5mL EP管,-70℃冰箱保存备用。
1.4 仪器 MCO-20AIC CO2培养箱、超净工作台,MDF-382超低温冰箱(日本SANYO),IX50型倒置显微镜(日本Olympus),5417型低温高速离心机、Biophometer生物分光光度计(德国EPPENDORF),Mx3000P荧光定量PCR仪(美国Stratagene)。
2 方法
2.1 人喉癌上皮细胞的培养 Hep-2置于37℃、5%CO2孵箱中培养。培养液可选用DMEM加10%新生牛血清,生长状态良好的细胞每2~3天可传代,0.25%胰酶消化,常温下约需2min,以镜下观察细胞回缩变圆时停止消化,每次分3~4瓶。
2.2 病毒的扩增 待Hep-2在25mL培养瓶中长满60% ~70%后,倒去液体,加入适量(300~500μL)病毒液,于37℃,5%CO2培养箱中吸附1.5h后,补充维持液(DMEM培养液含2%新生牛血清)3mL。逐日观察细胞病变(CPE,典型病变是融合的大泡),病变达75%以上时收集病毒液,2000r/min离心8min,分装,-70℃保存备用。
2.3 含药血清和含利巴韦林血清对Hep-2细胞最大无毒浓度测定 将1×105/mL浓度的HELF细胞悬液加入96孔细胞板,每孔0.1mL,培养24h。以DMEM单培稀释清肺口服液含药血清、利巴韦林含药血清及空白血清,依次设50%、40%、30%、20%、10%5个浓度。将长成单层细胞的细胞板弃去培养液,分别加入各浓度的含药血清及空白血清,每孔0.1mL,并设正常细胞对照组。置37℃、5%CO2培养箱中培养,每日观察细胞病变,连续观察5d。细胞无病变的最低稀释度为最大无毒浓度。结果为20%含药血清。
2.4 RSV组织培养半数感染量(TCID50)测定 以1×105/mL浓度的Hep-2细胞接种96孔细胞板,每孔0.1mL。病毒悬液用DMEM单培10倍梯度稀释8个浓度。在接种细胞后18~36h内,细胞长成单层时吸弃培养液,PBS洗细胞面,接种各稀释度的病毒液,每个稀释度接种5孔,每孔50μL,并设正常细胞对照组。置37℃、5%CO2培养箱中吸附1.5h。吸弃病毒液,每孔加入2%维持液100μL,置37℃、5%CO2培养箱中培养,逐日观察病变。以最高稀释度不再出现新病变时为终点,计算TCID50,结果RSV TCID50为 10-3.34/100μL,TCID50≥50% 的阳性百分率稀释度的对数+距离比率。
2.5 HELF细胞培养与分组 将复苏后的HELF细胞以1×106/瓶接种于25mL培养瓶中,加入DMEM全培(含10%新生牛血清),置37℃,5%CO2饱和湿度条件下培养。待细胞基本长满瓶壁后,用0.25%胰蛋白酶消化,进行传代培养。随着细胞数量的增多,分5组:含药血清组、空白血清组、利巴韦林血清组、病毒对照组、正常细胞组。每组两瓶细胞。
2.6 病毒攻击及细胞收获 培养24h,细胞长成单层(密度约90%以上)时,除正常细胞组外,各组细胞均弃上清液,用DMEM单培漂洗1遍后,加入100μL 100TCID50病毒液与100μL单培,置CO2培养箱吸附1.5h。后弃去病毒液,DMEM单培漂洗2次,分别加入20%清肺口服液含药血清,20%空白血清,20%利巴韦林含药血清;正常细胞组和病毒对照组只加维持液,置细胞培养箱中培养24h。弃去各组上清液,PBS漂洗1遍,加入1mL单培,以细胞刮刀轻刮细胞至培养液中,2000r/min离心10min,收集细胞沉淀于1.5mL dorf管中。
2.7 细胞总RNA的提取 每组细胞沉淀中加入1mL Tizol,轻轻吹打,裂解细胞。4℃,12000r/min离心10min,收集上清液,转移到新的无RNA酶的1.5mL dorf管中。常温放置5min后,每1毫升Trizol加氯仿200μL,剧烈震荡至呈粉红色。常温放置2~3min后,4℃,12000r/min离心15min。去上清,每1毫升Trizol加500μL异丙醇,轻摇晃均匀。常温放置10min后4℃,15000r/min离心,16min。弃上清液,加入75%的乙醇(Rnase-free水配制),4℃,12000r/min 离心。10min,沉淀。控干乙醇,RNA 沉淀干燥5~10min后加Rnase-free水溶解,于Biophometer生物分光光度计上测定各组RNA纯度及浓度,其中A260/A280>1.7,-80℃保存备用。
2.8 逆转录反应 5μL Rnase-free水,加1μL随机引物,2μg RNA,70℃,5min混合,再置冰上速冻5min。然后依次加入5μL Buffer、0.625μL RNase抑制剂、1.25μL dNTP,加入补齐反应体系(25μL)所需相应量水,最后加1μL逆转录酶M-MLV。42℃逆转录1h,冰浴5min,合成cDNA第1链,-80℃保存备用。
2.9 Real Time PCR扩增β-actin、TGF-β1基因片断 引物的设计:在GenBank中进行搜索,获得所需序列,根据序列的5'末端与3'末端设计引物。TGF-β1-F:5'-TGG AAA CCC ACA ACG AAA T-3',TGF-β1-R:5'-AGG CG AAA GCC CTC AAT-3',退火温度为52℃。β-actin-F:5'-GTG CGG AAG CCA ATC-3',β-actin-R:5'-ACG GAC GAG GGA AAC AAT -3'。
各取上述cDNA产物1μL做模板,利用SYBR Green I染料实时定量PCR检测药物处理后RSV感染的HELF细胞TGF-β1 mRNA表达变化,以β-actin作为内对照。实时Real Time-PCR反应体系:7.5μL 2×Mix(含荧光染料 SYRB,dNTP 等)、上下游引物各 3μL、cDNA 1μL。扩增条件为:95℃预变性 10min,95℃30s,52℃退火60s,72℃延伸30s,于 Mx3000P荧光定量 PCR仪内扩增40个循环(见图1)。每份标本设2个复孔检测,取其循环阈值均值(Ct值,即PCR反应过程中出现荧光信号的初始循环数)。采用比较2-△△Ct法分析各基因在细胞中的相对含量。△△Ct=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组,以△△Ct值为定量结果进行统计分析,则目的基因的量 =2-△△Ct[8]。
3 结果
3.1 细胞总RNA质量及纯度检验 每份样品其A260nm/A280nm吸光度比值均在1.8~2.0之间,说明所提RNA纯度较高。
3.2 药物处理后RSV感染的HELF细胞TGF-β1的mRNA表达变化 见表1,图1。结果显示,与正常细胞比较,病毒感染24h后,HELF细胞中TGF-β1的表达量下降为1/3;而感染病毒后马上用空白血清或含利巴韦林的血清干预,HELF细胞中TGF-β1的表达量回复上升为病毒对照组的3倍多,甚至比正常细胞组还高;与空白血清组或含利巴韦林组不同,感染病毒后马上用含清肺口服液的血清干预,HELF细胞中TGF-β1的表达量回复上升为病毒对照组的近2倍,但仍然比正常细胞组稍低。
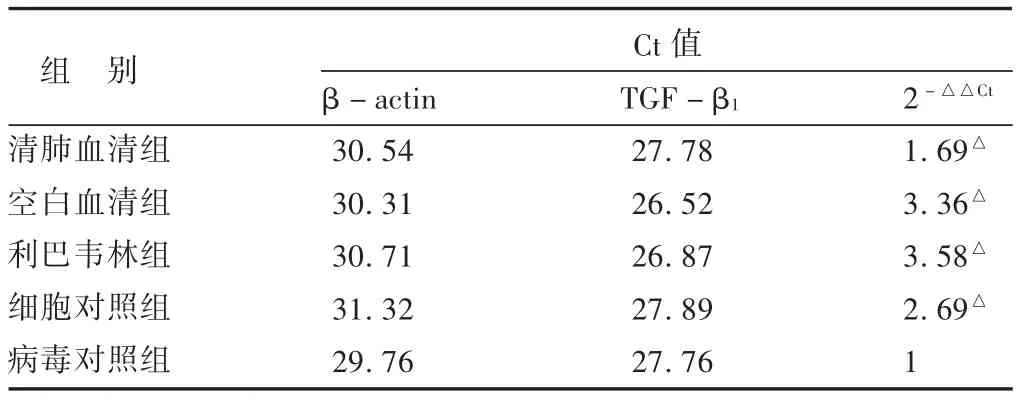
表1 各组细胞荧光定量Ct值及2-△△Ct值
图1 TGF-β1扩增曲线
4 讨论
近年来发展起来的Real Time-PCR技术以其灵敏度高、检测速度快、特异性强等优点,已在病原体定性定量检测、肿瘤基因检测、免疫分析、基因表达水平分析及其多态性研究等多个领域得到应用[4-5]。在RSV感染的过程中,RSV感染激发了机体的免疫系统,诸多细胞因子参与了此过程。在肺纤维化病灶区,TGF-β1作为细胞因子之一,作用于多个环节,在炎性细胞和非炎性细胞以及肺间质中表达增加,且其在炎性细胞内的增加出现较早。TGF-β1在肺间质纤维化过程中发挥重要作用,其过度表达,将加重炎症反应与细胞过度增殖及各种细胞因子和炎症介质的释放,促进肺泡炎及肺纤维化形成。研究证实TGF-β1 mRNA的高度表达可激发肺泡炎症,在肺泡急性炎症及间质性肺炎中发挥重要作用[6]。我们前期研究表明,体外培养的人胚肺成纤维细胞感染RSV后,经ELISA法检测其细胞上清液中TGF-β1较正常组明显降低。本实验进一步证实RSV感染可使TGF-β1mRNA表达降低,说明病毒感染不仅可从蛋白质水平,尚可从mRNA水平调节TGF-β1的表达,TGF-β1可能参与了RSV肺炎的发病过程。
利用RSV攻击体外培养的HELF细胞后,以清肺口服液含药血清、利巴韦林含药血清及空白血清干预,采用Real Time-PCR法测定各组人胚肺成纤维细胞TGF-β1mRNA表达变化。结果发现,病毒对照组较正常细胞组TGF-β1下降为1/3,提示可能在病毒感染的早期TGF-β1的产生被抑制,不能发挥抗过度免疫反应的作用。经清肺口服液含药血清组可显著升高TGF-β1至RSV感染细胞的2倍,提示清肺口服液可以拮抗这种异常变化。本实验结果表明,经清肺口服液含药血清作用后,过度降低的TGF-β1水平又回复升高。清肺口服液可调节TGF-β1等细胞因子的mRNA表达,缓减RSV感染后细胞的异常变化,这可能是其抗病毒作用的机制之一。利巴韦林含药血清和空白血清作用相似,对TGF-β1表达有一定的影响。空白血清作用后,TGF-β1水平过度表达,提示血清中可能含有某些物质能够促进TGF-β1的转录从而激发肺泡炎症,而清肺口服液使病毒感染细胞的TGF-β1回复上升的同时可以拮抗血清诱导的TGF-β1的过度表达,从而使其达到适中水平。利巴韦林含药血清与空白血清作用相似,没有显示药物作用,进一步佐证了利巴韦林抗病毒作用靶点不在TGF-β1上。
综上所述,RSV的致病过程中可能有细胞因子TGF-β1的参与。清肺口服液可以通过对TGF-β1mRNA的影响,从基因水平对炎症细胞因子加以干预,阻断病毒性肺炎发病过程,这可能是其抗病毒作用机制之一,但是病毒性肺炎的发病机理是复杂的,是多种细胞因子参与、共同作用的结果,TGF-β1在其中究竟通过何种途径起作用尚需要更多的实验加以阐明。本实验从基因水平探讨清肺口服液的药物动力学,为进一步探讨清肺口服液抗病毒机制提供依据和支持。此外,实验研究中建立的药物对RSV相关基因调控影响的分子生物学实验研究方法及实时荧光定量PCR技术的应用,可为病毒性疾病实验研究提供参照。
[1]陈莲香.浅谈小儿肺炎的治疗 [J],中国医药指南,2008,6(1):214.
[2]Matsuse T.Growth factor in the process of inflammation and fibrosis in the lung[J].Nihon Kokyuki Gakkai Zasshi,1998,36:413 - 420.
[3]袁斌,任现志,孙轶秋,等.清肺口服液治疗小儿呼吸道合胞病毒肺炎166例临床研究[J].中医杂志,2009,50(3):221-223
[4]张其威,游上游,孙继民,等.呼吸道合胞病毒实时荧光定量PCR检测[J].第一军医大学学报,2005,25(7):847-852.
[5]李金明.聚合酶链反映临床应邀的优越性和局限性 [J].中华检验医学杂志,2005,28(3):225 -227.
[6]张志琴,呼海燕,司军强.TGF-β在肺纤维化中的作用[J].农垦医学,2002,24(6):435.
Effect of Qingfei Oral Liquid on TGF-β1mRNA expression of Respiratory Syncytial Virus Infected Human Embryonic Lung Fibroblasts
LI Lin1,YUAN Bin2,YU Xi-zhong3, et al
1 Nanjing University of Chinese Medicine(Nanjing 210029)
2 Affiliated Hospital of Nanjing University of Chinese Medicine(Nanjing 210029)
3 Nanjing Normal University(Nanjing 210097)
Objective:To study the effect of Qingfei Oral Liquid on expression of TGF-β1geng in Respiratory Syncytial Virus(RSV)infected Human Embryonic Lung Fibroblasts(HELF).MethodsHELF cells in vitro cultured infected with RSV were intervened by the Qingfei Oral Liquid medicated serum,the ribavirin medicated serum and the blank serum.The expression variation of the TGF-β1in the HELF was detected by the Real-time fluorescence quantitative PCR method.ResultsCompared with normal cell,TGF-β1with virus infection was decreased to 1/3.The TGF-β1in the Qingfei Oral Liquid medicated serum group was increased to 2 times of that in RSV infected cells.Ribavirin medicated serum group and blank serum group have similar effect.They have certain effect on expression of TGF-β1.ConclusionThe expression level of TGF-β1mRNA in HELF cells infected with RSV could be decrease significantly.Qingfei Oral Liquid can regulate mRNA expression of TGF-β1and attenuate the abnormal changes of RSV infected cells.It may be one of the mechanisms of its antiviral effect.
Qingfei Oral Liquid;Respiratory Syncytial Virus;Transforming growth factor(TGF) -β1;Real-time fluorescence quantitative PCR method
R285.5
A
1004-745X(2010)10-1724-03
2010-01-11)

