镰刀菌毒素对母猪繁殖性能的影响及其作用途径
徐盛玉 王定越 吴 德
(四川农业大学动物营养研究所,雅安625014)
镰刀菌(Fusarium)是饲料中最常见的污染性霉菌,镰刀菌毒素是镰刀菌在生长过程中产生的各种有毒代谢产物,其中玉米赤霉烯酮(zearalenone,ZEA)和脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)的污染尤为普遍,这2种毒素均会导致母猪繁殖力下降。许多国家和地区对ZEA和DON的毒性作用都表现出高度重视,2006年欧盟规定仔猪和小母猪饲粮ZEA含量应不超过0.10 mg/kg,经产母猪和肥育猪不超过0.25 mg/kg;饲粮DON的最高剂量不超过0.90 mg/kg。德国农林部要求初情期母猪饲粮ZEA上限为0.05 mg/kg,DON上限为1.00 mg/kg。我国配合饲料和玉米ZEA的限量标准为0.5 mg/kg,配合饲料中DON的限量标准为1.0 mg/kg。本文就镰刀菌毒素ZEA和DON对母猪繁殖性能的影响及其发生作用的途径做一综述。
1 镰刀菌毒素污染饲料现状
美国学者Burlakoti等[1]发现ZEA、DON的检出量在小麦中可高达623~782μg/g,大麦中可高达171~ 255μg/g,土豆中可高达453~589μg/g,在甜菜中也可达17~336μg/g。Chin等[2]对亚洲饲料霉菌毒素污染情况调查表明ZEA和DON的平均检出量东亚为 396~969μg/kg,东南亚为199~219μg/kg,南亚为76~1 182μg/kg。杨晓飞等[3]对高温、潮湿的四川地区饲料原料霉菌毒素含量分析发现,ZEA在玉米蛋白粉、小麦和其他谷物副产品中的最高检出量可达1 816.09μg/kg,检出率为74.07%,超标率为14.81%;而饲料原料样品中DON污染更为严重,其最高检出量达17 163.13μg/kg,检出率为100%,超标率高达64.28%。由此可见,镰刀菌毒素ZEA和DON对饲料及饲料原料的污染广泛而严重。
2 镰刀菌毒素ZEA与DON
ZEA化学名为6-(10羟基-6氧基-十一-碳烯基)β-雷锁酸内酯,纯ZEA为白色晶体。ZEA与雌激素(estradiol,E2)有着相似的化学结构,且具有E2活性,ZEA在肝脏和肠黏膜中被3-OH-类固醇脱氢酶代谢为玉米赤霉烯醇(zearalenol,ZEL),ZEL有 α-ZEL和 β-ZEL 2种异构体。研究发现,α-ZEL是ZEA在猪肝脏中的主要代谢产物[4],除肝脏外,在猪卵泡颗粒细胞中 ZEA亦可代谢成α-ZEL[5]。α-ZEL具有强烈的E2合成代谢活性,活性比ZEA高,β-ZEL的活性与ZEA相似。
DON又名呕吐毒素(vomitoxin,VT),是一种单端孢霉烯族毒素,为3α,7α,15-三羟基-12,13-环氧单端孢霉-9烯-8酮,纯DON为无色针状结晶。动物对DON的反应有种属和性别差异,雄性动物对此毒素更敏感,猪比小鼠、家禽、反刍动物更敏感。急性动物试验表明,大剂量 DON(≥27 mg/(kg BW◦d))可以导致动物死亡;低剂量DON(≥50μg/(kg BW◦d))则可以使最敏感的动物——猪发生呕吐,进而引起猪拒食、采食量下降、体重减轻和腹泄等生理变化。
3 镰刀菌毒素ZEA与DON对母猪的毒性效应
3.1 ZEA与DON对初情期前母猪的毒性作用
研究表明,生长阶段的母猪饲喂污染ZEA的霉玉米,其增重、采食量和料重比随日粮中霉玉米比例增加而下降;饲喂自然霉变小麦配合的饲粮,试验前期随着DON和ZEA在饲粮中添加浓度的提高(4个处理的DON 浓度分别为:0.21、3.07、6.10和9.57 mg/kg;4个处理的ZEA浓度分别为0.004、0.088、0.235和0.358 mg/kg),母猪拒食现象的比例升高,而试验后期拒食现象消失[6]。
初情期前母猪以自由采食方式饲喂含ZEA 10 mg/kg的饲粮,3~5 d后现阴户肿大和发红的现象,并且该现象在试验期内持续发生,初情期也较正常母猪晚[7]。其他学者也发现初情期前母猪饲喂ZEA(200μg/kg BW)后表现出发情症状(阴户红肿),但没有静立反射现象发生[8]。
可见,镰刀菌毒素对初情期前母猪的影响主要表现为影响其采食量和体增重。此外,ZEA还影响初情期前母猪的发情时间,导致其出现阴户红肿、水肿等假发情现象。
3.2 ZEA与DON对妊娠母猪的影响
母猪配种后2~15 d饲喂含ZEA 5~30 mg/kg的饲粮不会影响胚胎的正常发育,但ZEA含量达60和90 mg/kg时在妊娠40~43 d屠宰母猪发现其子宫内没有活胚存在[9]。而用自然霉变小麦配合饲粮(DON和ZEA含量分别为4.420和0.048 mg/kg)饲喂妊娠35~70 d的德国种长白母猪,对母猪生长、生产性能及胎儿没有显著影响[10],可能是因为霉菌毒素含量太低。
Diaz-Llano等[11]发现自然霉变小麦配合饲粮(DON和ZEA含量分别为5.5和0.3 mg/kg)显著影响妊娠(90±3)d至分娩的约克夏母猪的日增重、料肉比和死胎率,由于采取限饲的方式因而平均日采食量差异不显著。饲粮中9.570 mg/kg的DON和0.358 mg/kg的ZEA显著影响妊娠75~110 d德国种长白母猪采食量和体增重,但对产仔数的影响差异不显著,肉眼观察新生仔猪均为正常,新生雌性小猪也没有阴户发红和肿大的现象,试验组仔猪平均体重较对照组降低了16%[12]。同等剂量的毒素饲喂妊娠75~110 d的母猪,发现试验组母猪拒食率高达(32.00±6.34)%,母猪体增重只有对照组的84%,仔猪的平均体重也较对照组低18%[13]。
以上研究说明DON>ZEA的自然霉变污染饲粮,DON含量在4.42 mg/kg以上将显著降低妊娠母猪的采食量、体增重和胎儿重量。
3.3 ZEA与DON对泌乳母猪的影响
目前为止,镰刀菌毒素对泌乳母猪的影响报道不多,妊娠至泌乳阶段DON含量为3.3 mg/kg的饲粮对母猪泌乳期的采食量影响差异不显著,但体损失显著提高,对断奶活仔猪数的影响差异不显著。而ZEA含量为10 mg/kg的饲粮将增加母猪从断奶到发情的间隔时间[14]。
Diaz-Llano等[15]研究自然条件下镰刀菌感染的小麦-玉米配合饲粮(DON和ZEA含量分别为5.5和0.3 mg/kg)对约克夏第1胎产奶母猪的影响,试验从妊娠(90±3)d开始至泌乳 21 d结束,结果发现试验组平均体重、平均日采食量显著下降,分娩当天试验组血清总蛋白浓度较对照组降低,乳汁成分、断奶窝重和哺乳期的死亡率未受到显著影响。断奶后2 d用成熟公猪诱情,以出现“静立反射”判断为发情,尽管统计学差异不显著,但试验组返情间隔时间较对照组增加了8.7 d。
4 镰刀菌毒素ZEA与DON的作用途径
4.1 DON对采食中枢的影响
母猪采食自然污染镰刀菌的饲粮后,将显著降低下丘脑、脑桥中多巴胺和脑桥中二羟苯乙酸及去甲肾上腺激素的浓度,而下丘脑和脑桥中5-羟吲哚乙酸(5-HIAA)与5-羟色氨酸(5-HT)的比值提高。脑桥中5-HIAA与5-HT的比值是5-羟色氨酸能神经递质的一个敏感指标,它比单独的代谢物质更能反应5-羟色氨酸能神经递质的变化。Prelusky等[16]研究也发现DON能导致猪5-羟色氨酸能神经递质的提高。5-羟色氨酸能神经递质升高可能与动物的采食下降、呕吐及采食镰刀菌污染饲粮后的其他行为变化有关。
4.2 ZEA与DON诱导脂类发生过氧化反应
镰刀菌毒素可通过加速自由基的产生和损害抗氧化系统来加速脂肪的过氧化反应。单端孢霉烯族毒素是两性(亲水亲脂)分子,可通过与细胞膜作用发挥其细胞毒性。DON损伤肝实质细胞,刺激谷草转氨酶(AST)释放,并随DON剂量的增加而升高,即使小剂量也可导致肝细胞的局部空泡变性[13],说明DON会损伤细胞脂质膜。
ZEA以浓度依赖方式增加丙二醛(MDA)的生成,通过增强脂质的过氧化反应诱导人肠细胞系Caco-2细胞的氧化损伤[17]。因此,氧化损伤可能也是ZEA发挥毒性作用的主要途径之一。Kouadio等[18]报道DON和ZEA均可诱导Caco-2细胞脂质过氧化作用,其能力大小为DON>ZEA。
4.3 ZEA与DON影响卵母细胞成熟和附植前胚胎发育
镰刀菌污染饲粮显著影响母猪卵母细胞质量,染色体成熟比例、卵母细胞质量均随DON和ZEA饲喂浓度的增高而降低。卵丘-卵母细胞复合物(COCs)体外培养发现其成熟比例随DON和ZEA饲喂浓度的增高而降低[6]。体外培养试验也发现,添加α-ZEL、β-ZEL和DON均显著影响卵母细胞的成熟和退化比率,并呈剂量依赖关系[19]。
卵泡液中E2的浓度约为89 ng/mL[20],可以推测正常情况下卵母细胞就是处于这样一个E2浓度中生长发育的。然而,目前没有证据表明减数分裂恢复过程中需要E2参与,相反,体外成熟培养试验表明E2在减数分裂时会扰乱细胞核成熟并导致纺锤体的形成紊乱。E2以弥散方式在细胞中出入,在靶细胞中它与核受体雌激素受体1(ESR1)和雌激素受体2(ESR2)结合,引起受体结构改变,从而与DNA上特定元件相结合启动细胞内转录机制,激活或抑制相关转录过程。ZEA与E2有着相似的结构,ZEA与ESR1和ESR2的亲和力是E2的7%和15%,ZEA通过内质网(ER)引发的反应与E2相同,且ESR1引起的转录效率比ESR2更高[21]。
添加正常剂量(0.312μmol/L)的E2以及ZEA和DON探讨对卵母细胞体外成熟的影响,结果发现E2、ZEA、α-ZEL、β-ZEL和DON 均显著降低猪卵母细胞体外培养的成熟比率,细胞核异常比率升高,且呈现剂量依赖关系[22]。镰刀菌毒素影响了卵母细胞成熟过程中的正常分裂过程。正常条件下卵母细胞培养30 h可达到M-Ⅰ期,生发泡破裂发生,同源染色体在微管形成的纺锤体牵引下开始分离(图1A)。培养40 h后大多数卵母细胞达到M-Ⅱ期,此时第一极体已经形成,染色体在微管的牵引下位于赤道板(图1B)。而用3.12μmol/L E2处理卵母细胞30 h后,发现没有微管形成(图1C),处理40 h后,染色体凝聚,但没有正常的排列,微管开始消失或是没有形成正常的纺锤体(图1D)。已有报道认为E2可以不通过ER在细胞内起作用,这被称为一种非基因效应,因此可以认为E2导致的卵母细胞异常不仅是其与ER结合后引起的效应,也可能是这种非基因效应。事实上,已发现E2可以和微管蛋白结合并阻止微管蛋白的聚合[23]。ZEA处理的结果与E2类似(图1E和图1F),这也说明ZEA的作用机制不仅是激活雌激素受体,也可能直接影响了微管的形成。相反,DON处理后形成了清晰的纺锤体样结构,但与正常的纺锤体不同,微管显得很模糊(图1G),培养 40 h后,微管开始消失(图 1H)。ZEA和DON联合作用(ZEA和 DON浓度均为1.56μmol/L)时,细胞核出现畸变,形态与 ZEA和DON单独作用时的效应叠加相似(图1I和图1J)。
考察镰刀菌毒素对卵母细胞的受精率、卵裂率和囊胚率影响发现,3.12μmol/L的ZEA处理较对照显著降低了卵母细胞体外受精后的卵裂率和囊胚率。而DON处理过的卵母细胞由于纺锤体的异常导致大部分不能继续发育,只有极少数发育到卵裂阶段,但最终没有形成囊胚[22]。
经过毒素处理的卵母细胞发育为囊胚的比率严重降低,并且这些胚胎大部分存在多倍体细胞,有的细胞甚至包含11个7或14号染色体[22]。这种染色体复制的机制目前还不清楚,但这种含大量异常细胞的胚胎其本身的细胞数就很少,说明这种胚胎细胞复制了DNA但没有正常的进行细胞分裂或是异常的染色体抑制了胚胎的进一步发育。
4.4 ZEA与DON对颗粒细胞的直接作用
母猪性成熟前ZEA的添加剂量达到200μg/kg体重时,卵巢表面很少卵泡存在,大部卵泡分布在卵巢的皮质层,这种卵泡充满了富含蛋白质的液体但却没有颗粒细胞层。而在发育成熟的单个大卵泡中颗粒细胞层的一种凋亡样过程被激活[24]。但也有学者发现卵泡大小的分布不受饲喂镰刀菌毒素污染饲粮的影响,DON和ZEA的饲喂浓度提高到9.570和0.358 mg/kg饲粮时,颗粒细胞的形态也不受其影响[6]。
体外培养取自1~5 mm卵泡的颗粒细胞,发现DON和ZEA对促卵泡生成素(follicle-stimulating hormone,FSH)和胰岛素样生长因子-Ⅰ(insulin-like growth factor-Ⅰ,IGF-Ⅰ)诱导的猪颗粒细胞产生E2具有双向作用,在小剂量时促进E2的产生而大剂量时则抑制E2的产生。DON对IGF-Ⅰ诱导产生孕酮具有抑制作用,而ZEA对FSH和IGF-Ⅰ诱导产生孕酮具有促进作用。ZEA对颗粒细胞增殖没有影响,而DON为10和100 ng/mL时促进了颗粒细胞的增殖[25]。ZEA和DON单独作用时对血清诱导的细胞生长没有作用,但联合作用时促进了细胞的增殖[25]。可见镰刀菌毒素可以直接作用于颗粒细胞并影响其激素的分泌和细胞增殖,这种对颗粒细胞的直接作用可能是采食镰刀菌毒素后影响母猪繁殖性能的机理之一。
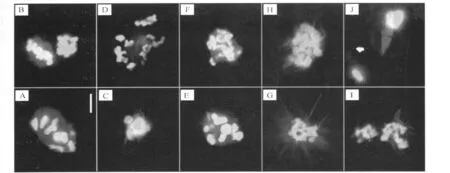
图1 卵母细胞减数分裂时纺锤体形态Fig.1 Spindle morphology of oocytes meiosis
4.5 ZEA与DON对母猪和胎儿脏器的影响
以自然镰刀菌感染的黑小麦配合饲粮(DON和ZEA含量分别为4.42和0.048 mg/kg),每天2 kg饲喂妊娠35~70 d的母猪,尽管肉眼观察不到母猪和仔猪任何器官的损伤,DON和ZEA对母猪肝脏铁离子和糖原的影响差异不显著,肝脏铁离子的浓度也与Starzynski等[26]报道相似,但在胎儿肝脏中发现糖原含量显著升高并且存在线粒体损伤(图2)[27]。
组织病理学检查发现,母猪脾脏红髓的铁染色显著提高。透射电子显微镜观察脾脏切片发现,由于2价铁离子浓度的上升提高了含铁血黄素在脾脏中的含量[27]。DON和ZEA增加了母猪脾脏细胞中含铁血黄素的沉积,可能是因为被隔离在脾脏窦状组织中的受损红血细胞数的增加。脾脏的主要功能是将年老的和受损的红血细胞清除出血液。脾脏中铁的增加说明转铁蛋白已经达到饱和没有能力结合过多的铁离子,而导致多余的铁离子留存在脾脏细胞。过量铁离子蓄积在实质器官中将影响细胞活力,当铁离子缓冲能力不堪重负时,氧化应激导致的细胞损伤和纤维化形成的几率将极大提高。可见母猪妊娠35~70 d时饲喂镰刀霉菌污染的小麦尽管没有临床症状,但引起了母猪脾脏功能障碍(含铁血黄素沉着症),导致了胎儿肝糖原升高和线粒体损伤。
妊娠75~110 d饲喂霉变饲粮(DON和ZEA含量分别为9.570和0.358 mg/kg)小母猪所产小猪脾脏重量较对照组显著降低了25%[12]。同等剂量的毒素饲喂相同阶段的小母猪,结果发现肉眼观察不到母猪和仔猪器官的损伤,母猪的肝脏和脾脏重量没有受到影响,但仔猪的脾脏重量较对照组显著降低。母猪肝脏铁颗粒沉积显著高于对照组,而仔猪差异不显著[13]。电镜扫描发现母猪肝脏细胞的胞质中存在大量自体吞噬体和脂肪空泡,粗面内质网核糖体脱落,滑面内质网存在大的病灶,但线粒体正常。脂肪空泡的出现可以推测脂质过氧化代谢将阻碍肝细胞的功能,但还未引起肝脏纤维化。
可见母猪妊娠的最后35 d饲喂镰刀菌毒素导致铁留存量提高,超微结构中细胞器的改变而影响肝细胞功能。综合现有研究发现,母猪在妊娠第3阶段采食DON和ZEA不超过9.570和0.358 mg/kg的饲粮,不会引起仔猪肝脏和脾脏中毒。
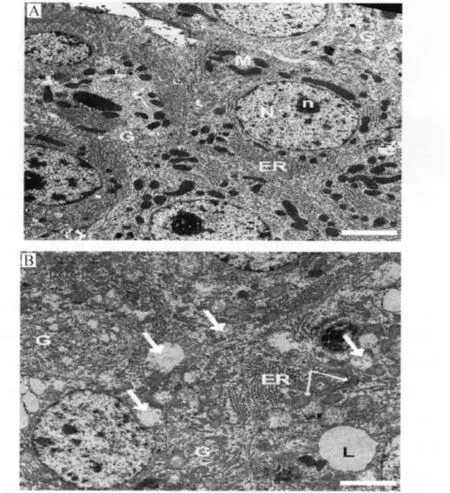
图2 透射电子显微镜扫描妊娠70 d胎儿的肝脏切片Fig.2 Transmission electron microscopy of hepatic cells from fetuses on day 70 of pregnancy
5 小 结
镰刀菌毒素DON>ZEA的饲粮通过影响5-羟色氨酸能神经递质而降低性成熟前母猪的采食量,抑制其生长发育。高浓度的镰刀菌毒素影响颗粒细胞激素的分泌和细胞增殖,干扰卵母细胞减数分裂的正常进行,而降低卵母细胞质量,影响母猪的繁殖性能;导致妊娠母猪脾脏和肝脏损伤,导致胎儿肝糖原升高和线粒体损伤而影响胎儿的生长发育;增加泌乳母猪的断奶-发情间隔时间。
[1] Burlakoti R R,Ali S,Secor G A,et al.Comparative mycotoxin profiles of Gibberella zeae populations f rom barley,wheat,potatoes,and sugar beets[J].Applied Environmental Microbiology,2008,74:6 513-6 520.
[2] Chin L J,Tan L M.Mycotoxins in feed explored[J].Feedstuffs,2005,26(11):12-13.
[3] 杨晓飞,余 冰,陈代文,等.2006年四川地区饲料原料霉菌毒素污染状况的调查报告[J].饲料工业,2007,28(13):61-64.
[4] Malekinejad H,Maas-Bakker R F,Fink-Gremmels J.Bioactivation of zearalenone by porcine hepatic biotransformation[J].Veterinary Research,2005,36:799-810.
[5] Malekinejad H,Colenbrander B,Fink-Gremmels J.Hydroxysteroid dehydrogenases in bovine and porcine granulosa cells convert zearalenone into its hydroxylated metabolites alpha-zearalenol and betazearalenol[J].Veterinary Research Communications,2006,30:445-453.
[6] Alm H,Brussow K P,Torner H,et al.Inf luence of Fusarium toxin contaminated feed on initial quality and meiotic competence of gilt oocytes[J].Reproductive Toxicology,2006,22:44-50.
[7] Edwards S,Cantley T C,Day B N.The eff ects of zearalenoneon reproduction in swine.Ⅱ.The effect on puberty attainment and postweaning rebreeding performance[J].Theriogenology,1987,28:51-58.
[8] Zwierzchowski W,Obremski K,Zielonka L,et al.The impact of zearalenone on thelevel of theselected estrogens in blood serum of sexually immature gilts[J].Polish Journal of Veterinary Sciences,2006,9:247-252.
[9] Long G G,Diekman M A.Effect of purified zearalenone on early gestation in gilts[J].Journal of Animal Science,1984,59:1 662-1 670.
[10] Goyarts T,Danicke S,Brussow K P,et al.On the transfer of the Fusarium toxins deoxynivalenol(DON)and zearalenone(ZON)f rom sows to their fetuses during days 35 to 70 of gestation[J].Toxicology Letters,2007,171:38-49.
[11] Diaz-Llano G,Smith T K.Effects of feeding grains naturally contaminated with Fusarium mycotoxins with and without a polymeric glucomannan mycotoxin adsorbent on reproductiveperf ormance and serum chemistry of pregnant gilts[J].Journal of Animal Science,2006,84:2 361-2 366.
[12] Danicke S,Brǜssow K P,Goyarts T,et al.On the transfer of the Fusarium toxins deoxynivalenol(DON)and zearalenone(ZON)f rom thesow to the full-term piglet during the last third of gestation[J].Food Chemical Toxicology,2007,45:1 565-1 574.
[13] Tiemann U,Brussow K P,Kǜchenmeister U,et al.Changes in the spleen and liver of pregnant sows and full-term piglets after f eeding diets naturally contaminated with deoxynivalenol and zearalenone[J].Veterinary Journal,2008,176:188-196.
[14] Young L G,Ping H,King G J.Ef fects of feeding zearalenone to sows on rebreeding and pregnancy[J].Journal of Animal Science,1990,68:15-20.
[15] Diaz-Llano G,Smith T K.The ef fects of feeding grains naturally contaminated with Fusarium mycotoxins with and without a polymeric glucomannan adsorbent on lactation,serum chemistry,and reproductive performance af ter weaning of first-parity lactating sows[J].Journal of Animal Science,2007,85:1 412-1 423.
[16] Prelusky D B,Trenholm H L.The efficacy of various classes of anti-emetics in preventing deoxynivalenol-induced vomiting in swine[J].Natural Toxins,1993,1:296-302.
[17] Vaca C E,Wilhelm J,Harms-Ringdahl M.Interaction of lipid peroxidation products with DNA:a review[J].Mutation Research,1988,195:137-149.
[18] Kouadio J H,Dano S D,Moukha S,et al.Eff ects of combinations of Fusarium mycotoxins on the inhibition of macromolecular synthesis,malondialdehyde levels,DNA methylation and fragmentation,and viability in caco-2 cells[J].Toxicon,2007,49:306-317.
[19] Alm H,Greising T,Brǜssow K P,et al.The influence of the mycotoxins deoxynivalenol and zearalenol on in vitro maturation of pig oocytes and in vitro culture of pig zygotes[J].Toxicology in vitro,2002,16:643-648.
[20] Fortune J E,Hansel W.Concentrations of steroids and gonadotropins in f ollicular fluid from normal heifers and heif ers primed f or superovulation[J].Biology of Reproduction,1985,32:1 069-1 079.
[21] Kuiper G G,Lemmen JG,Carlsson B,et al.Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor beta[J].Endocrinology,1998,139:4 252-4 263.
[22] Malekinejad H,Schoevers E J,Daemen I J,et al.Exposure of oocytes to the Fusarium toxins zearalenone and deoxynivalenol causes aneuploidy and abnormal embryo development in pigs[J].Biology of Reproduction,2007,77:840-847.
[23] Kipp J L,Ramirez V D.Estradiol and testosterone have opposite ef fects on microtubule polymerization[J].Neuroendocrinology,2003,77:258-272.
[24] Zwierzchowski W,Przybylowicz M,Obremski K,et al.Level of zearalenone in blood serum and lesions in ovarian follicles of sexually immature gilts in the course of zearalenone micotoxicosis[J].Polish Journal of Veterinary Sciences,2005,8:209-218.
[25] Ranzenigo G,Caloni F,Cremonesi F,et al.Ef fects of Fusarium mycotoxins on steroid production by porcine granulosa cells[J].Animal Reproduction Science,2008,107:115-130.
[26] Starzynski R R,Gralak M A,Smuda E,et al.A characterization of the activities of iron regulatory protein 1 in various f arm animal species[J].Cellular&Molecular Biology Letters,2004,9:651-664.
[27] Tiemann U,Brussow K P,Dannenberger D,et al.The effect of feeding adiet naturally contaminated with deoxynivalenol(DON)and zearalenone(ZON)on the spleen and liver of sow and fetus from day 35 to 70 of gestation[J].Toxicology Letters,2008,179:113-117.

