黄芪多糖对罗非鱼肠绒毛形态结构及肠道免疫细胞的影响
黄玉章 林 旋* 王全溪 谢建强 陈佳铭 赵 堇林树根
(1.福建农林大学动物科学学院,福州 350002;2.上海朝翔生物技术有限公司,上海 201611)
黄芪为豆科植物膜荚黄芪和内蒙古黄芪的干燥根,其味甘、性温,有补气升阳、固表止汗、托毒排脓、利水消肿和生肌等功效,为补气之要药。现代医学发现其药理作用广泛,能增强机体免疫功能、增强细胞代谢、调节DNA复制及RNA和蛋白质的合成,并具有固肾降压、保肝抗炎等功能[1]。黄芪多糖(astragalus polysaccharides,APS)是黄芪的主要活性成分之一,其具有调节免疫、抗病毒、抗肿瘤、抗衰老、抗氧化、抗辐射和抗应激作用,在临床上已经用于治疗肝炎、肿瘤等疾病[2-3]。目前,黄芪多糖作为免疫增强剂和抗病毒药物在畜牧业及水产养殖上已开始应用。
许多研究发现,黄芪多糖能促进单核巨噬细胞的功能,增强巨噬细胞的吞噬作用,提高自然杀伤细胞(NK)的活性。单核巨噬细胞系统能非特异性地吞噬侵入畜禽体内的病原体和有害异物,能将抗原提呈给T、B淋巴细胞从而参与机体的特异性免疫应答[4]。苗明三等[5]和单俊杰等[6]研究表明,黄芪多糖能增加小鼠腹腔巨噬细胞数量,显著促进小鼠腹腔巨噬细胞吞噬功能。
本试验以罗非鱼为研究对象,在罗非鱼基础饲料中分别添加不同剂量的黄芪多糖作为试验组,以不添加黄芪多糖为对照组,饲喂罗非鱼一段时间后解剖取材,应用组织化学染色方法观察各组罗非鱼肠道黏膜结构和肠道内相关免疫细胞的数量变化,探讨黄芪多糖对罗非鱼肠道免疫功能的影响。
1 材料与方法
1.1 试验设计与日粮
本试验所用的罗非鱼鱼种由福建省淡水水产研究所提供。选用体长9 cm左右、平均体重为47 g的健康罗非鱼150尾随机分为5组,每组设3个重复,每个重复10尾。试验组饲料分别在基础饲料中添加500、1 000、1 500 、2 000 mg/kg 的黄芪多糖 ,以不添加黄芪多糖的基础日粮作为对照组(0 mg/kg)。黄芪多糖由上海朝翔生物技术有限公司提供。基础日粮组成及营养水平见表1。
1.2 饲养管理
试验前罗非鱼先集中驯养2周,试验开始时,鱼体称重分组,注意将鱼的体重调整至各组间差异不显著(P>0.05),分别饲养在150 L水族箱里。试验前用金益优碘液消毒自来水1次,各组水质均为脱氯自来水,昼夜24 h用增氧机充气。采用饱食的方式,每天08:00和16:00分别饲喂和换水1次,每次换水量约为50%,每天的饲料投喂量为罗非鱼总体重的2%~4%,3 d调整1次。试验期间水温保持在27~29℃。
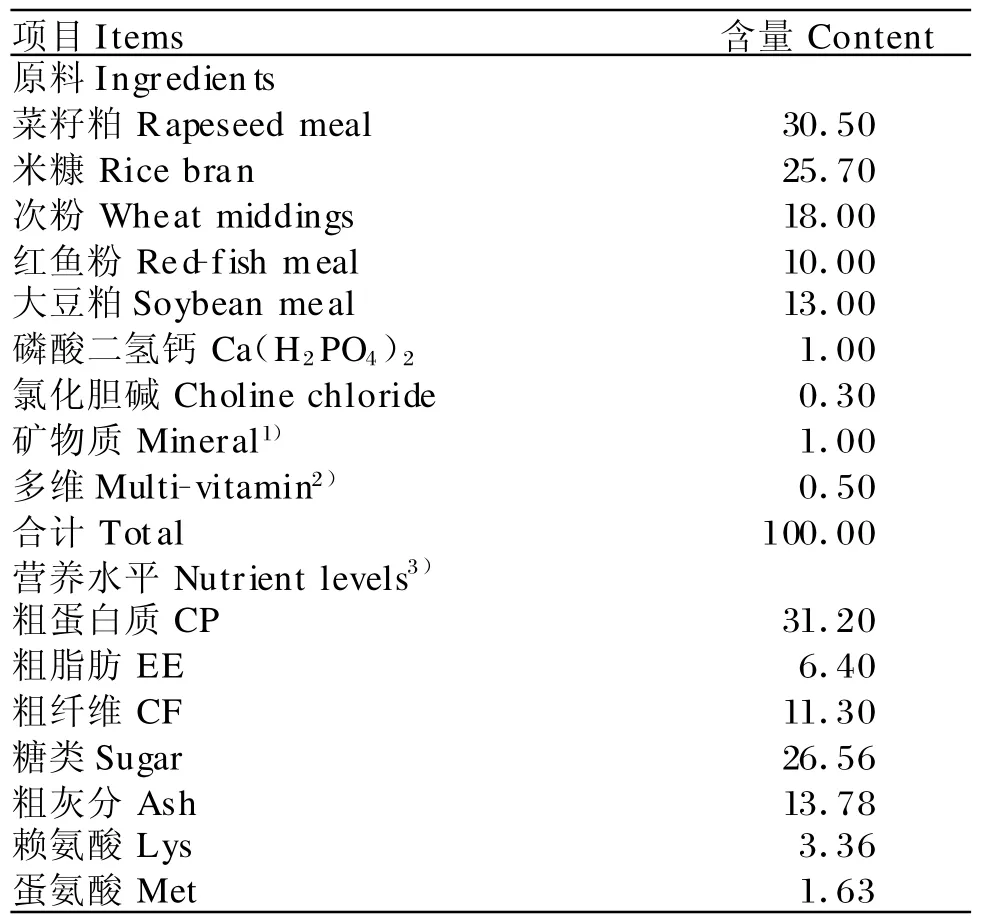
表1 基础日粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diet(air-dry basis,%)
1.3 检测指标及方法
1.3.1 取材与固定
试验进行至40 d时,对各组罗非鱼饥饿24 h后,从每组中随机抽取5尾鱼,按常规方法解剖,迅速取出罗非鱼的前肠、中肠和后肠,各肠段长度约1 cm,浸入pH 7.2~7.4的磷酸盐缓冲液洗掉内容物。Carnoy's固定液固定12~24 h,包埋并制作横断面切片。常规苏木精-伊红(HE)染色和阿利新兰-高碘酸雪夫氏(AB-PAS)染色。
1.3.2 肠绒毛的形态观察和测量
光镜下观察并应用图象分析系统(IM50),具体测量肠绒毛长度、隐窝深度和肌层厚度。每个肠管取5张染色结果较好的切片进行拍照,每张切片随机选取5根最长肠绒毛进行测量。
1.3.3 肠道免疫细胞的观察与计数
光镜下观察各组罗非鱼肠道内黏液细胞和上皮内淋巴细胞的分布与数量。
1.3.3.1 黏液细胞的计数 每个部位选择5张着色较好的AB-PAS染色切片,每张切片均在40×10倍的光镜下进行拍照观察并计数,每张切片随机抽取5根最长肠绒毛统计其中黏液细胞数量后取平均值。
1.3.3.2 上皮内淋巴细胞的计数 每个部位选择5张着色较好的HE染色切片,每张切片均在40×10倍的光镜下进行拍照观察并计数,取每根肠管横切面,选5根最长且排列整齐的肠绒毛,至少计算位于肠绒毛根部以上的上皮内淋巴细胞核,所有单核的非上皮细胞被认为是上皮内淋巴细胞,统计每l00个肠绒毛上皮柱状细胞间上皮内淋巴细胞的数量。
1.4 数据处理
应用SPSS 11.0统计软件的单因素方差分析进行生物学统计,各组间的差异显著性采用两组间独立样本双尾T检验分析,结果用平均值±标准差表示。
2 结果与分析
2.1 黄芪多糖对罗非鱼肠绒毛长度、隐窝深度、肌层厚度的影响
2.1.1 罗非鱼肠绒毛长度的变化
由表2可知,各试验组前肠、中肠和后肠的肠绒毛长度均比对照组长,且随添加量的增加呈现先增加后降低的趋势。其中,前肠肠绒毛长度:1 000和1 500 mg/kg组比对照组分别增加了 36.62%和60.87%,差异极显著(P<0.01),2 000 mg/kg组比对照组增加了16.69%,差异显著(P<0.05);中肠肠绒毛长度:1 000 mg/kg组比对照组增加了25.96%,差异显著(P<0.05),1 500 mg/kg组比对照组增加了59.58%,差异极显著(P<0.01);后肠肠绒毛长度:1 000和1 500 mg/kg组相对于对照组增加了38.48%和 63.56%,差异极显著(P<0.01)。其余各组各肠段肠绒毛长度均与对照组差异不显著(P>0.05)。此外,在同一组中,罗非鱼肠绒毛长度从前肠、中肠到后肠逐步降低,前肠肠绒毛长度最长,中肠次之,后肠最短。
2.1.2 罗非鱼肠绒毛隐窝深度的变化
由表2可知,各试验组前肠、中肠和后肠的隐窝深度均比对照组深,且随添加量的增加呈现先增加后降低的趋势。其中,前肠和中肠隐窝深度:与对照组相比,1 500 mg/kg组极显著增加(P<0.01);1 000 mg/kg组显著增加(P<0.05);后肠隐窝深度:1 000和1 500 mg/kg组分别比对照组增加了23.35%和32.01%,差异显著(P<0.05)。其余各组各肠段肠绒毛隐窝深度均与对照组差异不显著(P>0.05)。此外,在同一组中,罗非鱼肠绒毛隐窝深度变化与绒毛长度一样由前肠、中肠到后肠逐步降低。
2.1.3 罗非鱼肠绒毛肌层厚度的变化
由表2可知,各试验组前肠、中肠和后肠的肌层厚度比对照组均有所增加,且随添加量的增加呈现先增加后降低的趋势。其中,前肠肌层厚度:各试验组与对照组相比均差异不显著(P>0.05);中肠肌层厚度:1 500 mg/kg组比对照组增加了36.43%,差异极显著(P<0.01);1 000 mg/kg组比对照组增加了26.22%,差异显著(P<0.05);后肠肌层厚度:1 000和1 500 mg/kg组分别比对照组增加了37.81%和45.36%,差异极显著(P<0.01)。其余各组各肠段肠绒毛肌层厚度均与对照组差异不显著(P>0.05)。另外,在同一组中,罗非鱼肠绒毛肌层厚度中肠最大,后肠次之,前肠最小。
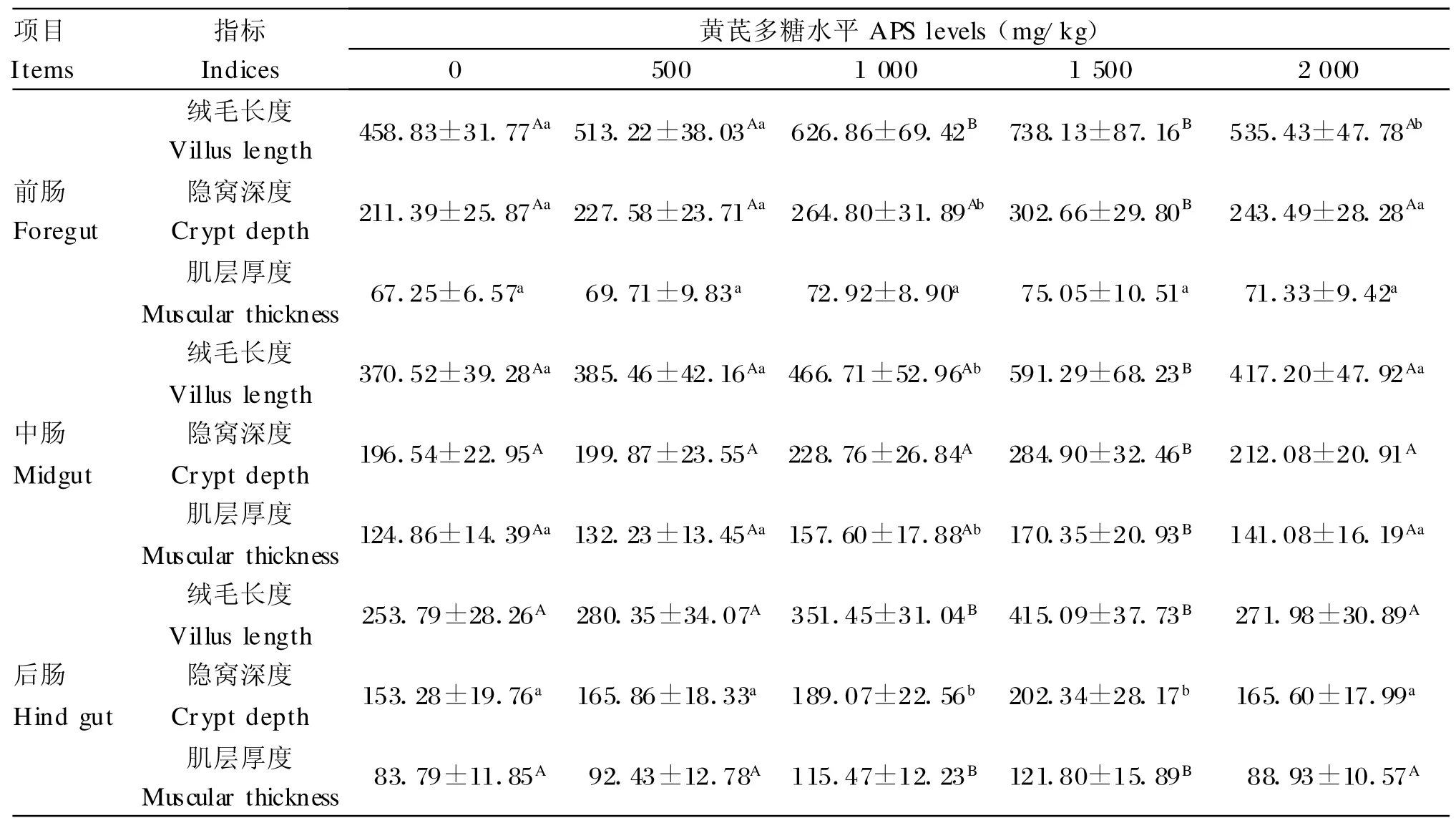
表2 罗非鱼肠绒毛组织形态变化Table 2 Morphological changes of villus intestinal of tilapia (μ m)
2.1.4 罗非鱼肠道黏膜的形态结构显微观察
肠黏膜层结构特点是有环形皱襞、肠绒毛和小肠腺,肠黏膜是肠道屏障的重要组成部分,它包括黏膜上皮、上皮之间的连接结构、上皮的基膜、细胞表面的细胞衣。在显微镜下观察,各组罗非鱼肠黏膜形态结构都较为完整,层次分明,肠黏膜上皮细胞的轮廓清晰,染色鲜明,排列规则,2 000 mg/kg组肠绒毛顶端有稍微脱落的现象,但不严重。(见图版1~5)
2.2 黄芪多糖对罗非鱼肠道内黏液细胞分布及数量的影响
2.2.1 罗非鱼肠道内黏液细胞的分布情况
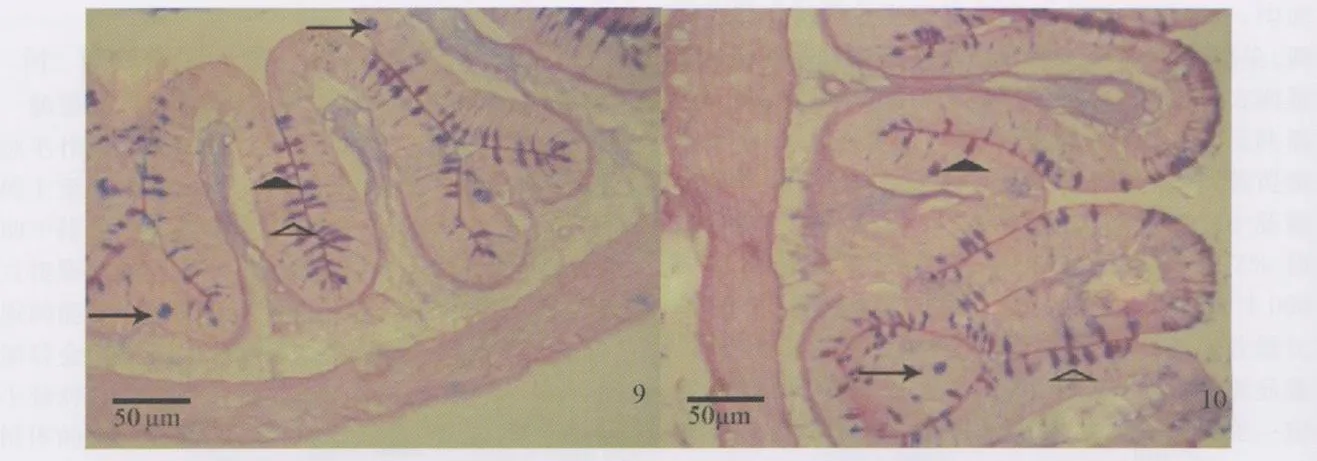
罗非鱼肠道组织经AB-PAS染色后,显微镜下观察黏液细胞呈红色、蓝色、紫红色和蓝紫色。肠道各段上皮均有黏液细胞分布,黏液细胞主要有囊状、梨状和杯状3种形态。罗非鱼黏液细胞以成熟期的杯状细胞为主,少量为囊状细胞和梨状细胞。杯状细胞散在分布于柱状细胞之间,呈高脚杯状,其顶部胞质为大量糖原颗粒拥塞而膨隆,底部纤细,有小而深染的不规则核与少量嗜碱性胞质。杯状细胞排列紧密,靠近绒毛顶端的杯状细胞呈散在分布,不同的肠段杯状细胞的数量有所不同。(见图版6~10)
2.2.2 罗非鱼肠道内黏液细胞的数量变化
由表3可以看出,各试验组罗非鱼肠道内黏液细胞数量均比对照组有所增加,且随添加量的增加呈现先增加后降低的趋势。其中,前肠和中肠内黏液细胞数量:与对照组相比,1 000和1 500 mg/kg组显著增加(P<0.05),500和2 000 mg/kg组无显著变化(P>0.05);后肠内黏液细胞数量:1 000和1 500 mg/kg组比对照组分别增加了 30.82%和47.17%,差异极显著(P<0.01),2 000 mg/kg组比对照组增加了 23.90%,差异显著(P<0.05),500 mg/kg组比对照组只增加了5.66%,差异不显著(P>0.05)。此外,在同一组的不同肠段中,罗非鱼肠道内黏液细胞的数量顺序为中肠>后肠>前肠。

表3 罗非鱼肠道内黏液细胞数量变化Table 3 Quantity changes of mucous cells in intestinal of tilapia (个)
2.3 黄芪多糖对罗非鱼肠道上皮内淋巴细胞分布及数量的影响
2.3.1 罗非鱼肠道上皮内淋巴细胞的分布情况
罗非鱼肠道组织经HE染色后,显微镜下观察上皮内淋巴细胞为散在分布于肠绒毛上皮细胞内一群特殊淋巴细胞,多数位于上皮细胞基膜附近,少量见于上皮游离面。胞核大而圆,深染,胞浆少,固有层亦有淋巴细胞分布。不同的肠段和不同的试验组,数量有差异,但形态差异不明显。(见图版1~5)
2.3.2 罗非鱼肠道上皮内淋巴细胞的数量变化
由表4可以看出,各试验组罗非鱼肠道上皮内淋巴细胞数量均多于对照组,且随添加量的增加呈现先增加后降低的趋势。其中,前肠上皮内淋巴细胞数量:各试验组虽比对照组有所增加但差异均不显著(P>0.05);中肠上皮内淋巴细胞数量:1 000和1 500 mg/kg组比对照组分别增加了10.55%和13.17%,差异极显著(P<0.01),2 000 mg/kg组比对照组增加了 8.72%,差异显著(P<0.05),500 mg/kg组比对照组只增加了3.67%,差异不显著(P>0.05);后肠上皮内淋巴细胞数量:1 000 mg/kg组比对照组增加了5.52%,差异显著(P<0.05),1 500 mg/kg组比对照组增加了10.67%,差异极显著(P<0.01),其余组与对照组差异不显著(P>0.05)。此外,同一组不同肠段上皮内淋巴细胞数量中肠最多,后肠次之,前肠最少。
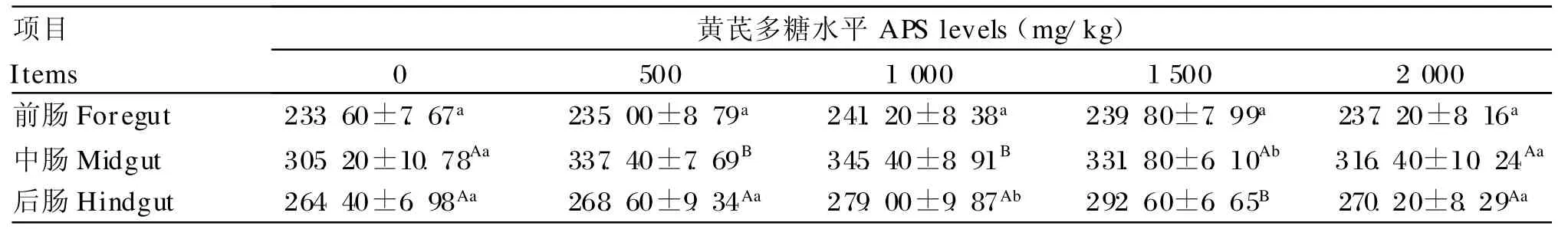
表4 罗非鱼肠道上皮内淋巴细胞数量变化Table 4 Quantity changes of lymphocyte in intestinal epithelial of tilapia (个)
3 讨 论
肠道是机体消化、吸收营养物质的重要场所,而肠绒毛作为小肠的重要组成部分,不但在吸收营养物质上至关重要,而且其强有力的、有规律的摆动也有助于排斥有害菌群的定植,同时,绒毛形态的变化也直接影响绒毛的表面积,进而影响机体吸收营养物质的能力[7]。Caspary等[8]报道指出肠绒毛长度增加后会使小肠接触营养物质的面积增大,从而增强小肠对营养物质的吸收,所以肠绒毛的形态直接和机体的生长发育有关。隐窝深度反映了隐窝细胞的增殖率和成熟度。隐窝细胞从底部向绒毛上部迁移,在迁移过程中,细胞逐渐分化,形成具有吸收能力的柱状细胞,肠绒毛高度与细胞数量呈显著相关。绒毛短时,成熟的绒毛细胞减少,对养分的吸收能力低。而隐窝深度反映了细胞生成率,不断有细胞从隐窝基部向绒毛端部迁移、分化,形成具有吸收能力的绒毛细胞,以补充绒毛上皮的正常脱落。如果此过程减慢,则基部的细胞生成率降低,使隐窝变浅。而绒毛长度/隐窝深度比值(V/C值)综合反映小肠的功能状况,比值下降,表示黏膜受损,消化吸收功能降低,动物生长发育受阻[9-10]。本试验研究结果表明,添加不同水平黄芪多糖的试验组肠绒毛长度、隐窝深度和肌层厚度相比于对照组都有一定程度的增加,其中以添加量为1 000和1 500mg/kg的2个试验组增加效果较好,从而得出在饲料中添加黄芪多糖可以在一定程度上增加小肠绒毛的表面积,从而有助于罗非鱼机体对营养物质的吸收。
对鱼类黏液细胞的研究国内外已有大量的报道[11],鱼类黏液细胞广泛分布于鱼类体表、鳃和消化道等部位,分泌的黏液中含有多种有机物质,如粘多糖、糖蛋白、免疫球蛋白及各种水解性酶类,对鱼类的许多生理功能有重要影响。黏液细胞所分泌的黏液中具有抵抗病原微生物入侵的非特异性的免疫化学反应物质,这些物质包括溶菌酶、转移因子、C-反应蛋白、几丁质、Ⅰ型干扰素及补体类物质等。它们有的可以杀灭细菌(如溶菌酶),有的可抑制病毒的复制(如干扰素),有的可作为调理素增加吞噬量(如C-反应蛋白)。此外,黏液中还具有同血液相似的血清学反应,免疫电泳分析也证明了黏液中含有免疫球蛋白,并且这种免疫球蛋白同血清免疫球蛋白具有一定的相似性。黏液细胞分泌的黏液物质中具有多种化学成分,因而黏液物质也具有不同的功能。杯状细胞是一种典型的黏液细胞,主要分布于消化道和呼吸道等器官内的上皮中,杯状细胞作为肠道黏膜免疫相关细胞的重要组成部分,构成肠道黏膜免疫系统的第一道防御屏障,在抗感染、调节上皮细胞的完整性和外来抗原的免疫应答方面起重要作用,其数量的变化可以在一定程度上反映消化道的局部免疫状况[12]。本试验结果表明,黄芪添加量为1 000和1 500 mg/kg的2个试验组中肠黏液细胞数量比对照组分别增加了17.97%和21.48%,差异显著(P<0.05);黄芪添加量为1 000和1 500 mg/kg的2个试验组后肠黏液细胞数量比对照组分别增加了30.82%和47.17%,差异极显著(P<0.01)。表明在饲料添加适量黄芪多糖在一定的程度能够促进肠道黏液细胞的增殖。
作为一种特殊的淋巴细胞群体,肠上皮内淋巴细胞长期与肠道菌群、病原体等接触,在黏膜抗感染免疫、调节上皮细胞的完整性和调节外来抗原的免疫应答方面起重要作用[13]。肠道相关淋巴组织分为组织性淋巴样组织及散在于整个肠壁中的淋巴细胞。上皮内淋巴细胞是黏膜免疫系统中最先接触抗原的免疫活性细胞,在肠道黏膜中起重要的免疫屏障作用[14]。肠上皮内淋巴细胞作为肠道相关淋巴组织中的一个特殊组分,是机体免疫系统中与外来抗原以及微生物最先接触的免疫细胞,同时也是最先发生免疫反应的细胞。因此小肠上皮内淋巴细胞的数量可以反映小肠局部黏膜免疫屏障的完整及免疫防御功能的完善程度[15]。另据研究表明,黄芪多糖可提高雏鸡T淋巴细胞的转化率,加速细胞免疫功能的发育与完善[16],促进浆细胞增生和抗体合成[17]。本试验结果表明,添加不同水平黄芪多糖的各试验组肠绒毛长度、隐窝深度和肌层厚度相比于对照组都有一定程度的增加,而且肠道黏液细胞和上皮内淋巴细胞的数量比对照组也有明显的增多,其中以添加量为1 000和1500 mg/kg的2个试验组效果最好。这表明饲料中添加黄芪多糖可以提高罗非鱼机体的特异性免疫功能。此外本试验还发现各组罗非鱼不同肠段黏液细胞和上皮内淋巴细胞的数量分布也明显不同,这和王子旭[18]对肉鸡肠黏膜结构的研究结果相似。这可能与肠道不同部位所接触病原微生物及食物抗原的种类和数量不同有关。
4 结 论
日粮中添加黄芪多糖可提高罗非鱼肠绒毛长度、隐窝深度和肌层厚度,增加肠道黏液细胞和上皮内淋巴细胞的数量,且以1 000和1 500 mg/kg添加量效果较好。
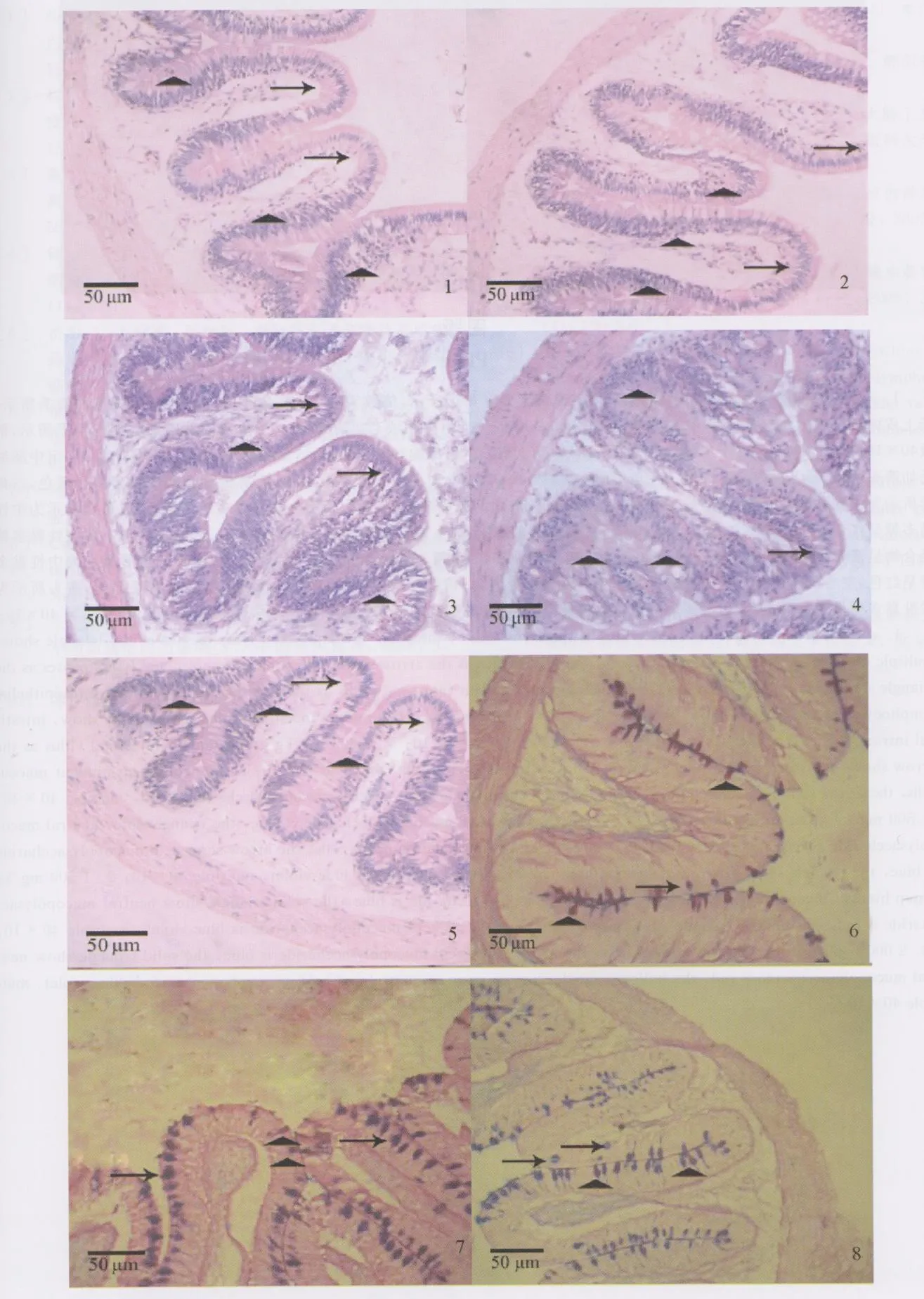
图版Plate
[1] 胡庭俊,梁纪兰,程富胜.黄芪对小鼠脾淋巴细胞蛋白激酶C活性的影响[J].中兽医医药杂志,2003,2:11-12.
[2] 程志斌,葛长荣,韩剑众.中草药有效成分对动物免疫功能的影响及其应用[J].河北畜牧兽医,2000,18(10):16-17.
[3] 陈 光,戚文臣,刘显清.黄芪多糖对动物肿瘤细胞凋亡影响的研究[J].中医药学报,2002,30(4):55-56.
[4] 储岳峰,颜新敏,胡元亮.几种中药成分的免疫增强活性及其作用效果[J].中国兽医科技,2005,35(1):67-70.
[5] 苗明三,方晓艳,孙艳缸.当归补血汤多糖及其单味药多糖对正常小鼠免疫功能的影响[J].中药药理与临床,2003,19(4):7.
[6] 单俊杰,王 易,翁颖琦.黄芪毛状根与黄芪多糖化学组成和免疫活性的比较[J].中草药,2002,33(12):1 096-1 099.
[7] 马仲华.家畜解剖及组织胚胎学[M].北京:中国农业出版社,2002.
[8] Caspary W F.Physiology and pathophysio1ogy of intestinal absorption[J].American Journal of Clinical Nutrition,1992,55:299-308.
[9] 王子旭,余锐萍,陈 越,等.日粮锌硒水平对肉鸡小肠黏膜结构的影响[J].中国兽医科技,2003,33(7):18-21.
[10] 韩正康.家畜营养生理学[M].北京:农业出版社,1991:16-17.
[11] 杨桂文,安利国.鱼类黏液细胞研究进展[J].水产学报,1999,23(4):403-408.
[12] 史玉兰,段相林.杯状细胞的研究进展[J].解剖科学进展,2001,7(4):358-341.
[13] 赵太平,徐玉东,魏 岚,等.大鼠小肠、大肠上皮及固有层淋巴细胞的分布差异[J].哈尔滨医科大学学报,2004,38(1):42-44.
[14] 李霄凌,李公启,徐玉东.免疫大鼠肠道上皮内淋巴细胞的实验研究[J].齐齐哈尔医学院学报,2005,26(3):241-242.
[15] 王继风,陈耀星,王子旭.丁酸钠对断奶仔猪小肠黏膜形态结构的影响[J].中国兽医科技,2005,35(4):298-301.
[16] Kong X,Hu Y,Rui R,et al.Effects of Chinese herbal medicinal ingredients on peripheral lymphocyte proliferation andserum antibody titer after vaccination in chicken[J].International Immunopharmacology,2004,4(7):975-982.
[17] Guo F C,Kwakkel R P,Williams B A,et al.Effects of mushroom and herb polysaccharides on cellular and humoral immne response of Eim eria tenella-infected chickens[J].Poultry Science,2004,83(7):1 124-1 132.
[18] 王子旭.锌硒互作对肉鸡肠黏膜形态结构及黏膜免疫相关细胞影响的研究[D].硕士学位论文.北京:中国农业大学,2003.

