仔猪肠道健康的生物学机制及调控技术研究与应用
印遇龙 李铁军 吴 信 徐海军
(湖南省畜禽健康养殖工程技术中心,中国科学院亚热带农业生态研究所,长沙410125)
肠道既是动物消化食物、吸收营养的主要场所,也是体内最大的免疫器官。然而,由于断奶后仔猪面临饲料和环境等各种外界因素的应激,使得仔猪常常出现食欲差、消化功能紊乱,从而导致肠道屏障受损,肠绒毛萎缩,隐窝深度加大,进而出现腹泻和生长缓慢的现象。断奶应激是造成肠道受损的主要原因,同时也是实施早期断奶的最大技术障碍[1-3]。目前,通过研究揭示仔猪肠道的发育规律,并通过维持仔猪肠道健康来缓解仔猪断奶应激造成的负面影响,已成为现代营养学研究的热点之一。
1 传统营养学对断奶仔猪消化生理特点的研究
仔猪的肠道消化在断奶前,其营养全部或部分由母乳提供,猪母乳中含有丰富的脂肪和易于消化的酪蛋白;断奶后仔猪的营养来源从液体饲料转成固体饲料,仔猪消化道酶系统和生理环境等均不适应,其结果表现在临床上为断奶仔猪采食量和饲料利用率降低,消化不良和引起腹泻的发生。影响早期断奶仔猪生产性能的主要因素有:1)胃酸分泌不足,消化酶分泌不足,小肠吸收功能减弱,肠道绒毛萎缩和隐窝增生;2)不能从母乳中得到有益因子,饲料采食量下降,水摄入量不足以及日粮蛋白质的抗原性,这些都会对仔猪肠道带来损伤[4]。
仔猪因肠道内尚未建立稳定的微生态系统,自身抵抗力较低,对外界刺激敏感,易受各种病原微生物的侵袭和各种应激因素的影响。哺乳仔猪以传染性腹泻较为常见,而保育仔猪以日粮抗原过敏、断奶、饲料突然更换和应激等非传染性因素引起的腹泻为主。仔猪腹泻的发病机制十分复杂,单一因素、复合因素都可促使发病。在所有的应激源之中,营养应激是最主要的[4]。
肠道形态学的变化(绒毛高度和陷窝深度)是引起功能上的改变和肠道吸收机能降低的主要原因[5-6],仔猪在应激条件下会产生过敏反应,使得肠细胞有丝分裂速度加快,隐窝深度增加[2-3]。当肠细胞向绒毛的迁移速度加快后,顶端肠细胞的脱落速度增快,成熟肠细胞损失加剧。由于它们的吸收和消化能力都较高,成熟细胞数量的减少会导致酶活性和吸收能力下降。这些变化与肠道营养物质周转速度加快和消化不良密切相关,而且很可能使小肠对病原微生物(如大肠杆菌)的敏感性提高,进而导致肠道组织的进一步损伤。
2 现代营养学对肠道健康的研究
2.1 利用基因组学、蛋白质组学和代谢组学技术手段研究仔猪肠道功能发育与调控
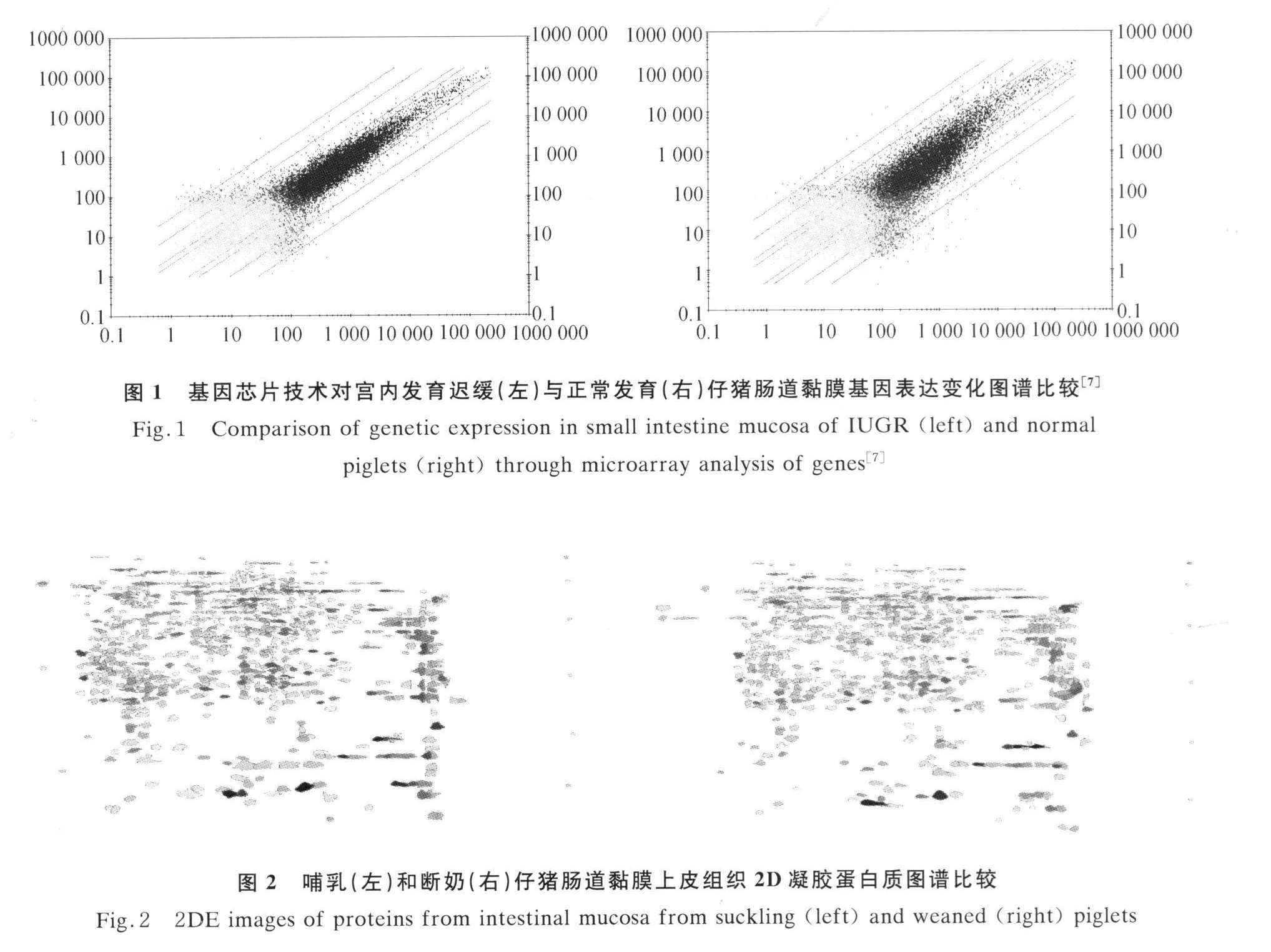
Wang等[8]、Chen等[7]和Wang等[9]将基因组学和蛋白质组学等技术应用于仔猪研究,利用猪的全基因组芯片技术研究了宫内发育迟缓(intrauterine growth retardation,IUGR)与正常发育仔猪肠道黏膜基因表达变化(图1),检测了4万多个基因的表达变化情况,同时利用蛋白质组学技术研究了哺乳和断奶仔猪肠道黏膜上皮组织蛋白变化(图2),分析了组织中数千个蛋白质的水平高低[7]。结果表明断奶引发了与氧化应激和免疫激活相关的21个基因(谷胱甘肽转移酶ω-1、HMG-CoA合成酶、细胞色素 P450、角鲨烯环氧化酶、溶菌酶、nudix水解酶-5、免疫球蛋白受体前体、Igα-链C、Ig J-链、Igκ-链 C、Igλ-链、水通道蛋白 8、N-乙酰氨基葡萄糖转移酶、半乳糖苷2-α-L-岩藻苷转移酶、二磷酸甲羟戊酸脱羧酶、3-β-羟基类固醇-δ8-δ7-异构酶、C-4甲基固醇氧化酶、C-4甲基固醇氧化酶-2、纤溶酶原激活子诱导的c54、法呢基焦磷酸合酶以及septin 5)表达上调及与营养代谢和细胞增殖相关的18个基因(乙酰-CoA脱氢酶、N-乙酰-D-葡萄糖胺异构酶2、ADP-核糖基化因子GTP酶激活蛋白I、氨基肽酶A、泛素羧基端水解酶、组织蛋白酶F、阿朴脂蛋白A-Ⅳ、肉碱转运子2、脂肪酸结合蛋白、甾醇结合蛋白相关蛋白10、钠和氯离子依赖的肌氨酸转运子Ⅰ、DNA结合蛋白抑制子ID-2、腺苷酸环化酶、IGF-Ⅱ、白细胞抗原相关蛋白、前甘丙肽原、生长激素抑制素和vanin-1)表达下降。同时,断奶引起DNA结合蛋白抑制子ID-2(-81%)、IGF-Ⅱ(-77%)、泛素羧基端水解酶 FAF-Y(-92%)、生长激素抑制素(-83%)和 vanin(-87%)表达量的下降,以及谷胱甘肽转移酶ω-1(+215%)、HMG-CoA 合成酶(+63%)、水通道蛋白8(+315%)和溶菌酶(+278%)表达的上调。
本课题组基于NMR的代谢组学方法研究了日粮添加精氨酸对猪血清代谢组的调控作用(图3)[10-11],为研究营养素对动物机体的作用提供的新的研究途径,所得数据也与生物的表型或整体状况的距离最近,是生物学现象的最直接表现[10]。研究结果表明,精氨酸可显著调控猪血清代谢组学特征。胴体系数表明,日粮中添加精氨酸能减少机体的脂肪沉积和增加蛋白质合成。血清代谢物的主要成分分析表明,与对照组相比,精氨酸添加降低了血清低密度脂蛋白、极低密度脂蛋白和尿素的浓度,提高了肌酐、三羧酸循环代谢物、丙氨酸、鸟氨酸、赖氨酸和酪氨酸的浓度(图3)。另外,精氨酸添加影响了甘油磷酸胆碱和肌醇等脂蛋白信号分子和甲酸、乙醇、甲胺、二甲胺、乙酸和丙酸等胃肠道菌群代谢物。这些新的发现表明,日粮中添加1%精氨酸能影响机体内的脂肪和氨基酸代谢,增强骨骼肌的蛋白质合成和调控胃肠道菌群的代谢。
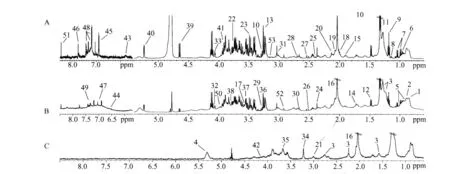
图3 核磁共振技术测定的仔猪血清样品中600 MHz 1H NMR CPMG(A)、NOESY(B)和DPP-LED(C)的图谱Fig.3 Typical 600 MHz 1H NMR CPMG(A),NOESY(B)and DPP-LED(C)spectrum of serum taken from asuckled piglet
2.2 仔猪哺乳期肠道黏膜发育变化规律
哺乳仔猪肠道黏膜发育状况对早期断奶仔猪的营养吸收和肠道健康至关重要。研究发现哺乳仔猪肠绒毛高度和隐窝深度变化范围及其发育规律,即肠绒毛高度在空肠前段、空肠后段和回肠末端分别为154.78~235.45 mm、142.67~279.82 mm、177.22~277.60 mm,其发育趋势表现为空肠前段、空肠后段和回肠末端分别呈二次方曲线、四次方曲线和线性变化;隐窝深度在空肠前段、空肠后段和回肠末端分别为 100.21~167.87 mm、97.37~201.90 mm 、101.64~195.35 mm,其发育趋势表现为空肠前段、空肠后段和回肠末端分别呈二次方曲线、线性和二次方曲线变化。这些发现为我们研究营养素对肠道发育的影响提供了重要参照指标[12]。
2.3 哺乳仔猪肠道功能性基因发育变化规律
通过克隆猪肠道氨基酸转运载体ASCT2、B0、b0+AT和y+LAT1,以及小肽转运载体Pep T1的cDNA编码区,并在发现Pep T1 cDNA长度为2 127 bp,预测蛋白质编码708个氨基酸,二级结构具有典型的膜蛋白结构,包括13个跨膜结构域,其中第10和11跨膜结构间存在一个大的胞外环;氨基酸的主要转运载体y+LAT1和b0+AT的cDNA长度分别为1 536和1 464 bp,预测蛋白质编码分别为511和487个氨基酸,二级结构均包括12个跨膜结构域。通过对氨基酸转运载体的研究,为进一步利用营养素调节载体表达奠定了试验基础[13]。
通过研究碱性磷酸酶(肠黏膜上的标志酶,可反映肠道的发育情况及肠上皮细胞的吸收能力)在肠道的分布,表明仔猪不同哺乳日龄和肠道部位碱性磷酸酶及功能性基因mRNA表达变化规律,即在空肠前段碱性磷酸酶、中性氨基酸转运载体ASCT1、碱性氨基酸转运载体CAT1和小肽转运载体Pep T1基因mRNA表达量发育趋势呈四次方曲线变化,在空肠后段碱性磷酸酶和中性氨基酸转运载体ASCT1分别呈线性和二次方曲线变化,在回肠末端碱性磷酸酶、中性氨基酸转运载体ASCT1、碱性氨基酸转运载体CAT1、酸性氨基酸转运载体EAAC1和小肽转运载体Pept1的发育趋势分别呈二次方曲线、线性、四次曲线、三次曲线和二次曲线变化。这些结果的发现从分子水平上揭示了仔猪肠道氨基酸和肽的转运和吸收机制[12]。
2.3 仔猪断奶应激造成肠道结构与功能变化的分子机制
本实验室通过研究发现,早期断奶应激显著改变调控肠道代谢功能关键基因的表达,其中与氧化应激和免疫激活相关的21个基因表达上调(52%~346%),与大分子营养代谢和细胞增殖相关的18个基因表达下降(35%~77%)[7]。近年来,应激蛋白70(HSP70)已成为研究外部应激对肠道影响的一个重要指标,通过试验研究,发现HSP70主要在肠道黏膜表层表达,对维持肠道黏膜结构和功能的完整性起着重要作用。断奶应激使肠道HSP70含量迅速增加。另外,利用大肠杆菌脂多糖(LPS)建立了仔猪断奶应激引起肠道损伤的模型,断奶应激刺激仔猪肠道炎性介质(如 IL-1β、IL-6、TNF-α等炎性细胞因子)的过量表达,引起肠黏膜上皮细胞增殖/凋亡的动态平衡紊乱,从而导致肠道结构和功能严重受损[14]。
2.4 宫内发育迟缓影响新生仔猪小肠功能的分子机制
IUGR是家畜生产中的主要问题之一。利用基因芯片技术发现IUGR仔猪空肠中306个基因上调(变化倍数≥2),271个基因下调(变化倍数≥2);利用蛋白质组学技术发现IUGR降低了调控免疫功能(免疫球蛋白、膜联蛋白AⅠ)、氧化防御(过氧化物酶1、转铁蛋白、z-晶体蛋白)、中间代谢(肌酸激酶、乙醇脱氢酶、L-乳酸脱氢酶、前列腺素 F合酶、载脂蛋白AⅠ、儿茶酚甲基转移酶、磷酸甘油酸酯激酶)、蛋白质合成(真核生物翻译起始因子-3)和组织生长(β-肌动蛋白、结合蛋白、角蛋白10)等组织特异蛋白的水平,增加了与蛋白质水解(蛋白酶α-5与 α-1亚基)、氧化应激(清道夫受体蛋白、α-1酸性糖蛋白)和ATP水解(F1-ATP酶)有关蛋白质的水平。上述发现表明,细胞信号转导异常、氧化还原失衡、蛋白质合成减少以及蛋白质水解增加都是影响子宫发育迟缓仔猪营养物质吸收代谢紊乱以及小肠生长发育受阻的主要机制[15]。
3 功能性氨基酸和植物提取物对肠道健康的影响作用
精氨酸可有效促进仔猪肠道发育[16],促进蛋白质的合成[17],显著促进血管内皮生长因子在肠道中的表达[16-17],谷氨酰胺可增加与细胞生长及清除氧化物相关的基因表达,减少与氧化应激和免疫激活相关的基因表达,药用植物提取物可通过提高仔猪内源性精氨酸的合成促进肠道健康。建立了以精氨酸家族及其代谢物(N-氨甲酰谷氨酸、α-酮戊二酸、精胺)、植物提取物和过氧化物酶体增殖物活化受体γ(PPARγ)为基础的关键调控技术体系。
3.1 精氨酸家族及其代谢物(N-氨甲酰谷氨酸、α-酮戊二酸、精胺)对缓解仔猪断奶应激的作用
细胞中HSP70对维持肠道黏膜结构和功能的完整性起着重要作用,精氨酸和N-氨甲酰谷氨酸(NCG)均通过 NO-HSP70途径,提高HSP70表达量,且NCG可以有效维持断奶仔猪肠道黏膜结构完整性,缓解仔猪断奶应激的作用[18],而精氨酸可通过PPARγ信号途径发挥缓解肠道损伤的作用,通过激活PPARγmRNA的表达而缓解LPS刺激导致的肠道炎性细胞因子的过量产生,从而缓解肠道损伤[19]。α-酮戊二酸能够促进仔猪生长,有效缓解LPS慢性免疫应激引起的仔猪生产性能的下降,抑制LPS刺激引起的空肠黏膜蛋白合成的减少和抗氧化能力的降低,维持肠道屏障完整性[20]。精胺可提高断奶仔猪小肠绒毛高度和空肠麦芽糖酶活性,降低隐窝深度,使小肠形态结构与吸收功能得到改善,其作用效果具有后续性。日粮中添加1%的精氨酸可以显著促进血管生长(血管内皮生长因子在十二指肠,空肠和回肠中的表达分别提高25%、30%和35%)和肠道的发育,日增重提高 18.5%,饲料转化率提高12.8%[21]。给哺乳仔猪灌服NCG,其血浆精氨酸浓度分别增加了68%和32%。在断奶仔猪饲料中添加0.08%的NCG,平均日采食量提高20%;平均日增重提高19%,腹泻率由15.8%下降为2.9%[22]。
3.2 谷氨酰胺调控仔猪断奶应激的作用机制
肠道谷氨酰胺供应不足,导致不能及时合成所需的谷胱甘肽,使肠道细胞氧化状态恶化,处于应激和免疫激活状态,生长增殖受限[23-24]。本项目发现,谷氨酰胺增加了细胞生长及清除氧化物相关的6个基因(羊水因子-9、信号识别粒子、亚铁血红素结合蛋白、内源性苯甲二氮、IL-13R-α-1和肌浆球蛋白)的表达,而减少了氧化应激和免疫激活相关的8个基因(TGFβ诱导的早期生长反应蛋白Ⅰ、酪蛋白激酶、胞间粘附分子、la蛋白、MAPK-6、肽基脯氨酰异构酶、Rho相关的GTP结合蛋白和mRNA剪切复合体蛋白Ⅱ)的表达。添加谷氨酰胺下调了酪蛋白激酶I(-34%)、MAPK-6(-67%)和 TGF β诱导的早期生长反应蛋白I(-51%)等基因的表达。在日粮中添加1%谷氨酰胺可增加细胞生长和氧化剂移除必需基因的表达(120%~124%),降低氧化应激和免疫激活促进基因的表达(34%~75%);增强断奶仔猪肠道的氧化防御能力(血清中的谷胱甘肽浓度增加29%),防止空肠黏膜萎缩(空肠绒毛高度增加38%),提高仔猪小肠重量12%,体重增加19%,断奶后第2周饲料转化率增加25%[8]。
3.3 药用植物提取物通过提高仔猪内源性精氨酸的合成促进肠道健康
药用植物提取物通过提高仔猪体内内源性精氨酸的合成促进肠道的健康。药用植物超微粉显著提高血清氨基酸浓度10%~50%(精氨酸浓度提高9.9%~22.0%),显著提高氨基酸消化率10%~15%(精氨酸消化率提高7.9%~9.4%);刺五加提取物显著提高血清氨基酸浓度15.3%~80.8%(精氨酸浓度提高20%~31%),显著提高氨基酸消化率4.1%~30.8%(精氨酸消化率提高15%~31%)[25]。
本实验室研究结果表明,药用植物超微粉能极显著提高断奶仔猪全期平均日增重(18.77%),显著降低料重比(11.49%),腹泻率降低 14.65%~23.33%,显著提高淋巴细胞百分率12.8%~26.7%、淋巴细胞增殖活性4.6%~12.6%;刺五加提取物能极显著提高断奶仔猪全期平均日增重(12.92%),显著降低全期料重比(18.89%),显著降低腹泻率24.55%~27.35%,显著提高淋巴细胞百分率13.2%~17.9%、淋巴细胞增殖活性5.7%~12.8%。该类植物提取物抗断奶应激效果优于抗生素或与其相当,可有效替代抗生素用于防止仔猪断奶应激。其抗断奶应激效果优于抗生素或与其相当,可有效替代抗生素用于防止仔猪断奶应激[26-27]。
4 促进仔猪肠道健康及替代抗生素和激素的系列功能性产品的研发与应用
针对仔猪的生理特点,本实验室开发出精氨酸生素、乳化脂肪、乳猪诱食剂、断奶整肠剂、大米蛋白粉、大米糖浆、药用植物复方、药用植物超微粉和刺五加提取物等调控剂,并研制生产出高效、安全、低成本的乳猪料系列产品[28-31]。
4.1 仔猪料系列产品特点
(1)具有高度生物安全性:通过添加肠道上皮细胞营养调节剂(精氨酸、精氨酸生素、谷氨酰胺等),并与大米蛋白粉、大米糖浆、乳清蛋白等结合使用,使仔猪的生产性能达到或超过血浆蛋白的使用效果,完全可以替代血浆蛋白等同源动物蛋白的使用。
(2)适口性好,消化率高:大米糖浆为不同糖基数的混合糖,甜度高、适合消化道对淀粉的消化与吸收规律,提高了断奶仔猪对糖的利用率;植物油脂的乳化,大大提高了断奶阶段仔猪对脂肪的利用率,如50%乳化脂肪的生产性能明显高于100%的大豆油,平均日采食量增加 10~20 g,日增重提高10.6%~17.6%。
(3)仔猪抗病能力强:中药提取物的使用,提高了仔猪机体的免疫力,缓解或消除了免疫抑制因子,减少了病毒性疾病的发生和对抗生素的依赖,保障了仔猪的健康生长。
(4)腹泻率低:通过肠道上皮细胞营养调节剂的使用,促进了肠道绒毛的发育,提高了肠道对营养素的消化利用率,减少了断奶应激造成的肠道机能紊乱与腹泻的发生率,腹泻率下降25.7%~30.0%,减少了对抗生素、高铜、高锌的依赖。
4.2 仔猪调控剂特点
(1)断奶整肠剂:缓解仔猪断奶应激。一方面,通过给细胞提供能量源,刺激受损小肠绒毛膜的修复,对仔猪肠道提供保护,从而提高其消化吸收营养物质的能力,抑制病原菌(如大肠杆菌等)的生长;另一方面,通过黏附作用,有效防止肠毒素(大肠杆菌)对肠上皮细胞的进一步入侵,从而维持断奶仔猪肠道健康。
(2)乳猪诱食剂:通过调节采食中枢,促进乳猪下丘脑神经肽Y的分泌,达到强诱食目的,同时还具有促进有益菌生长,抑制有害菌繁殖,保持肠道微生态平衡和增强胃肠道消化酶的分泌,从而提高仔猪健康水平。
(3)乳化脂肪:采取特殊工艺(高压乳化,胶体磨、均质机30~40 Mpa)将油脂制备成粒径 1~3μm的脂肪球,以水溶性大米糖浆为包壁材料,形成微囊化的乳化脂肪。该产品乳化效果好,与水互溶后24 h悬浮率大于95%。该产品的消化吸收率达95%,而普通豆油的消化吸收率仅为43.4%,棕榈油(脂肪粉)的消化吸收率更低,只有23%。在与饲料配合时可以提高油脂含量(可高达30%~50%,而液态油脂的添加量不超过8%),为配制高能饲料提供了技术储备,特别适应于寒冷和热应激状态。
5 小 结
综上所述,通过研究仔猪在断奶前后肠道变化的规律,阐明其变化的机理,对指导配方设计和研发新型的功能性饲料具有十分重要的意义,其研究成果也必将具有广阔的应用前景。
[1] Lalles J P,Bosi P,Smidt H,et al.Weaning—A challenge to gut physiologists[J].Livestock Science,2007,108(1/3):82-93.
[2] Gu X,Li D,She R.Effect of weaning on small intestinal structure and function in the piglet[J].Archives of Animal Nutrition,2002,56(4):275-286.
[3] Hampson D J.Alterations in piglet small intestinal structure at weaning[J].Research in Veterinary Science,1986,40(1):32-40.
[4] Lalles J P,Bosi P,Smidt H,et al.Nutritional management of gut health in pigs around weaning[J].Proceedings of the Nutrition Society,2007,66(2):260-268.
[5] Cera K R,Mahan D C,Cross R F,et al.Ef fect of age,weaning and postweaning diet on small intestinal growth and jejunal morphology in young swine[J].Journal of Animal Science,1988,66(2):574-584.
[6] Nabuurs M J,Hoogendoorn A,van der Molen E J,et al.Villus height and crypt depth in weaned and unweaned pigs,reared under various circumstances in the Netherlands[J].Research in Veterinary Science,1993,55(1):78-84.
[7] Chen R,Yin Y,Pan J,et al.Microarray analysis of genes in small intestine of IUGR piglets:Swine Species[J].Journal of Animal Science,2009,87,(E-Supplement 2):488.
[8] Wang J,Chen L,Li P,et al.Gene expression is altered in piglet small intestine by weaning and dietary glutaminesupplementation[J].Journal of Nutrition,2008,138(6):1 025-1 032.
[9] Wang W C,Geng M M,Li T J,et al.The proteomes analysis of dietary arginine supplementation improving early weaned stress syndrome in the jejunum of early-weaned piglets[C].Proceedings of 4thInternational Symposium on Animal Nutrition,Health and Feed Additive,2009:654-660.
[10] He Q H,Kong X.F,Wu G,et al.Metabolomic analysis of the response of growing pigs to dietary L-arginine supplementation[J].Amino Acids,2009,37(1):199-208.
[11] He Q H,Kong X F,Tang Z R,et al.Serum metabolome is altered in arginine-supplemented growing pigs[C].Proceedings of 4thInternational Symposium on Animal Nutrition,Health and Feed Additive,2009:426-430.
[12] 李铁军.哺乳仔猪发育血液成分及肠道功能性基因表达变化趋势研究[D].博士学位论文.北京:中国科学院,2009.
[13] Wang W C,Gu W T,Tang X F,et al.M olecular cloning,tissue distribution and ontogenetic expression of the amino acid transporter b0,+c DNA in the small intestine of Tibetan suckling piglets[J].Biochemistry and Molecular Biology,2009,154(1):157-164.
[14] 刘玉兰,黄晶晶,范 伟,等.L-精氨酸对脂多糖刺激断奶仔猪生产性能、血液生化指标和内脏器官重量的影响[J].动物营养学报,2008,20(2):140-145.
[15] Wang J,Chen L,Li D,et al.Intrauterine growth restriction affects the proteomes of the small intestine,liver,and skeletal muscle in newborn pigs[J].Journal of Nutrition,2008,138(1):60-66.
[16] Kim SW,Mateo R D,Yin Y L,et al.Functional amino acids and fatty acids f or enhancing production performance of sows and piglets[J].Asian-australasian Journal of Animal Sciences,2007,20(2):295-306.
[17] Yao K,Yin Y L,Chu W,et al.Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs[J].Journal of Nutrition,2008,138(5):867-872.
[18] Wu X,Gao Y L,Wang L.N-carbamylglutamate and L-argininemaintain intestinal health through an Arg-NO-HSP70 pathway in weanling piglets[C].11thInternational Symposium on Digestive Physiology of Pigs,2009:161.
[19] Liu Y L,Huang J J,Hou Y Q,et al.Dietary arginine supplementation alleviates intestinal mucosal disruption induced by Escherichia coli lipopolysaccharide in weaned pigs[J].British Journal of Nutrition,2008.100:552-560.
[20] Liu Y L,Lu J,Shi JX,et al.Increased expression of the peroxisome proliferator-activated receptor in the immune system of weaned pigs af ter Escherichia coli lipopolysaccharide injection[J].Veterinary Immunology and Immunopathology,2008,124:82-92.
[21] Zhan Z,Ou D,Piao X.Dietary arginine supplementation af fects microvascular development in the small intestine of early-weaned pigs[J].Journal of Nutrition,2008,138(7):1 304-1 309.
[22] Yao K,Fan M,Wu G.Y,et al.Dietary L-arginine supplementation can increase the vascular endothelial growth f actor(VEGF)and HSP70 expression in weaned pigs[C].Proceedings of 4thInternational Symposium on Animal Nutrition,Health and Feed Additive,2009:115-123.
[23] Wu G,Meier SA,Knabe D A.Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs[J].Journal of Nutrition,1996,126(10):2 578-2 584.
[24] Kong X F,Yin Y L,He Q H,et al.Dietary supplementation with Chinese herbal powder enhances ileal digestibilities and serum concentrations of amino acids in young pigs[J].Amino Acids,2009,37(4):73-82.
[25] Kong X,Wu G Y,Liao Y P,et al.Effects of Chinese herbal ultra-fine powder as a dietary additive on growth performance,serum metabolites and intestinal health in early-weaned piglets[J].Livestock Science,2007,108:272-275.
[26] Kong X,Wu G Y,Liao Y P,et al.Dietary supplementation with Chinese herbal ultra-fine powder enhances cellular and humoral immunity in earlyweaned piglets[J].Livestock Science,2007,108:94-98.
[27] Kang P,Yin Y L,Zhen R,et al.Eff ect of replacement of lactose with partially hydrolysed rice syrup on small intestine development in weaned pigs f rom 7 to 21 days[J].Journal of the Science of Food and Agriculture,2008,88:1 932-1 938.
[28] Hou Z P,Yin Y L,Huang R L,et al.Rice protein concentrate partially replaces dried whey in the diet f or early-weaned piglets and improves their growth performance[J].Journal of the Scienceof Food and Agriculture,2008,88:1 187-1 193.
[29] 谭碧娥,李新国,孔祥峰,等.精氨酸对早期断奶仔猪肠道生长、组织形态及IL-2基因表达水平的影响[J].中国农业科学,2008,41(9):2 783-2 788.
[30] 印遇龙,吴 信,唐志如,等.不同水平精氨酸衍生物对断奶仔猪生长性能及腹泻的影响[J].农业现代化研究,2008,29(06):723-725,760.
[31] 吴 信,高运苓,伍国耀,等.N-甲酰谷氨酸对仔猪内源性精氨酸的合成调控[J].饲料工业,2009,30(4):56-58.

