苦瓜蛋白诱导K562/A02细胞凋亡
尹丽慧,熊术道,叶爱芳,韩义香,章圣辉,吴建波
(温州医学院附属第一医院 内科实验室,浙江 温州 325000)
苦瓜蛋白是从苦瓜种籽中分离出来的一种碱性糖蛋白,属于I型植物核糖体失活蛋白(ribosomal inactivating protein,RIP),其 RNA N-糖苷酶活性能使真核细胞核糖体28S rRNA第4323位腺嘌呤糖苷键水解、断裂,从而无法与延长因子2结合并导致60S亚基失活,进而使蛋白质的合成受到不可逆的抑制。近年来,陆续有研究表明,I型RIP具有抗肿瘤作用,而其抗肿瘤作用依赖于其介导的细胞凋亡。我们以往的研究也表明,苦瓜蛋白具有良好的抗肿瘤作用,并能诱导肿瘤细胞凋亡[1-2]。Pongnikom等[3]研究发现宫颈癌患者在化疗过程中同时服用苦瓜45~90 d,其P-糖蛋白(P-glycoprotein,P-gp)水平明显下降,而单纯化疗的患者P-gp表达没有改变,提示苦瓜中某种成分具有下调P-gp表达的作用。但目前有关苦瓜蛋白对耐药肿瘤细胞作用的研究国内外少有报道。本研究以多药耐药(multi-drug resistance,MDR)K562/A02细胞为模型,从细胞凋亡、P-gp表达及caspase活性等方面研究苦瓜蛋白对K562/A02的细胞生物学作用,探讨苦瓜蛋白对耐药肿瘤细胞作用的分子机制,以期为白血病多药耐药治疗寻找一种新的药物。
1 材料和方法
1.1 材料
1.1.1 实验材料:多药耐药细胞株K562/A02购自中国医学科学院血液学研究所;苦瓜蛋白由本实验室提取[2]。
1.1.2 试剂:RPMI1640(美国GIBCO公司);胎牛血清(天津市正江高科技有限公司);100×青霉素-链霉素双抗液(美国GIBCO公司);CCK-8(日本同仁化学研究所);Annexin V kit(Bender Medsystems公司);荧光标记单抗(BD公司);caspase-8 kit(联科公司)。
1.2 方法
1.2.1 细胞培养:K562/A02细胞用含10%FBS,100 U青霉素、链霉素的RPMI1640培养液,予37 ℃、5% CO2、饱和湿度的培养箱中培养,长满后按悬浮细胞常规传代法进行传代培养。
1.2.2 细胞毒性试验:取对数生长期K562/A02细胞,按1×105/mL接种96孔板,每孔加100μL,24 h后分别加入0、2、5、10、20、50和100μg/mL苦瓜蛋白,每组6复孔,继续培养48 h,加入CCK-8,37 ℃孵育1 h,酶标仪测OD值,计算细胞增殖抑制率,IC50。
1.2.3 AnnexinV/PI双染法检测细胞凋亡:取对数生长期细胞,按1×105/mL接种于24孔板,24 h后分别加入0、5、10和15μg/mL苦瓜蛋白,作用48 h后,每个标本收集2×105个细胞,按试剂盒说明书进行操作,用FACS Calibur型流式细胞仪检测。
1.2.4 细胞凋亡细胞形态学的检测(姬姆氏染色):取对数生长期细胞,按1×105/mL接种于6孔培养板,分别予0、5、10和15μg/mL苦瓜蛋白,药物作用48 h后,收集细胞,制成细胞涂片,姬姆氏染色10 min,镜下观察,拍照。
1.2.5 苦瓜蛋白对P-gp表达和caspase-3活性的影响:取对数生长期细胞,按1×105/mL接种于24孔板,分为对照组和苦瓜蛋白组,药物作用48 h后,每个样本收集细胞(2~3)×105个细胞,按试剂盒说明书进行操作,用FACS Calibur型流式细胞仪检测。
1.2.6 苦瓜蛋白对caspase-8活性的影响:取对数生长期细胞,按1×105/mL接种于24孔板,阴性对照组加入Z-VAD-FMK 1μL/mL,对照组和苦瓜蛋白组分别加入0、5、10和15μg/mL苦瓜蛋白,每个标本收集3×105个细胞,按试剂盒说明操作,上机检测。
1.3 统计学处理方法 样本均数比较采用软件进行单因素方差分析;IC50采用加权线性回归方法计算。
2 结果
2.1 苦瓜蛋白对K562/A02细胞毒性试验 2μg/mL以上的苦瓜蛋白即能够显著抑制K562/A02细胞生长(P<0.05),抑制作用随着药物剂量的增加而增强,呈明显的剂量依赖关系(见图1);48 h的IC50为(20.9±0.7)μg/mL。
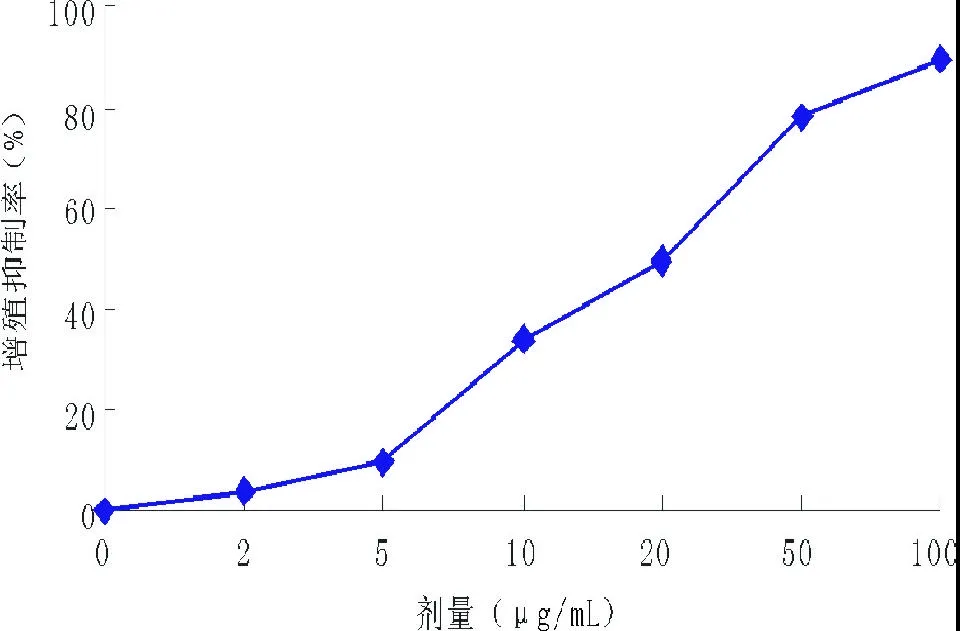
图1 苦瓜蛋白抑制K562/A02增殖的作用
2.2 苦瓜蛋白诱导K562/A02细胞凋亡 0、5、10和15μg/mL苦瓜蛋白处理K562/A02细胞48 h,细胞凋亡率分别为(1.64±0.27)%、(4.02±0.51)%、(8.11±1.00)%和(16.36±1.47)%,(n=3),苦瓜蛋白处理组与对照组相比较,差异有显著性(P<0.05),其中,以15μg/mL组细胞凋亡最明显(见图2)。细胞涂片姬姆氏染色,光镜下观察发现用药组细胞核染色质浓集、聚集在核膜下呈半月形或指环状,核固缩、碎裂,凋亡小体等典型的凋亡细胞形态学改变(见图3)。
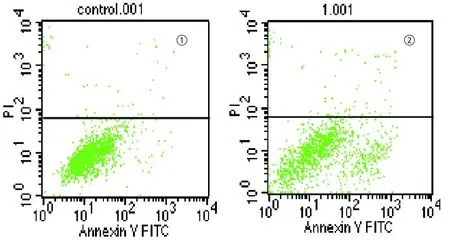
图2 ①对照组;②15μg/mL苦瓜蛋白处理48 h组,凋亡细胞明显增多Anexin V/PI双染法检测细胞凋亡(右下象限为Anexinn V阳性,PI阴性的凋亡细胞)
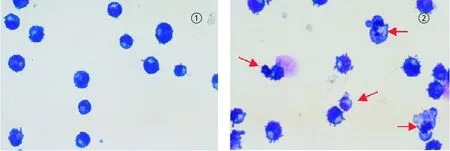
图3 K562/AO2经苦瓜蛋白处理前后的细胞形态学改变
2.3 苦瓜蛋白对P-gp表达的影响 流式细胞法检测显示,K562/A02细胞表面 P-gp蛋白呈高表达,表达率为(94.88±3.37)%(见图4①),苦瓜蛋白处理K562/A02细胞48 h后,P-gp表达下调(见表1),以15μg/mL苦瓜蛋白组最为明显(见图4②),表达率下降了30.17%。
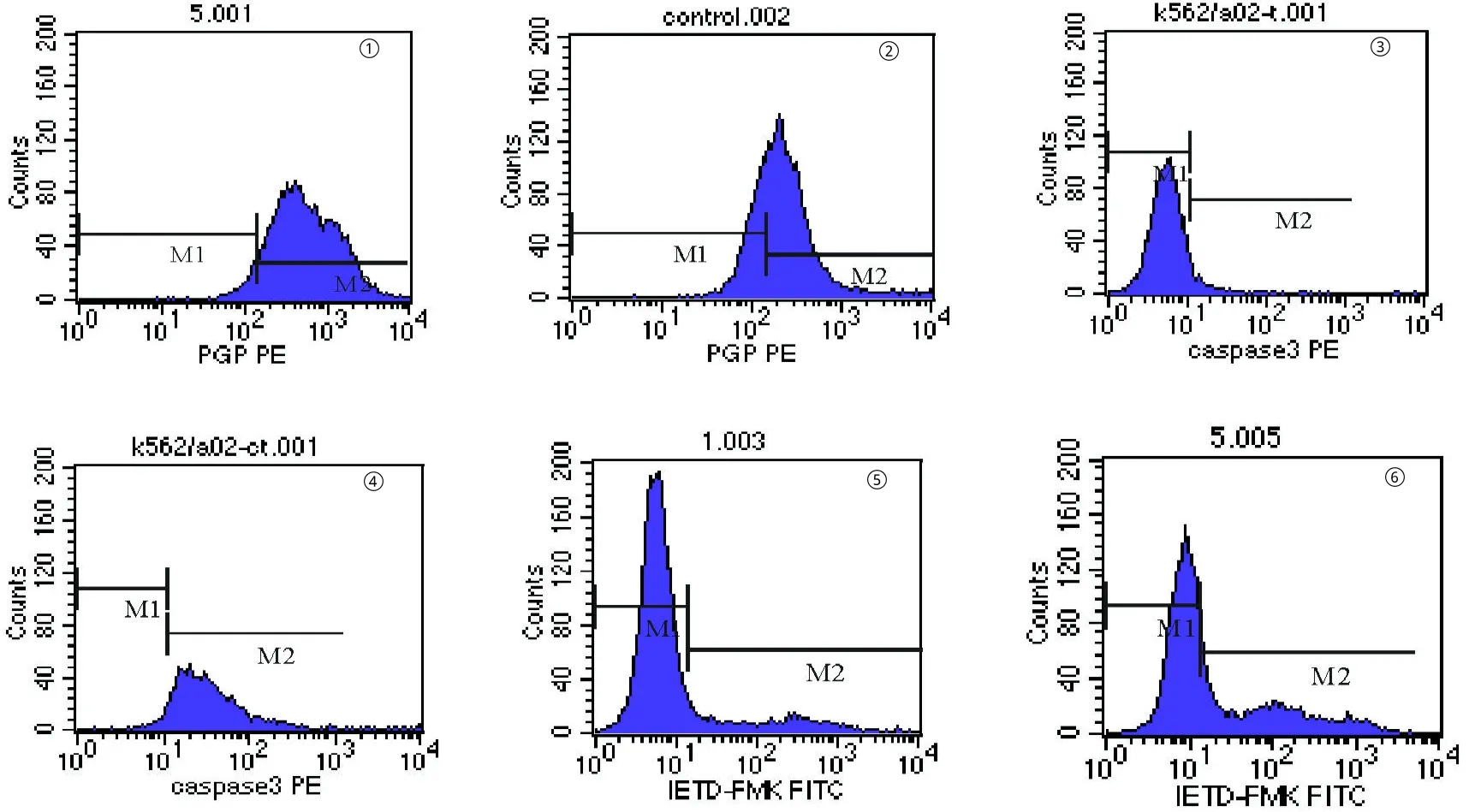
图4 苦瓜蛋白对K562/A02细胞P-gp表达及caspase活性的影响
2.4 苦瓜蛋白对caspase-3和caspase-8活性的影响 耐药细胞K562/A02的caspase-3和Caspase-8活性很低,分别为(6.52±2.03)%和(9.82±1.08)%(见图4③⑤),经苦瓜蛋白处理后,caspase-3和caspase-8的活性显著增强(见表1),15μg/mL苦瓜蛋白组活化caspase-3和活化的caspase-8分别增至(81.91±8.87)%(见图4④)和(26.94±2.90)%(见图4⑥)。
表1 苦瓜蛋白对P-gp表达和caspase活性的影响(±s,n=3)
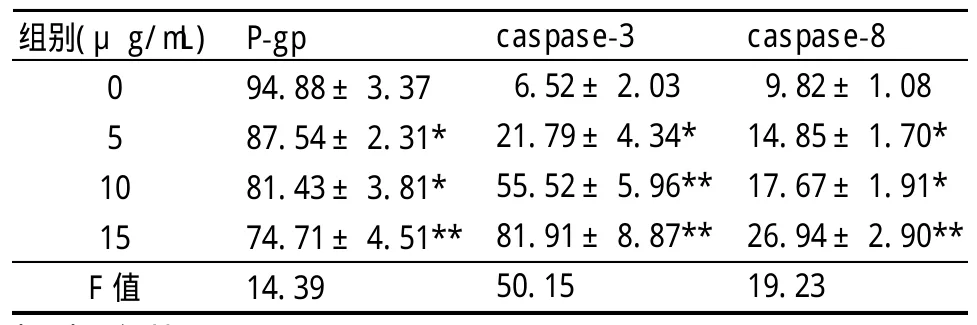
表1 苦瓜蛋白对P-gp表达和caspase活性的影响(±s,n=3)
与对照组比:*P<0.05,**P<0.01
组别(μg/mL)051 0 15 F值P-gp 94.88±3.37 87.54±2.31*81.43±3.81*74.71±4.51**14.39 caspase-3 6.52±2.03 21.79±4.34*55.52±5.96**81.91±8.87**50.15 caspase-8 9.82±1.08 14.85±1.70*17.67±1.91*26.94±2.90**19.23
3 讨论
白血病细胞对化疗药物产生MDR是临床上白血病患者化疗失败和复发的主要原因,克服白血病多药耐药,已经成为白血病治疗的重要课题。白血病MDR的发生均伴随着细胞凋亡受抑的现象,绝大多数常规化疗药物几乎不能诱导耐药细胞凋亡。苦瓜蛋白是从苦瓜中分离出来的一种植物糖苷酶,能够使核糖体失活,抑制细胞蛋白质合成。苦瓜蛋白能显著抑制白血病敏感细胞株K562细胞增殖,诱导K562细胞凋亡[2],但有关苦瓜蛋白对MDR细胞的研究国内鲜见有报道。K562/A02细胞是以P-gp蛋白升高为主要耐药机制的细胞株,它对长春新碱、阿霉素、柔红霉素等有不同程度的耐药现象[4],为本研究理想的实验模型。本研究表明2μg/mL以上苦瓜蛋白能显著抑制耐药白血病细胞K562/A02的增殖活性,呈明显的剂量-效应依赖关系,苦瓜蛋白处理K562/A02细胞48 h的IC50为(20.9±0.7)μg/mL。AnnexinV/PI双染显示苦瓜蛋白处理后凋亡细胞显著增加,以15μg/mL组细胞凋亡最明显,形态学研究显示用药组细胞呈现典型的凋亡细胞形态学改变。以上提示苦瓜蛋白对常规化疗药物耐药的K562/A02细胞保持敏感性,并能促使耐药细胞凋亡。
白血病化学治疗中药物诱发的MDR常见、主要的机制是耐药蛋白P-gp过度表达和细胞凋亡受抑制,对绝大多数常规药物不敏感[5-7]。近年来的研究表明P-gp除通过从细胞内逆浓度梯度排出抗肿瘤药物,降低细胞内药物浓度,使药物无法对白血病细胞构成有效杀死而引起耐药;还通过抑制caspase的激活来调节由多种因素诱发的细胞凋亡,特别是依赖caspase的激活凋亡途径[8-9]。我们的研究也证实了P-gp蛋白在K562/A02细胞中呈高表达状态,且同时存在caspase-3和caspase-8活性受抑制,提示P-gp可能通过抑制caspase的凋亡通道参与K562/A02细胞多药耐药性和凋亡抑制的形成。我们的研究表明,苦瓜蛋白诱导K562/A02细胞凋亡的过程中,存在着P-gp蛋白表达下调现象,15μg/mL苦瓜蛋白处理后P-gp蛋白表达率下降了30.17%;而caspase-3和caspase-8活性显著增强,15μg/mL苦瓜蛋白处理后分别升高了75.39%和17.12%,因此我们认为苦瓜蛋白能抑制P-gp表达,解除P-gp对caspase-3和caspase-8的抑制,从而逆转因P-gp高表达对caspase的凋亡通道的抑制效应而促进耐药细胞凋亡,是苦瓜蛋白诱导耐药白血病细胞凋亡的关键机制。
[1] 叶爱芳,尹丽慧,熊术道,等.苦瓜蛋白对H22细胞增殖抑制作用的实验研究[J].温州医学院学报,2008,38(4):328-332.
[2] 熊术道,尹丽慧,李景荣,等.苦瓜籽RIP的分离纯化及其对K562细胞作用的研究[J].中华中医药学刊,2007,25(1):81-84.
[3] Pongnikom S,Fongmoon D,Kasinrerk W,et al. Effect of bittermelon(Mamordica charantial L inn) on level and function of natural killer cells in cervical cancer patients with radiotherapy[J]. J Med Assoc Thai,2003,86(1):61-68.
[4] 岚凤君,杨纯正,马建国,等.一株人红白血病多药耐药细胞系(K562/A02)的建立及其耐药特性的研究[J]. 中华肿瘤杂志,1993,15(2):101-102.
[5] Mahadevan D,List AF.Targeting the multidrug resistance-1 transporter in AML:molecular regulation and therapeutie strategies[J]. Blood,2004,104(7):1940-1951.
[6] Ruefli AA,Smyth MJ,Johnstone RW. HMBA induce activation of a caspase-independent cell death pathway to overcome P-glycoprotein-mediated multidrug resistance[J].Blood,2000,95(7):2378-2385.
[7] Johnstone RW, Cretney E,Smyth MJ,et al. P-glycoprotein protects leukemia cells against caspase-dependent,but not caspase-independent cell death[J].Blood,1999,93(3):1075-1085.
[8] Li YC,Fung KP,Kwok TT,et al. Mitochondria-targeting drug oligomycin blocked P-glycoprotein activity and triggered apoptosis indoxorubic inresistant HepG2 cells[J].Chemotherapy,2004,50(2):55-62.
[9] Levchenko A, Mehta BM,Niu X,et al.Intercellular transfer of P-glycoprotein mediates acquired multidrug resistance in tumor cells[J].Proc Natl Acad Sci USA,2005,102(6):1933-1938.

