抗癌活性肽-S诱导肝癌细胞凋亡及对细胞周期的调控
王朝阳,杨成旺,欧阳晓晖,苏秀兰
(内蒙古医学院附属医院,内蒙古呼和浩特 010050)
抗癌活性肽-S诱导肝癌细胞凋亡及对细胞周期的调控
王朝阳,杨成旺,欧阳晓晖,苏秀兰*
(内蒙古医学院附属医院,内蒙古呼和浩特 010050)
目的探讨抗癌活性肽-S对荷肝癌小鼠肿瘤的抑制作用及其可能机制。方法建立荷肝癌小鼠皮下种植瘤模型,随机分三组,分别给5-Fu,20 mg/Kg,抗癌活性肽-S 0.4 ml/只,对照组给同体积的生理盐水,尾静脉注射,隔日给药连续10天。10天后处死小鼠,计算重量抑瘤率;取瘤组织制备石蜡切片,原位杂交法检测瘤细胞VEGFmRNA表达情况并计算瘤组织微血管密度(MVD),免疫组化法检测瘤组织中Ki67的表达情况;流式细胞仪检测细胞周期及凋亡。结果抗癌活性肽-S具有较好地抑制肝癌细胞增殖生长及血管生成作用,抑制率为49.43%,且对VEGF m R NA及Ki67表达有较显著的抑制作用(P<0.01);流式细胞仪分析显示,抗癌活性肽-S可以阻滞肿瘤细胞停止于S期,促进瘤细胞凋亡。结论抗癌活性肽-S具有抑制肝癌细胞生长增殖的作用,其抗肝癌细胞增殖作用机制为诱导肿瘤细胞凋亡,调控细胞周期。
抗癌活性肽-S;抑瘤作用;肝肿瘤;细胞凋亡
(Chin J Lab Diagn,2010,14:0001)
随着现代分子生物学,免疫生物学和肿瘤免疫学的飞速发展,生物治疗逐渐被人们所重视,已被公认为“肿瘤的第四大治疗模式”[1],抗癌活性肽-S(anti-cancer bioactive peptide-S,ACBP-S)来源于动物脏器,是经过对羊诱导后产生的小分子物质。本实验建立了小鼠荷人肝癌皮下种植模型,采用常规组织病理切片、HE染色、流式细胞术、、原位杂交、免疫组化等技术,分析了抗癌活性肽-S对肝癌细胞增殖的影响及其对肿瘤细胞周期及凋亡的调控作用,以期探讨抗癌活性肽-S对荷肝癌小鼠的抑瘤作用及可能的机制。
1 材料与方法
1.1 实验材料
1.1.1 实验药物 抗癌活性肽-S由内蒙古医学院附属医院临床医学研究中心分离提取,4℃保存。5-氟尿嘧啶(Fluorouracilum,5-Fu):规格,0.25 g/10 ml,南通制药总厂生产。
1.1.2 细胞株 肝癌细胞H 22由北京大学肿瘤研究柯杨教授馈赠。
1.1.3 实验动物 昆明白鼠30只,内蒙古大学动物试验中心购买。鼠龄为4-5 wk,体重18-22 g,雌雄各半,分笼饲养。
1.2 实验方法
1.2.1 荷肝癌H-22小白鼠皮下种植瘤模型的建立
复苏肝癌细胞H-22,离心,收集细胞放入1 ml生理盐水中混匀,等分两份,二只昆白鼠腹腔注射,饲养一周后取小鼠腹水制备模型。无菌条件下取小鼠腹水约10 ml,按1∶2稀释成细胞悬液,每份0.4 ml,细胞计数约在1.9×108细胞/ml,按0.4 ml/只接种于小鼠右腋皮下,建立肝癌模型。接种肿瘤细胞4 h后,将昆白鼠随机分三组,雌雄各半,按组分为①5-Fu组,20 mg/Kg◦d,②ACBP-S 组,0.4 ml/只◦天;③生理盐水对照组,0.4 ml/只◦天,以小鼠尾静脉注射方式给药。接种瘤细胞12 h后开始给药,隔日给药一次,共给药五次。
1.2.2 标本采集及相关分析 (1)计算荷瘤小白鼠抑瘤率。抑瘤率=[(NS组平均瘤重-治疗组平均瘤重)/NS组平均瘤重]×100%。(2)处死荷瘤鼠后30 min内取瘤组织,10%中性甲醛固定后,常规石蜡包埋,切5 μ m切片,HE染色,光学显微镜下低倍、高倍观察。(3)瘤细胞VEGFmRNA表达检测:采用VEGF原位杂交试剂盒(博士德公司生产)检测瘤组织VEGF mRNA表达。按试剂盒说明书进行操作。胞浆棕黄色染色为阳性,高倍镜下计数,阳性细胞百分率作为mRNA表达水平。(4)瘤组织Ki-67抗原表达检测:按照免疫组化试剂盒说明书进行操作。Ki-67染色信号定位于细胞核,胞核出现深棕色为阳性标记。(5)流式细胞仪检测瘤组织的细胞周期及细胞凋亡。①细胞周期检测:经消化、离心、上机,轻轻摇匀上样管,B.D公司标准Beads校准流式细胞仪,cell quest获取细胞10 000个,观察不同组别细胞周期变化。ModFit软件分析。②Annexin-V-FITC试剂盒检测凋亡:样本制备同细胞周期的测定。制备100 μ l细胞悬液分别加入4个5 ml试管中。加荧光染料,轻轻混匀,PI避光,孵育15 min,各管中加400 μ l 1×Binding Buffer,1 h内上机。
1.3 统计学处理 实验数据应用SPSS 13.0软件统计,根据实验资料的要求采用单因素方差分析法统计数据。
2 实验结果
2.1 抗癌活性肽-S组对H-22荷肝癌小白鼠皮下种植瘤的抑制作用
小鼠尾静脉注射5-Fu、抗癌活性肽-S均可明显抑制肿瘤生长,抑瘤率分别是5-Fu组61%,抗癌活性肽-S组49.43%(见表1)。

表1 ACBP-S对小鼠H22种植瘤的生长抑制作用
2.2 瘤组织切片光镜观察
生理盐水组细胞呈异质性,核分裂相多,可见较多的血管。抗癌活性肽-S组可见大量坏死细胞,以及灶状淋巴细胞浸润,也可见有炎细胞浸润,并可见较多的核固缩、体积缩小的细胞。
2.3 原位杂交法检测瘤细胞VEGF mRNA的表达及微血管数分析
实验中用PBS水代替原位杂交探针做阴性对照实验,结果表明瘤细胞中无阳性表达,提示本实验检测VEGF mRNA是特异性表达。图像分析系统对各组瘤细胞VEGF mRNA表达进行平均光密度数值统计。显示其表达以NS组最高,依次是抗癌活性肽-S组、5Fu组(见表2及图1)。分析结果表明NS组表达最强,而给予抗癌活性肽-S治疗后可以使肝癌细胞中VEGFmRNA的表达减弱。

图1 各实验组VEGFmRNA表达
各组瘤组织微血管数(MVD)计算。MVD记数参照Maeda[2]方法,计算5个视野内微血管数,取其平均数作为MVD值。结果显示NS组MVD值最高,5-Fu组及抗癌活性肽-S组明显低于NS组,有显著性差异,各组瘤组织MVD平均值见表2。
2.4 免疫组化法检测瘤组织Ki67表达
计数采用Ki67指数[3],指每个标本低倍镜(×100)下观察并确定有代表性的Ki67染色阳性视野,选择5个视野,即高倍镜(×400)下每个视野数200个肿瘤细胞,计算其阳性细胞总数。Ki67定位于细胞核,阳性细胞可见细胞核染色为棕褐色或棕黄色,与被苏木素衬染成蓝色的阴性胞核区别明显。Ki67指数值以NS组、抗癌活性肽-S组、5-Fu组的顺序下降。治疗组与NS组比较Ki67值均有显著型差异(见图 2,表 2)。

图2 各实验组Ki67表达

表2 ACBP-S对 VEGF mRNA、MVD、Ki67表达的影响
2.5 流式细胞术检测肿瘤细胞周期及凋亡细胞数的变化
抗癌活性肽-S作用后S期比例为40.89%,较NS组14.18%明显增加;凋亡率抗癌活性肽-S组为8.96%,较NS组2.37%明显增加。5-Fu组S期比例38.36%也明显高于NS组,凋亡率是6.95%(见图3)。凋亡细胞数统计,抗癌活性肽-S组明显高于NS组,略高于5-Fu组(见图3及表3、4)。
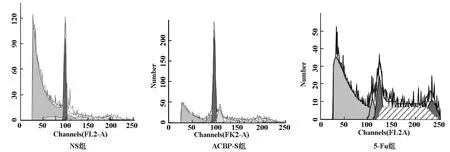
图3 ACBP-S对细胞周期和凋亡率的影响
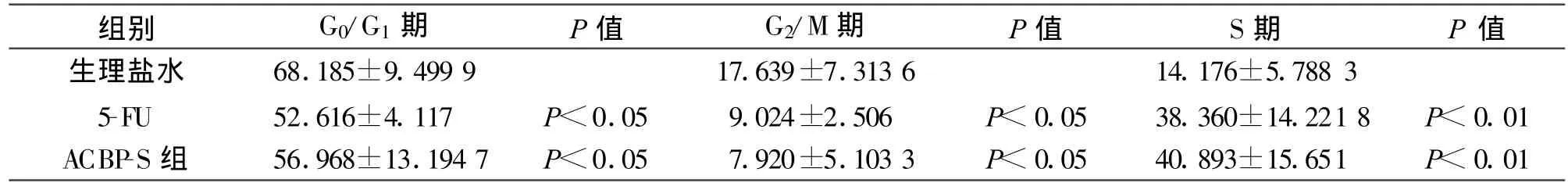
表3 各治疗组细胞周期的比较

表4 各组凋亡率及凋亡细胞数比较
3 讨论
抗癌生物活性肽-S(已获得国家发明专利,专利号:ZL96122223610),它来源于经过诱导的动物脏器,是一种新型抗癌生物制剂。前期苏秀兰等[4-6]以大量体外细胞实验和动物体内实验证明,ACBP-S能够抑制胃癌、白血病、卵巢癌、胆囊癌等多种肿瘤细胞的DNA合成,诱导肿瘤细胞凋亡和分化,降低肿瘤病人机体血液黏稠度,改善微循环,调节患癌机体无氧糖酵解代谢,提高机体免疫力。ACBP-S对BGC-823细胞的生长有明显的抑制作用,并可诱导细胞凋亡,其抑癌机制可能与其调控细胞周期有关,使p27mRNA重获表达,从而发挥抗BGC-823细胞增殖的作用。王玉芳等[7]通过ACBP-S作用于荷胃癌裸鼠后,发现ACBP-S组胃癌移植瘤中PCNA阳性细胞数显著低于对照组,提示ACBP-S能降低胃癌移植瘤细胞的增殖活性,使之生长速度减慢。而ACBP-S组的肿瘤中caspase-8的表达均升高,提示ACBP-S可能通过促进或诱导caspase-8的活化而激活整个凋亡通路。
肝癌是恶性程度最高的肿瘤之一,高复发且预后差。国内外研究表明肝细胞癌的预后与某些分子指标有关,其中血管内皮生长因子(VEGF)是近年研究的热点之一[8-12]。在本实验研究结果中,通过原位杂交法检测VEGF的表达,统计各实验组瘤细胞中VEGF表达的平均光密度的值,结果显示VEGF的表达强弱不同,生理盐水组最强,各给药组按肝肽、脾肽、5-Fu的顺序减弱。说明5-Fu及活性肽可以抑制肿瘤细胞中VEGF的生成,血管生成的环节受到抑制,抑制肿瘤组织血管的生成,阻断肿瘤生长所需营养,致使肿瘤细胞缓慢生长,最终抑制肿瘤细胞生长、侵袭、转移。同时也发现5-Fu存在明显的毒副作用。5-Fu是现今公认的有效的抗肿瘤药物,它可以明显抑制肿瘤细胞生长,其毒副作用导致荷瘤小鼠免疫功能下降,摄入量减少,后期出现体重下降,毛色差等反应。而两个活性肽给药组的小鼠一般状态较5-Fu组好,摄入饮食量无改变,小鼠体重始终在增加,毛色也较好,提示活性肽具有改善荷瘤机体生活质量的作用。
MVD被认为是能反映肿瘤血管生成的一个指标[13],近年来研究证实,许多恶性肿瘤组织中的MVD计数都显著增高,MVD计数高者易发生转移和复发,且往往和恶性肿瘤差的预后相关,是一个仅次于淋巴结转移的独立预后评估因子。它与肿瘤细胞的营养和供氧有关,是一个反映淋巴结转移的独立预后评估因子[14]。本试验通过原位杂交法检测肿瘤组织中微血管表达,在肿瘤组织中微血管呈棕色表达,计算微血管数,结果显示治疗组明显少于生理盐水组的微血管数,与肿瘤生长呈正相关,说明活性肽可以抑制肿瘤细胞产生VEGF,减少了肿瘤组织中微血管生成,通过血管供给组织的营养减少,抑制肿瘤组织的生长,最终达到抑制肿瘤组织的目的。
Ki-67抗原为细胞核内与细胞分裂增殖相关的蛋白,在细胞周期 S、G1、G2、M 期均有表达,G0 期缺如。由于其半衰期短,有丝分裂后迅速降解,故常作为检测肿瘤细胞增殖活性可靠的标记[15]。Ki-67反应细胞的增殖活性,其标记指数与有丝分裂指数显著相关,在肝癌中最高阳性表达率可达95%[16]。本实验通过图像分析系统对各组瘤组织中Ki67表达的阳性细胞数统计,结果显示生理盐水组瘤组织Ki67指数值最高,治疗组按肝肽组、脾肽组、5-Fu组的顺序下降。说明生理盐水组未给予任何抗癌药物,瘤组织增殖旺盛,增殖细胞较多。抗癌活性肽及5-Fu的作用使瘤组织增殖受到抑制,组织中增殖细胞减少,出现一些凋亡及坏死细胞。两组活性肽抑制瘤组织增殖的作用较5-Fu组略弱,但Ki67指数与生理盐水组比较有显著性差异,提示活性肽抗癌机制之一是通过抑制肿瘤细胞增殖,诱导细胞凋亡及坏死,达到抗肿瘤的治疗效果。
Ki67的表达主要受细胞营养供应的影响,而营养供应又与组织的位置和血管生成情况密切相关,浅表部位的MVD常常较高,越靠近瘤体中心的部位的MVD值越低,表现出异质性。实验中观察病理切片也看到位于肿瘤边缘的微血管较多,这可能与建立模型后血管是从周围组织中长入瘤组织有关。而且检测Ki67的表达与VEGF mRNA的表达强弱的趋势是相同的,这也说明瘤组织中血管增生旺盛,通过血管为肿瘤组织提供较多的营养,促进肿瘤细胞增殖旺盛,促进肿瘤组织的发展。当血管生成因子受到抗癌药物的抑制后,肿瘤细胞营养供应差,瘤细胞的增殖受到抑制,最终起到抑制肿瘤的作用。
现代医学研究认为,肿瘤的发生发展与细胞的增殖、分化和凋亡失衡有密切关系[17-18]。肿瘤的发生不仅是与细胞增殖速度有关。还与细胞凋亡速度有关。细胞增殖是细胞生命活动的基本表现之一,是一种受到严格调控的精确有序过程,肿瘤细胞则表现为调控失常,不受节制地无限繁殖通过影响或调节细胞周期可以抑制肿瘤细胞的增殖,诱导细胞分化或导致细胞死亡。现有的一些抗肿瘤药物就是通过影响细胞周期而发挥作用的[19-22]。另外,在肿瘤治疗过程中,促进肿瘤细胞坏死(对瘤细胞的直接细胞毒作用)和诱导肿瘤细胞凋亡、分化也是药物治疗肿瘤的基本出发点。本实验结果显示活性肽组瘤细胞的核分裂相明显较生理盐水组减少,肿瘤组织的坏死灶数目增多。并且,抗癌活性肽在促进肿瘤细胞坏死和诱导肿瘤细胞凋亡、分化两方面同时发挥了抑瘤作用,这一点参照流式细胞仪分析结果得以证实。流式细胞仪细胞周期的测定可以看出,活性肽组S期细胞比例较生理盐水组明显增高,G0/G1、G2/M期细胞比例明显下降,与生理盐水组比较均有统计学意义,且活性肽组的细胞凋亡率也明显高于生理盐水组,凋亡细胞数统计明显较生理盐水组高。提示活性肽有阻滞肿瘤细胞停止于S期作用,G0/G1期细胞不断进入S期,肿瘤细胞阻滞于S期后S期细胞增加,而G0/G1期、G2/M 期细胞减少,并促进肿瘤细胞凋亡。这个结果与实验中免疫组化Ki67的结果相同,活性肽使G2/M期的瘤细胞减少,分裂增殖的细胞减少,Ki67指数下降,表明活性肽可以阻滞瘤细胞的细胞周期,诱导并促进肿瘤细胞凋亡、分化,抑制肿瘤细胞的增殖,最终起到抗肿瘤的作用。而与对照5-Fu组比较,尽管5-Fu组显示较好的抑瘤作用,S期细胞数增加,G0/G1、G2/M期细胞减少,也有阻滞肿瘤细胞在S期的作用。但是,小鼠的生活质量显著下降,包括食欲差、消瘦、活动减少。
综上所述,抗癌活性肽-S是一种较为有效的提高荷肝癌白鼠免疫功能的生物反应调节剂,可以通过提高机体免疫功能,激发体内的免疫活性细胞,促进肿瘤细胞坏死、诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖,实现整体的抗肿瘤效果。随着分子肿瘤学和细胞分子生物学技术的进步,抗肿瘤生物活性肽的研究与开发将逐渐引起人们的重视[23],同时将在肿瘤的综合治疗中显示其较好的应用前景。
[1]严律南,主编.肝脏外科[M].北京:人民卫生出版社,2002:448.
[2]Maeda K,Chung YS,Ogawa Y,et al.Prognostic value of vascular endothelial growth factor expression in gastric carcinoma[J].Cancer,1996,77(5):858.
[3]Nolte M,Werner M,Nasarek A,et al.Expression of proliferation associated antigens and detection of numerical chromosome aberrations in primary human liver tumors:relevance to tumor characteristics and prognosis[J].J Clin Pathol,1998,51(1):47.
[4]赵媛媛,彭诗东,苏秀兰.抗癌活性肽对鼻咽癌细胞周期的影响[J].中华耳鼻咽喉头颈外科杂志,2006,41(8):607.
[5]苏秀兰,欧阳晓晖,徐桂华,等.抗癌生物活性肽-S对胃癌细胞周期和凋亡的影响[J].中华肿瘤杂志,2008,30(6):422.
[6]徐桂华,苏秀兰,申 杰,等.抗癌活性肽对人胃癌BCG-823细胞周期的调控[J].肿瘤防治杂志,2007;14(18):1361.
[7]王玉芳,闫美荣,贾淑芹,等.抗癌生物活性肽对实验性胃癌PCNA、caspase-8基因表达的影响[J].内蒙古医学院学报,2009;31(1):6.
[8]罗荣城,韩焕兴.肿瘤生物治疗学[M].北京:人民卫生出版社,2006:477.
[9]Ferrara N.Vascular endothelial growth factor:basic science and clinical progress[J].Endocr Rev,2004,25(4):581.
[10]Tian X,Cong M,Zhou W,et al.Relationship between protein expression of VEGF-C,MMP-2 and lymph node metastasis in papillary thyroid cancer[J].J Int Med Res,2008,36(4):699.
[11]Chao Y,Li CP,Chau GY,et al.Prognostic significance of vascular endothelial growth factor,basic fibroblast growth factor,and angiogenin in patients with respectable hepatocellular carcinoma after surgery[J].Ann Sung Oncol,2003,10(4):355.
[12]陆 健,卞建民,樊克武,等.肝癌中骨桥蛋白和血管内皮生长因子的表达及临床意义[J].江苏医药,2006,32(5):418.
[13]Hasan J,Byers R,Jayson GC.Intra-tumoural microvessel density in human solid tumours[J].Br J Cancer 2002;86(10):1566.
[14]Goddard JC,Sutton CD,Furness PN,et al.Microvessel density at presentation predicts subsequent muscle invasion in superficial bladder cancer[J].Clin Cancer Res,2003,9(7):2583.
[15]吴彩虹.Ki67与MMP-9在胆囊癌中的表达[J].世界华人消化杂志,2008,16(14):1585.
[16]Scholzen T,Gerdes J.The Ki-67 protein:from the know and the unknown[J].J Cell Physiol,2000,Mar;182(3):311.
[17]胥 彬,许建华.抗癌药物与肿瘤化学治疗进展[M].北京:科学出版社,2001:98-439.
[18]Su Y,Sun C M,Chuang H H,et al.Studies on the cytotoxic mechanisms of ginkgetin in a human ovarian adenocarcinoma cell line[J].Naunyn Schmiedebergs Arch Pharmacol,2000,362(1):82.
[19]Sausville EA.Cyclin-dependent kinase modulators studied at the NCI:pre-clinical and clinical studies[J].Curr Med Chem Anticancer Agents,2003;3(1):47.
[20]Grant S,Roberts JD.The use of cyclin-dependent kinase inhibitors alone or in combinationwith established cytotoxic drugs in cancer chemotherapy[J].Drug Resist Updat,2003,6(1):15.
[21]Senderowicz AM.Novel direct and indirect cyclin-dependent kinase modulators for the prevention and treatment of human neoplasms[J].Cancer Chemother Pharmacol,2003,52(Suppl 1):S61.
[22]Senderowicz AM.Novel small molecule cyclin-dependent kinases modulators in human clinical trials[J].Cancer Biol Ther,2003,2(4 Suppl 1):S84.
[23]苏秀兰.生物活性肽的研究进展[J].内蒙古医学院学报,2006,28(5):471.
Anti-cancer bioactive peptide-S induced apoptosis of hepatoma cells and cell cycle regulation
WANG Chao-yang,YANG Cheng-wang,OUYANG Xiao-hui,et al.(Clinical Research Center of Affiliated Hospital,Inner Mongolia Medical College,Hohhot010050,China)
ObjectiveTo study the inhibitory effect of anti-cancer bioactive peptide-S(ACBP-S)on the tumor of liver cancer loadedmouse and the possible mechanisim.MethodsEstablished liver cancer loaded mouse mode and divided mice into three groups randomly and gave drugs through tail intravenous injection,the drugs were 5-Fu(20 mg/kg)and ACBP-S 0.4ml per mouse.NS was given to the control group at the same dosed and in the same way.Every other day for 10 days.Then,executed mice after 10 days and calculated weight inhibitory rate.Tumor tissueswere embedded with paraffinwax and made into slices.Detected the expression of VEGFmRNA and calculatedMVD of tumor tissues and the expression of Ki67 proteinwith immune histochemistry,also detecded cell cycle distribution and cell apoptosis rate.ResultsThe ACBP-S could inhibit tumor growth and angiogenesis.The inhibitory rate were individually 49.43%.The expression of VEGF mR NA and ki67 were decreased in ACBP-S groups(P<0.01).ACBP-S could arrest tumor cells atS phase andinduce tumor cellsinto apoptosis.ConclusionACBP-S may obviously inhibit the proliferation of liver cancer cells and induce tumor cells into apoptosis.
ACBP-S;tumor inhibitory effect;liver tumor;cell apoptosis
R735.7
A
1007-4287(2010)01-0001-06
国家自然科学基金(30860327)
*通讯作者,E-mail:xlsu@hotmail.com
2009-08-14)

