组织工程支架和细胞的相互作用
向鸿照综述,王远亮,杨维虎审校
(重庆大学生物力学与组织工程教育部重点实验室 400044)
组织工程是把支架、细胞和生长因子三者相结合,用于病变、损伤部位组织和器官的修复、重建和再生。其中支架作为细胞外基质(ECM)的替代物,为细胞和生长因子负载提供一个3D环境。理想的支架除了应该具有足够的孔隙率以利于氧气和营养物质的运输,还要有足够的力学性能负载和刺激细胞,传递细胞信号,保证细胞的正常表型[1-3]。因此,了解组织工程中细胞和支架的相互作用对组织和器官的制备具有重要的意义。
1 支架对细胞的作用
理解3D支架对细胞组织的作用是组织工程研究的重点。支架对细胞的刺激主要是通过支架的构型、机械性能和外力作用3种途径实现的,其中对3D支架的机械性能的评估是组织工程研究的关键。下面分别进行论述。
1.1 支架模量对细胞生理功能的影响 支架的机械性能对细胞的表型、生长、迁移和繁殖等生理活动起到调节和控制的作用[4-5],其中支架刚性(主要指杨氏模量)对细胞行为的影响最为重要。很难准确定义3D支架中细胞的形态和支架刚性之间的关系,因为支架中细胞的表型是一个物理和生化性质共同作用的复杂过程,除了考虑支架的模量外,还要考虑蛋白水解敏感性,细胞生长因子等因素。Daniel等[6]在研究支架模量和蛋白水解敏感度对细胞表型的影响中,发现在柔顺支架中(0~100 Pa)生长的细胞更多表现出星形,而刚性较大(>500 Pa)的支架中生长的细胞则主要表现为圆球形,见图1。并且对于不同的细胞和支架其相关系数是变化的。支架模量除了影响细胞的形态之外,还控制细胞的分化和迁移功能[7]。Engler和Jean[8]研究发现,当间充质干细胞(MSCs)被种植在聚酰胺(PA)凝胶支架上时,通过控制支架基底的模量可以影响细胞的分化。此外,当支架的弹性模量分别相似于肌肉、脑和骨组织的弹性模量时,可以诱导细胞分化成肌细胞、神经元、成骨细胞。并且,基体模量直接诱导细胞骨架的肌动蛋白的重构。在细胞植入初期,支架基底的模量会影响相邻内皮细胞融合。在Engler和Jean[8]的实验中PLLA/PLGA混合物的机械性能影响支架肌肉细胞的构造、分化和成活力,刚性的PLLA/PLGA支架支持细胞聚集形成线性管状。Reinhart等[9]发现采用柔软的基底有利于细胞在支架中的黏附和保持细胞之间的接触,刚性的基底则鼓励细胞迁移活动,基底的弹性强度与细胞迁移的速度和距离相关。为了研究支架的模量对细胞繁殖的影响,Hadjipanayi等[10]和 Levy-Mishali等[11]对比成纤维细胞在刚性和柔顺2种胶原支架上的生长情况,刚性支架中的成纤维细胞2 d时表现出较高的繁殖能力(其细胞密度为柔顺支架上细胞密度的2倍),2 d时柔顺支架细胞繁殖数目与刚性支架相比显示出4 d的滞后期,6 d时柔顺支架细胞繁殖数目表现出6 d的滞后期。
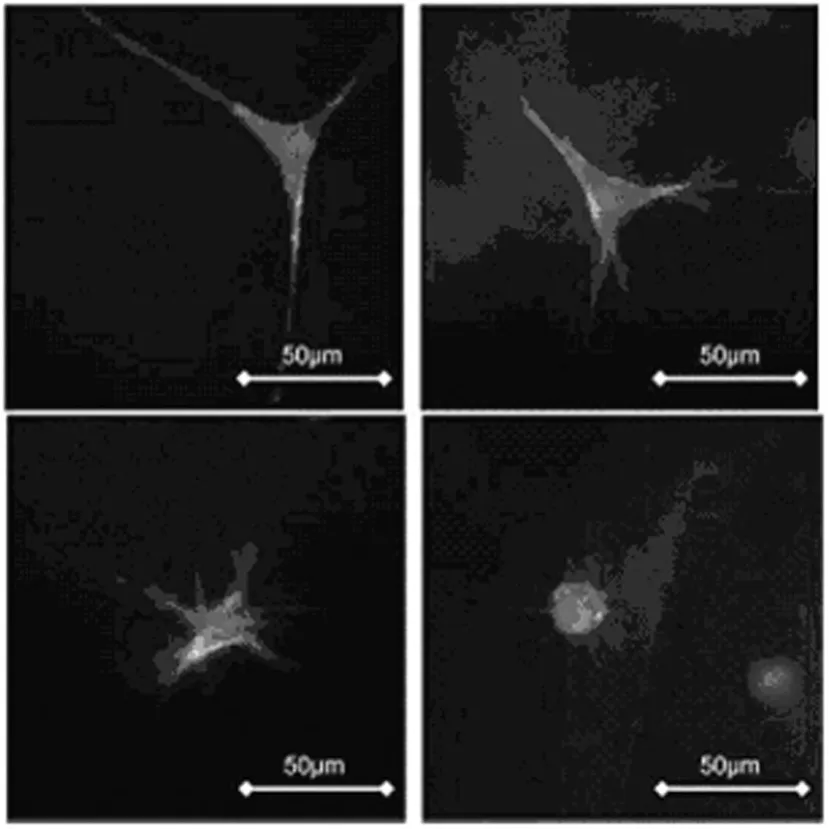
图1 细胞在不同硬度支架中的形态
1.2 支架模量对细胞收缩力的影响 细胞收缩力是细胞在3D支架黏附和生长过程中,受到支架模量和构型等因素的刺激产生的调控细胞应答和响应的力。细胞的收缩力对很多生理功能如感染、伤口愈合、血管再狭窄非常重要。支架模量对细胞收缩力的影响现在还没有一个统一的定论,研究这方面的文献也较少,有的结论甚至相互矛盾。Karamichos等[12]发现种植成纤维细胞在硬的胶原凝胶支架中,细胞产生的收缩力下降。而Yi等[13]的实验结果显示支架的硬度和细胞产生收缩力的强度成正比。与此矛盾的是,有学者通过力学测量发现细胞的收缩力大小与支架的硬度无关。作者认为不同的结论可能源于支架不同的应变水平或细胞不同时期的影响,以及不同的研究模型和理论。研究支架的模量和细胞力之间的关系是一个复杂的问题。首先需要提高实验仪器精度以及规范操作,使用来源一致的支架并且统一的细胞处理技术。
1.3 支架构型对细胞的影响 支架作为细胞生长的外部环境,支架的构型为细胞提供了黏附的基底和生长的空间,同时还影响细胞在支架中的密度分布,以及制备的组织器官的形状和功能[14]。实验显示,内皮细胞种植在不同尺寸的球形支架中,当球的直径减小时细胞病死率增加。在微岛结构中培养内皮细胞,显示繁殖细胞的增加主要出现在微岛的边缘,其中细胞密度最大的部位分布在微岛的角上。此外,MSCs种植在胶原3D支架微岛结构中,结果显示分化的脂肪细胞主要聚集在微岛结构的中心部位,成骨细胞则主要分布在微岛结构的边缘部位。说明支架构造对细胞分化可产生特殊影响。Victor等[15]研究了支架材料、长度、结构对制备工程肌腱组织的影响,发现当支架为海绵结构时得到肌腱力学性能优于凝胶结构的支架;延长轴方向,长度较大的支架其制得的肌腱径向力学性能优于短支架;支架对细胞作用力传递有梯度缓冲作用。
通过认识支架几何形状对细胞行为的作用,促进三维支架制造技术的发展,这些技术能有效地控制支架的几何形状,满足组织和器官制备的需要。例如光成型技术、静电纺丝编制技术、3D打印制备支架等。
1.4 外力作用对细胞的影响 支架在外力作用下影响细胞的表型、分化和繁殖。不同的细胞和组织采用不同的支架、反应器、刺激方式。机械刺激在组织生长过程提供剪切力,通过拉伸(单轴和双轴)、静态和动态的负载影响细胞的行为。例如collagen-glycosaminoglycan支架种植成纤维细胞,在模拟环境下拉伸方向、拉伸幅度、弹性形变次数和频率对组织工程细胞的弹性模量都会产生影响[16]。在体外对种植在胶原表面的MSCs细胞应用机械刺激,制备得到机械性能增加的肌腱组织,随后植入体内。此外,对人骨髓干细胞进行的机械刺激,结果显示这种刺激有利于骨细胞和骨组织的产生。最近发现,在聚乙二醇(PEG)支架上种植关节软骨细胞,经过动态的压力和拉伸刺激28 d,与静止状态培养相比,细胞表现出很高的弹性模量。这些发现都表明外部的刺激能诱发细胞的生理变化,细胞的生理变化反过来又影响支架的性质[17]。角膜成纤维细胞分别种植在单轴拉伸和无拉伸的胶原支架中,证明细胞排列和形态与支架的重排一致,细胞种植在未拉伸的支架中,自由取向,成星形状态,而细胞在拉伸环境中平行于长轴方向排列。增加支架对细胞影响的理解能更好地指导组织工程支架的制备。
2 细胞对支架的作用
支架在调控细胞行为的同时其性质也受到细胞活动的影响,主要表现为支架变形、支架降解和模量下降。支架性质的改变是细胞物理和生化两方面作用的结果[18]。
一方面由于细胞活动时产生的收缩力引起支架重新塑形。支架中细胞活动包括伸展、收缩、迁移3个阶段。首先细胞在工程支架中铺展和黏附,在蛋白水解的帮助下伸展层形足板进入支架内部,细胞和细胞之间是隔开的,周围支架不发生形变;12 h后细胞产生收缩力引发支架向细胞靠拢,然后诱使支架局部微小变形;3 d后支架中的细胞相向迁移,开始发生相互联系;7 d时支架中的细胞相互连接并且产生聚集,引起整个支架的收缩(即支架被压缩变形)。细胞之间的连接作用破坏了支架的弹性恢复。细胞的星形形状有利于它们与支架基底黏附以及通过支架孔相互连接。
另一方面是由于蛋白酶的作用。蛋白酶的作用分为3类:(1)蛋白水解酶作用[19],它们破坏支架纤维蛋白骨架,为细胞层形足板进入3D支架内部提供渠道。这种水解作用降低支架的模量,加速支架的降解。(2)产生新的结构蛋白如胶原,引起支架的局部结构和力学性能发生变化。(3)调控肌动蛋白,肌动蛋白是控制细胞收缩作用的关键。其中α-SMA(alpha smooth muscle actin)对细胞肌动蛋白丝合成有调节作用。有学者研究了单个肌纤维细胞中α-SM A蛋白的表达与细胞收缩力的关系,发现α-SMA对收缩力的产生没有影响,但是它的存在能提高细胞的收缩力大小,两者表现为一种近似的线性关系,至于原理现在还不清楚。有学者发现α-SMA含量高不仅能提高肌动蛋白丝表达和细胞的黏附性能,还可以有效地通过调节优化细胞亚单元的空间分布实现细胞的变形,影响细胞功能。转换生长因子TGF-β蛋白调节能增加α-SMA的表达,促进肌纤维细胞分化。有研究发现 TGF-β1与 TGF-β3相比更能诱导α-SMA 表达。b FGF、PGE2能抑制 TGF-β1的表达,阻碍细胞收缩力的产生。这些作用都是通过整合素传递给细胞外支架。
除此之外,组织工程中细胞的培养条件[20]也会影响支架的模量。培养液除了提供足够的养分和缓冲作用外,还含有激素和生长因子以促进细胞的增殖。考虑这些因素有利于更好地理解细胞与支架或ECM相互作用的机制。
3 测量细胞收缩力仪器
测量细胞收缩力和研究收缩力的调节功能是理解组织和器官的生理和病理功能的关键。定量细胞收缩力的大小为组织工程选择理想的细胞和支架提供帮助。以下介绍检测细胞收缩力的最新仪器和原理。
CFM力学检测仪通过传感器记录支架的微小形变(灵敏度为10-6m)换算成力的大小。获得细胞对支架作用力随时间变化的曲线图。缺点是存在背景噪声(它反映所有细胞对支架的作用,没有生长在支架上的细胞产生的力也被记录下来)。一个典型的CFM曲线能显示106个生长在胶原支架中的成纤维细胞产生的力,推断出某个时间细胞产生的力。如培养8 h,一个成纤维细胞可以产生大约0.1 n N的力。有学者对此系统加以改进,从测量结果中扣去背景噪音,得到更加准确的结果。有学者测量细胞收缩力对collagen-glycosaminoglycan支架的影响,结果显示支架中成纤维细胞密度和所产生的力之间呈线性关系。此外将关节软骨细胞种植在相同的支架上,力/时间曲线显示单个细胞力峰值为0.3 nN(3 h)。
Eastwood设计了更加精密的CFM(t-CFM)系统。t-CFM系统可以检测细胞对支架的机械力反应,当成纤维细胞种植在3D collagen-glycosaminoglycan支架中时,t-CFM装置检测发现种植8 h以后细胞收缩力减少,达到一个新的平衡。显示出细胞具有一种自我调节功能,能减少由于外界刺激对细胞的破坏和干扰。人们使用t-CFM检查了骨髓干细胞在胶原支架中的收缩情况,结果显示力学峰值随供体的不同而不同。
在t-CFM基础上研制出(SIM-CFM)[21]。这种装置可以同时获得细胞作用力、外部载荷和支架微观的图像。SIMCFM能提供4个关键数据,通过这4种数据可以确定支架形变过程。这4种数据是细胞的尺寸、细胞内应力、动态的细胞扰动和支架在湿态时位移。这些数据的测定有助于衡量支架的变形和细胞力之间的关系。
对细胞图像的观测可以借助原子力显微镜观测细胞和支架的微观作用。标定细胞的空间构型采用类似细胞间骨架聚合物F-actin的细胞角蛋白中间丝的免疫荧光染色,或者通过分子探针(Eugene OR)对细胞内进行荧光探针标计[22-23]。
前面介绍这些技术对于研究工程细胞和组织的生长极为重要。合适相匹配的细胞和支架将会有助于提高组织工程技术,获得所需健康的组织器官。
4 结 论
本文主要是介绍组织工程中细胞和支架间的相互作用,介绍了支架的机械性能对细胞功能的影响,细胞的收缩力对支架的作用,还有最新的测量装置和作用原理。将来的研究应当着重发展新的实验装置,有效地定量细胞产生的收缩力。这些技术应该提供一个可供操作的统一规范,从而使实验结果具有可比性,更加精确。探讨细胞与支架,细胞和细胞之间的作用将为进一步的组织工程模型提供理论依据,有助于寻找更好的组织工程支架和细胞。
[1]Alvaro M ,Eun JK ,Cynthia A,et al.A three-dimensional scaffold with precise micro-architecture and surface micro-textures[J].Biomaterial,2009 ,30(5):4610.
[2]Wang L,Shashi KM ,Wlilliam H,etal.Influence of microw ellbiomimetic topography on intestinalepithelial Caco-2 cellphenotype[J].Biomaterials,2009,30(8):1.
[3]Vincenzo G ,Filippo C ,Paola T ,et al.Polyactic acid fibroreinforced polycaprolactone scaffolds for bone tissue engineering[J].Biomaterials,2008 ,29(5):3662.
[4]Biman B,Subhas C.Cellpreliferationand migration in silk fibroin 3D scaffolds[J].Biomaterials,2009 ,30(2):2956.
[5]Anthony CJ,Christoph HA ,Dietmar WH ,et al.The correlation of pore morphology,interconnectivity and physicalproperties of 3D ceramic scaffolds with bone ingrow th[J].Biomaterials,2009 ,30(29):1440.
[6]Daniel D,Havazelet B ,Dror S.Defining the role of Matrix com pliance and proteolysis in three-Dimesionalcell spreading and remodeling[J].Biophys J,2008,94(4):2914.
[7]Deok-Ho K ,Karam H ,Kshitiz G,et al.Mechanosensitivity offibroblast cell shape and movement to anisotropic substratum topography gradients[J].Biomaterials,2009,30(6):5433.
[8]Engler AJ,Jean S.Biophysical Regulation of Endoderm By 3-Dimensional Fibronectin Matrix[J].Biophys J,2009,96(3):523.
[9]Reinhart KCA,Dembo M,Hammer DA.Cell-Cell mechanical communication through compliant substrates[J].Biophys J,2008 ,95(12):6044.
[10]Hadjipanayi E ,Mudera V ,Brow n RA.Close dependence offibroblast proliferation on collagen scaffold matrix stiffness[J].J Tissue Eng Regen Med,2008,33(5):1384.
[11]Levy-Mishali M ,Zoldan J,Leavenberg S.Effect of scaffold stiffness on myoblast differentiation[J].Tissue Eng Part A ,2008,51(11):2607.
[12]Karamichos D,Brown RA ,Mudera V.Collagen stiffness regulates cellular contraction and matrix remodeling gene expression[J].J Biomed Mater Res A,2007 ,83(4):887.
[13]Yi F,Gong YQ ,Prabar K,et al.Spatial Coordination of Actin Polymerization and ILK-Akt2 Activity during Endothelial Cell Migration[J].Deve Cell,2009 ,16(5):661.
[14]Cheng K,Lai YZ ,William S.Th ree-dimesnsional polymer scaffolds for high throughput cell-based assay systems[J].Biomaterials,2008 ,29(3):2801.
[15]Victor S,Marepalli N,Jason T,et al.Effect of scaffold mmaterial,construct length and mechanical stimulation on the in vitro stiffness of the engineered tendon construct[J].J Biomechan,2008,41(11):822.
[16]Jungreuthmayer C,Jaasma S.Deformation simulation of cells seeded on a collagen-GAG scaffold in a flow perfusion bioreactor using a sequential 3D CFD-elastostatics model[J].Med Eng Phys,2009,31(4):40.
[17]Dekel D,Shlanlamit L.Cell-scaffold mechanicalinterplay within engineered tissue[J].Semin Cell Deve Biol,2009,20(11):656.
[18]Simon C,Geralding R,Jennifer S,et al.The relationship between the mechanical properties and cell behaviour on PLGA and PCL scaffolds for bladder tissue engineering[J].Biomaterials,2009 ,30(7):1321.
[19]Kumiko M ,Shinichi T,Kosuke O,et al.Comparative study of silk fibroin porous scaffolds derived from salt/waterand sucrose/hexafluoroisopropanolin cartilage formation[J].J Biosci Bioeng ,2009,108(1):68.
[20]Christophe P,Kiyoshi T ,Yasuyuki S ,et al.A method for the design of3D scaffolds forhigh-density cellattachment and determination of optimum perfusion culture conditions[J].J Biomechan,2008,41(2):1436.
[21]Annegret H,Dahlmann N ,Belen M ,et al.Dynamic protrusive cell behaviour generates force and drives early matrix contraction by fibroblast[J].Exp Cell Res,2007,31(3):4158.
[22]Deepak V,Ranga R.Surfactant-free Cd Te nanoparticles mixed M EH-PPV hybrid solar cell deposited by spin coating technique[J].Solar Energy Mate Solar Cells,2009,93(9):1482.
[23]Ranjna CD,Aroop KD.Cell-interactive 3D-scaffold:advances and applications[J].Botechnol Adv,2009 ,27(2):334.

