p21在乳腺癌化疗中对表柔比星的增敏性及其作用机制的研究
熊娟 徐笑红 陈文虎 李一荣 胡丽华
1. 浙江省肿瘤医院检验科,浙江 杭州 310022;2. 华中科技大学同济医学院附属协和医院检验科,湖北 武汉 430022
表柔比星是治疗乳腺癌的常见化疗药物,但近年来其疗效不佳是困扰临床应用的一大问题,目前配合基因治疗提高表柔比星的疗效,是乳腺癌治疗发展的新趋势。p21(cyclin-dependent kinase interacting protein 1, p21WAF1/CIP1)基因是目前备受关注的一种肿瘤抑制基因,同时又是一种重要的细胞周期负性调控因子,在细胞的生理、病理增殖与分化过程中发挥关键性作用,有研究显示p21的低表达预示肿瘤的进展和高度恶性倾向[1]。此时若恢复其与细胞周期解偶联的调控机制及正常的基因表达,这对于处于增殖旺盛期的肿瘤细胞而言具有重大意义[2]。本研究即采用基因转染技术高表达p21基因,以研究其对表柔比星作用于乳腺癌细胞的敏感性影响及其可能的作用机制。
1 材料和方法
1.1 细胞和试剂 人乳腺癌细胞株MCF-7购自华中科技大学同济医学院细胞库,采用含10%胎牛血清的DMEM高糖培养液(Gibco公司),置于37 ℃、CO2体积分数为5%的培养箱中培养。表柔比星购自Sigma公司,溶解于无菌的0.9%的NaCl溶液中,配成2 mg/mL的储存液,使用前稀释成终浓度为0.2 μg/mL的工作液。pEGFP-C2空质粒由华中科技大学同济医学院免疫学研究所惠赠。LipofectamineTM2000、TRIzol试剂为Invitrogen公司产品;G418为Gibco公司产品;质粒抽提试剂盒为美国Omega公司产品;MTT及DMSO,碘化丙啶(propidium iodide,PI)购自Sigma公司;ReverTra Ace-a-反转录试剂为日本Toyobo公司产品;SYBR Green Ⅰ染料购自上海申友公司。
1.2 方法
1.2.1 基因转染及细胞筛选 以质粒pcDNA3-p21为模板,定向引入EcoRⅠ和BamHⅠ酶切位点,PCR扩增获得全长p21基因;随即将p21基因插入到经同样酶切处理的pEGFP-C2质粒中,经连接、转化和筛选构建获得带有增强型绿色荧光蛋白(enhanced green fluorescent proteins,EGFP)真核表达质粒pEGFP-p21。pEGFP-p21经酶切和测序鉴定后,即可用于转染实验。按转染说明书的要求,分别将pEGFP-p21和pEGFP-C2转染至MCF-7细胞,48 h后换用含G418的DMEM完全培养液进行筛选,荧光显微镜下观察EGFP的表达及定位,挑取表达EGFP同时具有G418抗性的克隆,传代扩大培养,建立稳定表达p21基因的细胞株,将筛选获得的细胞株分别命名为MCF-7-p21和MCF-7-pEGFP。提取以上2组细胞的总RNA,并反转录获得cDNA待用。
1.2.2 表柔比星对p21基因转染前后MCF-7细胞增殖抑制状况的影响 实验共分4组:未转染质粒的MCF-7细胞组(空白对照组)、0.2 μg/mL表柔比星处理MCF-7细胞组(单独加药组)、pEGFP-p21转染组(MCF-7-p21组)和0.2 μg/mL表柔比星处理MCF-7-p21细胞组(联合组),每组设6个复孔。单独加药组与联合组在细胞铺板培养8 h后,于每孔中加入0.2 μg/mL表柔比星,实验终止前每孔加入MTT 20 μL,4 h后弃去培养液,加入150 μL DMSO,待结晶溶解后在酶标仪上570 nm波长处测定的吸光度值(A),实验重复3次。计算每组细胞的增殖抑制率,细胞增殖抑制率(%)=(1-A实验组平均值/A空白对照组平均值)×100%,绘制生长抑制曲线图。同时应用公式计算p21基因转染与表柔比星联合作用的增敏效果:Q=E联合组/[E单独加药组+(1-E单独加药组)×Ep21转染组],其中E代表增殖抑制率,Q<0.85表示两者相互拮抗,0.85≤Q≤1.15表示两者作用相加,Q>1.15表示两者具有协同作用。
1.2.3 细胞周期的检测 收集稳定转染后的各组细胞(1×106个细胞/组),PBS洗涤细胞2次,离心后回收细胞,用预冷的70%乙醇溶液在-20 ℃条件下固定细胞过夜,用含核糖核酸酶A(RnaseA) 的PI染色,4 ℃避光60 min后行流式细胞仪检测,CellQuest软件分析处理。
1.2.4 凋亡率的检测 收集稳定转染后的各组细胞(1×106个细胞/组)接种于6孔培养板,24 h后用70%冰乙醇固定细胞,PBS洗涤细胞,加入5 μg/mL的Hoechst 33342染液1 mL反应15 min,再加入100 μg/mL的PI 染液0.5 mL,-20 ℃避光静置10 min后,荧光显微镜下观察细胞形态学变化,并计数细胞凋亡、坏死百分率。评判标准:细胞核染为淡兰色为Hoechst 33342染色(-),细胞核浓染为亮兰色或颗粒状为Hoechst 33342染色(+);细胞核被PI 拒染为PI 染色(-),细胞核染为红色为PI 染色(+)。因此,Hoechst 33342 (-)/ PI(-)为活细胞;Hoechst 33342 (+)/ PI(-)为凋亡细胞;PI(+)为坏死细胞。同一处理随机选择6个观察视野,计数至少500个细胞,计算凋亡率。
1.2.5 实时荧光定量PCR法(real-time fluorogent quantitative PCR,RFQ-PCR)检测p21和survivin mRNA的表达 收集各组上述不同方法处理的细胞,每组1×106个细胞/mL,用TRIzol试剂提取总RNA,紫外分光光度仪定量后各取2 μg RNA,反转录获得cDNA备用,具体步骤参照ReverTra Ace-a-反转录试剂说明书。随后进一步检测p21和survivin在细胞中的表达量,p21基因上游引物5’-CAGGGGACAGCAGAGGAAGA-3’,下游引物5’-TTAGGGCTT CCTCTTGGAGAA-3’;survivin基因上游引物5’-AGAACTGGCCCTTCTTGGAGG-3’,下游引物5’-CTTTTTATGTTCCTCTATGGGGTC-3’;以GAPDH为内参照,GAPDH上游引物5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物5’-GAAGATGGTGATGGGATTC-3’。利用SYBR Green Ⅰ染料在LightCycle定量PCR仪上检测各扩增反应的情况,扩增条件:94 ℃预变性2 min;94 ℃变性5 s,60 ℃退火15 s,72 ℃延伸15 s,共40个循环,分别进行荧光检测,并制作熔解曲线对PCR产物的特异性进行鉴定,此过程中可密切观察不同产物的熔解情况,最后反应冷却至40 ℃。该检测独立重复3次。由于各CT值与该模板中目的基因含量的对数值存在线性关系,目的基因含量越多,CT值越小,本研究根据公式得出目的基因的相对值:目的基因=2-ΔΔCT,其中ΔΔCT=ΔCT标本-ΔCT校正组=(CT标本目的基因-CTGAPDH)-(CT校正组目的基因-CTGAPDH)。本研究中,均以未经任何处理的HepG2细胞(即空白对照组)作为校正组。
1.3 统计处理 以上实验均独立重复3次,所有数据用SPSS 13.0统计软件进行统计学分析,计量资料以表示。组间比较采用单因素分析及t检验,以P<0.05为差异有统计学意义。
2 结 果
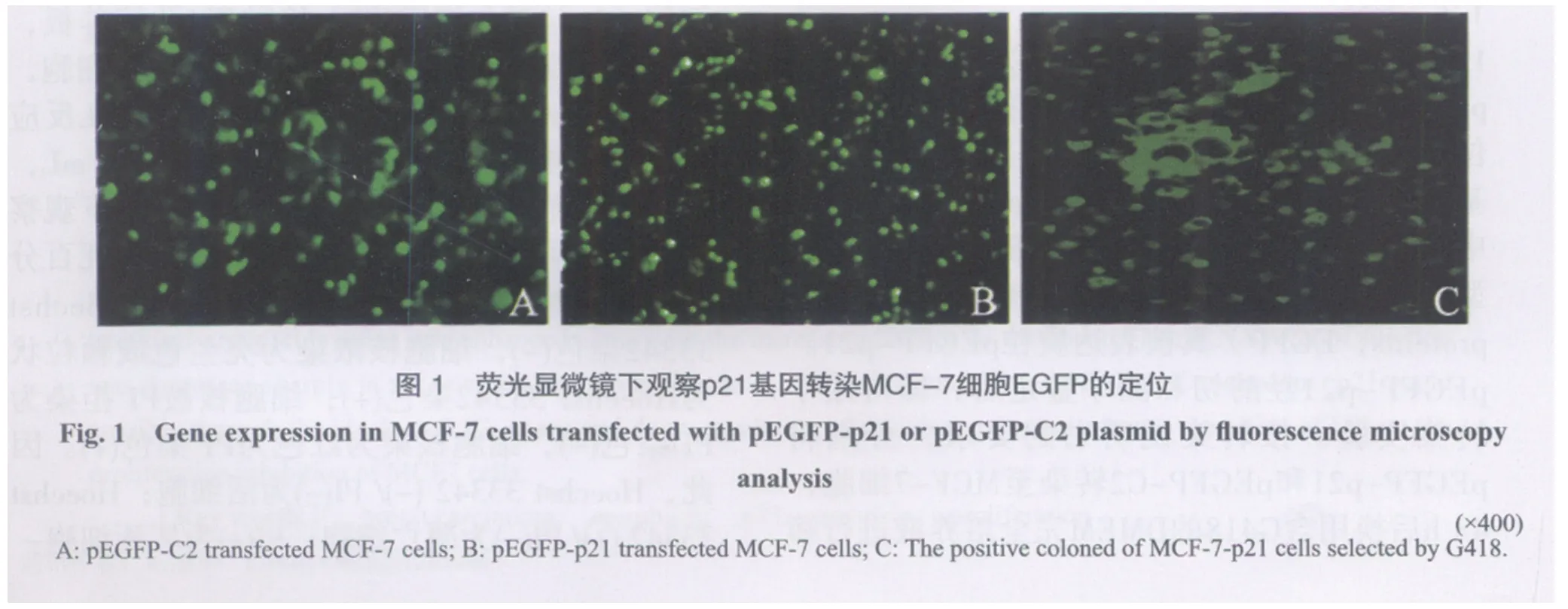
2.1 p21基因转染后的鉴定及细胞定位 利用LipofectaminTM2000与G418对细胞进行转染和筛选后,得到高表达p21的MCF-7细胞株,RFQPCR亦证实,pEGFP-p21转染组、pEGFP-C2转染对照组和空白对照组中p21 mRNA的表达水平(用2-ΔΔct值得到目的基因的表达量)分别为:155.12±56.00、2.06±0.55和1.00±0.00,结果提示,pEGFP-p21转染组的p21 mRNA的表达量与对照组比较,差异有显著的统计学意义(F=22.56,P<0.01)。其中与空白对照组比较,pEGFP-p21转染组p21 mRNA的表达水平是其155倍(t=4.77,P<0.05),而pEGFP-C2转染组与空白对照组间,经比较差异无统计学意义(t=3.35,P>0.05),结果说明p21基因转染成功。荧光显微镜下观察发现pEGFP-C2转染组中,细胞内绿色荧光主要分布于细胞质中(图1A);而p21转染组,绿色荧光主要集中在细胞核内,表达强时可凝聚成团块表达于核仁(图1B)。48 h后,将瞬转成功的p21转染组细胞给与含有G418培养液进行筛选,扩大培养得到稳定高表达p21基因的MCF-7细胞,镜下呈携带绿色荧光的细胞克隆团生长(图1C)。
2.2 表柔比星联合p21基因转染对MCF-7细胞增殖的影响 MTT法检测结果显示,0.2 μg/mL的表柔比星单用及联合p21基因后,对MCF-7细胞均具有一定抑制作用(图2)。与表柔比星单独处理组相比,联合组比表柔比星单独处理组对MCF-7细胞的增殖抑制效应要提早2 d(P<0.05);在药物处理第3、4天,联合组的抑制效应明显增强,显著大于表柔比星单独加药组(P<0.01)。表柔比星与p21基因转染联合用时,p21可促进表柔比星对MCF-7细胞的杀伤作用,且抑制效应随作用时间的增加而增强(r=0.91,P<0.05),两者联用呈效应的相加作用,计算得出联合作用效果Q值=1.07。
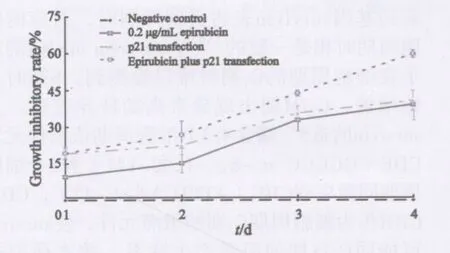
图2 表柔比星联合p21转染对MCF-7细胞增殖能力的影响Fig.2 Inhibitory effects of epirubicin combined with p21 gene transfection on proliferation of MCF-7 cells detected by MTT assay
2.3 细胞周期变化 由表1可见,与MCF-7和MCF-7-pEGFP细胞比较,MCF-7-p21细胞中处于G0/G1期和S期的细胞比例明显增加,而G2/M期的细胞比例明显减少。
2.4 细胞凋亡情况 由图3所示,与两对照组相比,PI和Hoechst33342 荧光染色未见p21基因转染对MCF-7细胞有显著性形态学影响,细胞核呈弥散均匀荧光,也无明显地细胞死亡,凋亡率改变差异亦无统计学意义(P>0.05)。
表1 转染后各组细胞细胞周期的变化Tab.1 Cell cycle phase patterns of MCF-7 after transfection[( )%]
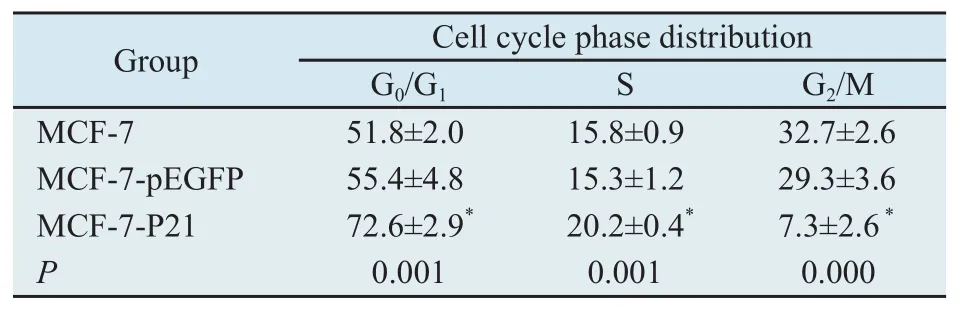
表1 转染后各组细胞细胞周期的变化Tab.1 Cell cycle phase patterns of MCF-7 after transfection[( )%]
*: P<0.05, compared with MCF-7 group and MCF-7-pEGFP group.
2.5 单独用药与联合作用后survivin mRNA的水平变化 根据实时荧光定量PCR的2-DDCT分析结果显示[3],24 h时空白对照组、单独加药组、空质粒转染对照组、p21转染组、联合组的survivin mRNA水平分别为1.00±0.00、0.22±0.08、1.01±0.19、0.56±0.10和0.13±0.05;48 h时各组的survivin mRNA水平分别为1.00±0.00、0.21±0.05、1.05±0.05、0.17±0.04和0.03±0.00。与空白对照组和空质粒转染对照组比较,单独加药组、p21转染组、联合组的survivin的表达水平较空白对照组和空质粒转染对照组相比明显下调(P均<0.01)。在24 h时,联合组的survivin mRNA水平低于单独加药组,差异有统计学意义(P<0.05);在48 h时,联合组中survivin的表达明显受到了抑制,与单独加药组相比,差异有显著的统计学意义(P<0.01,图4)。
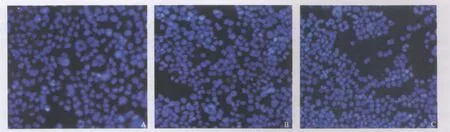
图3 Hoechst33342/PI染色对转染后MCF-7细胞的形态学比较Fig.3 Morphology of the MCF-7 cells stained with Hoechst33342/PI after transfection(×400)
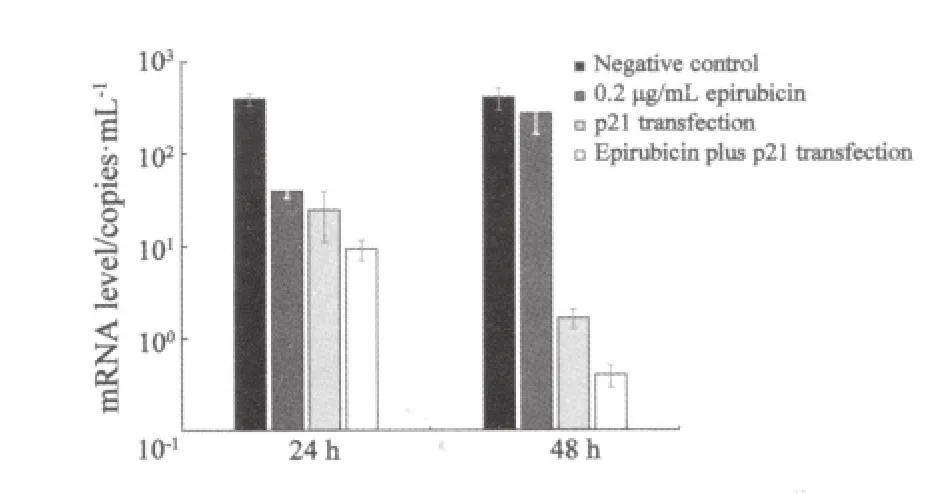
图4 RFQ-PCR法检测各组MCF-7细胞中survivin mRNA相对表达的情况Fig.4 Expression of survivin mRNA in MCF-7 cells after different treatments detected by RFQ-PCR
3 讨 论
乳腺癌是我国常见妇科肿瘤,临床发现时许多已发生血行转移,有研究证实,合理剂量表柔比星的运用以及手术切除的成功与患者预后密切相关[4]。但随着耐药性的逐年升高,如何提高其疗效是临床治疗中亟待解决的问题。目前乳腺癌的发病机制尚未完全明了,但一般认为是细胞周期失控性疾病,大部分乳腺细胞经历了G1期或G2期控制点的缺陷,并能利用受损伤或未完全复制的DNA来启动有丝分裂,导致组织异常的持续增生,这提示细胞绕过细胞周期阻滞途径是其永生化及癌变的必要条件[5]。作为广泛的细胞周期素依赖性激酶(cyclin/CDK)的抑制蛋白,p21能参与细胞生长抑制、分化、衰老及DNA损伤修复等功能的调节,而且参与介导许多转录因子功能的发挥,这使其在细胞周期、细胞分化和细胞凋亡的调控网络中处于重要的位置[6]。
survivin是细胞凋亡抑制因子(inhibitor of apoptosis family of proteins,IAPs)家族中最强的凋亡抑制因子,近年来在乳腺癌的相关研究领域中,许多研究提示survivin的表达可作为乳腺癌患者独立的预后因子[7-8]。临床上survivin表达水平高的肿瘤患者存活率低,也易产生化疗耐药及预后不佳等问题[9],这提示survivin极可能起乳腺癌恶性转化和耐药基因的角色。
为了研究p21基因和表柔比星的联合效应,本课题组将稳定转染p21基因后的MCF-7-p21细胞与0.2 μg/mL表柔比星共同培养,发现p21能明显促进表柔比星对MCF-7细胞增殖的抑制作用,这显示p21可能通过某种途径增强了表柔比星的疗效。为进一步了解该作用机制,本研究利用PI和Hoechst33342双标染色法对转染后的MCF-7细胞进行观察,发现p21转染对MCF-7细胞凋亡率的改变并不显著,多数细胞核呈弥散均匀的兰色荧光,也无明显的细胞死亡。但通过流式细胞术发现p21转染后,MCF-7细胞的生长受到了明显抑制,G1期的细胞比例明显增加,G2期和S期比例下调,这与耐药基因survivin表达受到抑制时,对应的细胞周期时相是一致的[10]。survivin mRNA的水平在细胞周期的G1期时难以检测到,S期时开始增加,G2/M期出现异常高的特异表达。且survivin的近5’端含有3个细胞周期依赖性元素CDE(GGCGG at -6、-12和-171)和1个细胞周期同源序列CHR(ATTTGAA at -42),CDE/CHR作为细胞周期G1期的阻滞元件,使survivin可能同G1/S期的阻滞产生联系。故本研究推测,p21的高表达可能会下调MCF-7细胞中survivin的表达,进而增强乳腺癌细胞对表柔比星的敏感性,缓解其抑癌效益不佳的情况。
目前在对survivin启动子区分析时,Hoffman等[10]发现survivin转录抑制可能是通过野生型p53与下游靶分子间的相互作用来实现的。而p21蛋白是p53下游靶分子中最重要的一个抑癌基因,p53许多生物学功能的发挥都需在p21协助下完成的[11]。本研究通过RFQPCR发现,p21转染和表柔比星联合作用MCF-7细胞后,细胞中的survivin mRNA水平低于单独加药组,且随联合作用时间的延长,p21基因对乳腺癌细胞内survivin表达的抑制效应明显增强。
综上所述,笔者认为肿瘤耐药是化疗中常见的难题之一,这一问题的解决必将提高肿瘤患者治疗效果,对延长患者的生存期有重大影响。
[1] Kao JT, Chuah SK, Huang CC, et al. P21/WAF1 is an independent survival prognostic factor for patients with hepatocellular carcinoma after resection[J]. Liver Int,2007, 27(6): 772-781.
[2] Weinberg WC, Denning MF. P21Waf1 control of epithelial cell cycle and cell fate[J]. Crit Rev Oral Biol Med, 2002,13: 453-464.
[3] Schefe JH, Lehmann KE, Buschmann IR, et al. Quantitative real-time RT-PCR data analysis: current concepts and the novel “gene expression’s CT difference” formula[J]. J Mol Med, 2006, 84(11): 901-910.
[4] 王世清, 刘武红. 中、晚期乳腺癌术前表阿霉素介入治疗的临床观察[J]. 中国癌症杂志, 2000, 10(6): 574.
[5] 陆劲松, 施达仁. 细胞周期相关因子与乳腺细胞的癌变及生物学特性的相关性研究[J]. 中国癌症杂志, 2001,11(3): 193-195.
[6] Altieri DC. Survivin, versatile modulation of cell division and apoptosis in cancer[J]. Oncogene, 2003, 22(53): 858l-8589.
[7] Hinnis AR, Luckett JC, Walker RA. Survivin is an independent predictor of short-term survival in poor prognostic breast cancer patients[J]. Br J Cancer, 2007, 96(4): 639-945.
[8] 鲁祥石, 刘彦龙, 王涤, 等. 凋亡抑制蛋白Livin和Survivin在乳腺癌中的表达及意义[J]. 中国癌症杂志, 2007, 17(7):542-545.
[9] Zhou M, Gu L, Li F, et al. DNA damage induces a novel p53-Survivin. signaling pathway regulating cell cycle and apoptosis in acute lymphoblastic leukemia cells[J]. J Pharmacol Exp Ther, 2002, 303(1): 124-131.
[10] Hoffman WH, Biade S, Zilfou JT, et al. Transcriptional repression of the anti-apoptotic survivin gene by wild type p53[J]. J Biol Chem, 2002, 277(5): 3247-3257.
[11] Lohr K, Moritz C, Contente A, et al. p21/CDKN1A mediates negative regulation of transcription by p53[J]. J Biol Chem,2003, 278(35): 32507-32516.

