髓样分化因子88与胃癌细胞BGC823紫杉醇耐药性关系研究
张隆 魏涛 倪振华 季青 赵晓艳 康向东
上海中医药大学附属普陀医院实验中心,△检验科, 上海 200062
髓样分化因子88(myeloid differentiation factor88,MyD88)是Toll样受体(Toll-like receptor,TLR)信号通路中的一个关键衔接分子[1]。其本质是一种胞质可溶性蛋白,结构上有3个功能区域:N 端的死亡区(death domain,DD),中间区域及C端的Toll区,在传递上游信息和疾病发生发展中具有重要的作用[1]。耶鲁大学医学院Michael等[2]通过对MyD88与紫杉醇对卵巢癌(epithelial ovarian cancer,EOC)细胞敏感性关系的研究发现,MyD88的表达与EOC细胞对紫杉醇的耐药性相关,在EOC细胞中诱导MyD88表达后可明显抑制紫杉醇诱导的细胞凋亡,其对卵巢癌人群癌组织进一步检测发现,癌组织中表达MyD88患者的平均复发时间为23个月,而不表达MyD88的平均复发时间为42个月[2],因此,提出在卵巢癌中MyD88分子可能是紫杉醇的耐药标志之一[2]。目前在其他肿瘤中,MyD88分子是否能做为紫杉醇的耐药标志物,国内外尚未见报道。本研究通过脂质体转染的方法上调胃癌细胞BGC823中MyD88的表达水平,检测转染前后细胞对紫杉醇的耐药性的变化,Caspase-3的活性、细胞周期及凋亡情况的变化,探讨MyD88基因与胃癌细胞BGC823细胞对紫杉醇耐药性的关系。
1 材料和方法
1.1 试剂 紫杉醇(paclitaxel)购于美国Sigma公司;PolyFect转染试剂购于Qiagen公司;RPMI 1640培养液购于美国Gibco公司;Casepase-3活性检测试剂盒及Bradford蛋白浓度测定试剂盒购于碧云天生物技术研究所;BGC823细胞株购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。GAPDH和MyD88上、下游引物和探针由上海闪晶生物公司设计并合成,MyD88上游引物序列5’-ATTTGCACTCAGCCTCTCTCCA-3’,下游引物序列5’-CGAGTCCAGAACCAAGATTTGG-3’;MyD88探针序列:5’-fam-TGTCTGCGACTACACCAACCCCTGC-tamra-3’;GAPDH上游引物5’-CCACTCCTCCACCTTTGAC-3’,5’-ACCCTGTTGCTGTAGCCA-3’,GAPDH探针:5’-fam-TTGCCCTCAACGACCACTTTGTC-tamra-3’。
1.2 MyD88基因的克隆及表达质粒的构建为获得正确序列的MyD88基因,本研究选取正常细胞株人晶体上皮细胞(lens epithelial cell,LEC)作为基因克隆的模板。收集LEC细胞约1×107个,TRIzol一步法提取细胞总RNA。反转录合成cDNA第一链。取2 μL反转录产物,以MyD88-1(5’-ACGGATCCGCCATGGCTGCAGGAGGTCC-3’)和MyD88-2(5’-GCGAATTCGGGCAGGGACAAGGCCTTG-3’)为上、下游引物进行PCR扩增。将PCR产物与pMD18-T载体连接并转化到埃希菌DH5α中,将筛选到的阳性克隆,送上海申能博彩生物科技有限公司测序鉴定,将测序正确的载体命名为pMD18-T-MyD88。提取pMD18-T-MyD88质粒,双酶切胶回收后将MyD88基因插入到pCDNA3.0中构建重组质粒pCDNA3.0-MyD88,并转化入埃希菌DH5α中筛选重组子。重组表达质粒经双酶切验证,验证正确的表达质粒命名为 pCDNA3.0-MyD88。
1.3 脂质体转染及细胞筛选 将胃癌细胞BGC823以4×105个/孔的细胞密度接种到6 孔细胞培养板,置于37 ℃、CO2体积分数为5%的培养箱中培养过夜,第2天待细胞融合度达40%~80%时,开始转染。实验组取重组质粒pCDNA-MyD88 1.5 μL用于转染,对照组为不加质粒的脂质体。转染24 h后换新鲜培养液,并加入500 μg/mL的G418筛选阳性细胞,2周后即可挑取单克隆。
1.4 实时荧光定量PCR检测MyD88 mRNA 的表达 TRIzol一步法提取细胞总RNA,定量后取RNA反转录为cDNA。采用荧光定量PCR法检测MyD88 mRNA 的表达,以GAPDH基因为内参照,反应体系25 μL,样品管和内参管均设复管。反应条件为:94 ℃预变性 2 min,94 ℃30 s、60 ℃ 30 s,共40个循环,采用ABI7300全自动荧光定量PCR仪(美国ABI公司)进行PCR检测。反应结束后,采用ABI 7300 SDS Software自动分析荧光信号并将其转换Ct值。Ct值取3个复管的平均值。
每个样本靶基因(检测基因)的相对mRNA表达水平,能直接用样品各自的内参照GAPDH表达来标准化加入的初始RNA量。即每个样品的靶基因的相对mRNA表达水平可以用以下公式计算:相对mRNA表达=2一△△Ct,△Ct值=Ct靶基因值-CtGAPDH值。△△Ct值=△Ct实验组值-△Ct对照组值。通过比较,可间接反映各组模板的起始拷贝数之间的关系。ΔCt值越小表明MyD88的表达量越高。
1.5 耐药性实验 将处于对数生长期的转染组及对照组BGC823细胞以7×103个/孔的细胞密度接种于96 孔培养板中,置于37 ℃、CO2体积分数为5%的培养箱中,培养24 h后分别加入0.01、0.1、1和10 μmol/L的紫杉醇,加药处理24 h,以未加药组为对照组,各组细胞均设7个平行孔。采用MTT法检测细胞的生长抑制率及IC50。
1.6 流式细胞术检测紫杉醇对转染MyD88基因的胃癌BGC823细胞周期的影响 取对数生长期细胞按2×106个细胞/mL的细胞密度接种于6孔板,每孔接种3 mL,24 h后依据上述IC50值分组加药即阴性对照组(未加药组)和加药组,每组设3个复孔;分别继续培养24和48 h后,收集细胞,依照凯基细胞周期及凋亡检测试剂盒操作步骤进行,最终每个样品收集1×105个细胞,上流式细胞仪检测。试验重复3次,CellQuest软件进行分析,测定DNA含量和亚二倍体峰在细胞周期所占百分比。
1.7 Caspase-3活性检测 取对数生长期细胞按2×106个/mL的细胞密度接种于6孔板,每孔接种3 mL,24 h后依据上述IC50值分组加药,即阴性对照组(未加药组)和加药组,每组设3个复孔;分别继续培养24和48 h后,收集细胞,PBS清洗2次,细胞计数。每2×106个细胞加入100 μL裂解液,重悬沉淀,冰浴裂解15 min。4 ℃,12 000 rpm离心10 min,取上清液检测。
1.8 统计处理 采用EXCEL进行统计分析,计量数据均用表示,对照组和实验组之间的差异行单因素方差分析,2组间均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 转染效果鉴定 采用实时荧光PCR法检测转染前后BGC823细胞中MyD88 mRNA表达水平。结果表明,与对照组相比,胃癌细胞BGC823转染pcDNA3.0-MyD88质粒后, MyD88 mRNA表达水平显著上升,差异具有显著性的统计学意义(P<0. 01,表1,图1)。
表1 胃癌细胞BGC-823转染质粒后MyD88 mRNA表达量与相应GAPDH mRNA表达量的比值Tab.1 The ratio of MyD88 mRNA and GAPDH mRNA in cell transfected BGC823(n=8, )
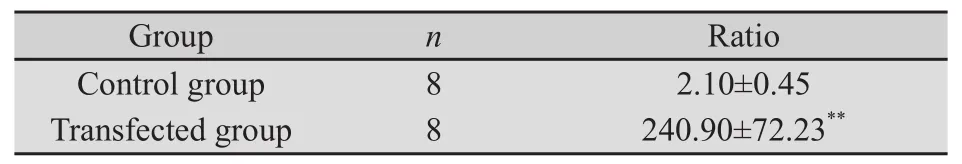
表1 胃癌细胞BGC-823转染质粒后MyD88 mRNA表达量与相应GAPDH mRNA表达量的比值Tab.1 The ratio of MyD88 mRNA and GAPDH mRNA in cell transfected BGC823(n=8, )
**: P<0.01, compared with the control group.
2.2 MyD88对紫杉醇耐药性的影响 分别用1、10和100 nmol/L的紫杉醇作用于转染的BGC-823细胞24 h。结果表明,与对照组相比,紫杉醇对转染后的胃癌细胞BGC823的抑制率显著下降,说明提高MyD88表达水平增加了BGC-823细胞对紫杉醇的耐药性(图2)。对照组IC50为26.8 mmol/L,转染组IC50为116.6 mmol/L。
2.3 紫杉醇对转染MyD88基因的胃癌BGC823细胞周期的影响 将10 nmol/L紫杉醇作用转染MyD88基因的胃癌BGC823细胞24 h,通过流式细胞术检测其细胞周期的变化。结果表明,经紫杉醇作用后,对照组BGC823细胞凋亡率从0.37%上升到14.53%,G2/M期细胞由对照的13.69%增加到73.03%;实验组(转染组)MyD88的BGC823细胞凋亡率从2.68%上升到9.28%,G2/M期细胞由对照的16.45%增加到70.66%,均出现了明显的G2/M期阻滞(P<0.01)。与对照组相比,转染MyD88的胃癌BGC-823细胞在紫杉醇作用24 h后,凋亡率小于紫杉醇处理的未转染对照组,具有极其显著的差异(P<0.01)。但与对照组相比,紫杉醇未对转染MyD88的胃癌BGC823细胞周期分布产生影响(P>0.05,图3,表2)。
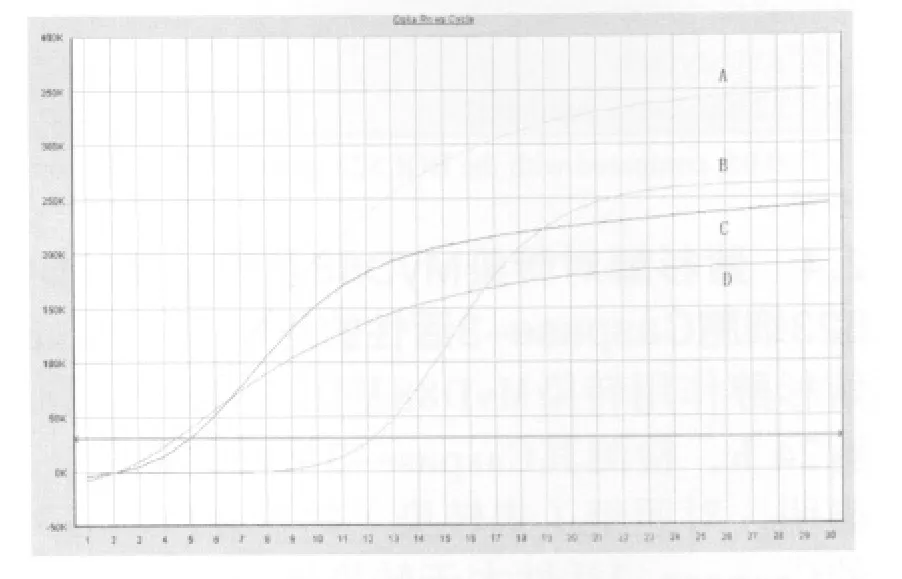
图1 Real time-PCR检测胃癌细胞BGC823转染质粒前后MyD88 mRNA与GADPH mRNA的表达情况Fig.1 The expression level of MyD88 and GAPDH mRNA after the transfection of plasmid in BGC823 by using Real-time PCR
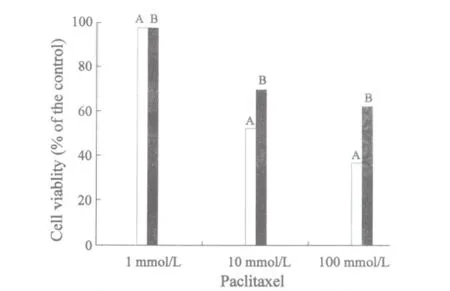
图2 MyD88对紫杉醇耐药性的影响Fig.2 The relationship between MyD88 and the resistance of paclitaxel

图3 紫杉醇对BGC823细胞周期和凋亡影响Fig.3 Effect of paclitaxel on the rate of apoptosis and cycle of BGC823 cells
表2 紫杉醇对BGC823细胞周期和凋亡影响Tab.2 Effect of paclitaxel on the rate of apoptosis and cycle of BGC823 cells(n=8, )

表2 紫杉醇对BGC823细胞周期和凋亡影响Tab.2 Effect of paclitaxel on the rate of apoptosis and cycle of BGC823 cells(n=8, )
*: P<0.05, compared with the BGC823 group; **: P<0.01, compared with the BGC823 group; △△: P<0.01, compared with the BGC823+paclitaxel group.
2.4 紫杉醇对转染MyD88基因的胃癌BGC-823细胞Caspase-3活性的影响 将10 nmol/L紫杉醇作用转染MyD88基因的胃癌BGC823细胞24 h,检测其Caspase-3活性的变化。结果表明,对照组(未转染)的胃癌BGC823细胞的Caspase-3活性大于转染MyD88基因的胃癌BGC823细胞的Caspase-3活性,差异有显著的统计学意义(P<0.01)(表3)。

表3 紫杉醇对BGC823细胞Caspase-3活性的影响Tab.3 Effect of Paclitaxel on the activity of Caspase-3
3 讨 论
Michael等[2]对美国24例Ⅲ/Ⅳ期卵巢癌患者癌组织及EOC细胞进行MyD88、NF-κB蛋白和Caspase-3/7凋亡蛋白检测,以及通过MyD88与紫杉醇对EOC细胞敏感性关系的研究发现,MyD88的表达与EOC细胞对紫杉醇的耐药性相关,在EOC细胞中诱导表达MyD88后可明显抑制紫杉醇诱导的细胞凋亡。Michael等[2]对卵巢癌术后复发人群癌组织中MyD88的检测还发现,癌组织中表达MyD88患者的平均复发时间为23个月;而不表达MyD88的平均复发时间为42个月。因此,Michael等[2]提出MyD88分子是紫杉醇的耐药标志。由于MyD88是TLR信号通路中的一个关键衔接分子,Michael等[2]认为MyD88的表达水平上调后通过TLR信号通路促进了NF-κB的激活,诱导了一些抗凋亡蛋白的表达,从而抑制了Caspase-3的活化,减少了细胞凋亡。如果胞内没有MyD88,或者表达量很低,那么NF-κB活化减少,抗凋亡蛋白相应减少,就不足以阻止细胞的凋亡。Wang等[3]和Ikebe等[4]也进一步证明MyD88的表达水平与卵巢癌细胞对紫杉醇的耐药性相关。
紫杉醇是从天然植物红豆杉属树皮中提取的单体双萜类化合物,具有良好的抗癌活性,尤其对转移性卵巢癌有十分显著的疗效。在细胞分裂时,紫杉醇能与细胞微管结合,使细胞内形成稳定的微管束,以干扰细胞周期的G2期有丝分裂,从而抑制肿瘤细胞的生长[5]。
本研究通过提高胃癌细BGC823 MyD88的表达水平,发现胃癌细胞对紫杉醇耐药性明显提高,凋亡蛋白Caspase-3的活性明显降低,而细胞凋亡率明显下降,说明MyD88表达量的提高能够增强胃癌细胞BGC823对紫杉醇的耐药性,与Michael等[2]提出的在卵巢癌中MyD88分子对紫杉醇存在耐药性相符。目前的报道仅显示MyD88的表达水平与肿瘤细胞对紫杉醇的耐药性有关,是否其表达水平与他药物的耐药性有关,目前还未见报道。综上所述,MyD88能提高胃癌细胞BGC823对紫杉醇的耐药性,减缓细胞凋亡。在胃癌细胞BGC823中,MyD88分子也可能是紫杉醇的耐药标志。
[1] 徐世军, 沈映君. TLR信号途径关键转接分子MyD88的研究进展[J]. 中华中医药学刊, 2007, 25(12): 2504-2506.
[2] Kelly MG, Alvero AB, Chen R, et al. TLR-4 signaling promotes tumor growth and paclitaxel chemoresistance in ovarian cancer[J]. Cancer Res, 2006, 66(7): 3859-3868.
[3] Wang AC, Su QB, Wu FX, et al. Role of TLR4 for paclitaxel chemotherapy in human epithelial ovarian cancer cells[J].Eur J Clin Invest, 2009, 39(2): 157-164.
[4] Ikebe M, Kitaura Y, Nakamura M, et al. Lipopolysaccharide(LPS) increases the invasive ability of pancreatic cancer cells through the TLR4/MyD88 signaling pathway[J]. J Surg Oncol, 2009, 100(8): 725-731.
[5] Janssens S, Beyaert R. A universal role for MyD88 in TLR/IL-1R-mediated signaling[J]. Trends Biochem Sci, 2002,27(9): 474-482.
[6] 戎云霞, 颜文才, 顾根网, 等. 紫杉醇在卵巢癌治疗中的应用[J]. 中国医院用药评价与分析, 2006, 21(06): 380-384.

