氮素浓度对黄檗幼苗生长及氮代谢相关酶类的影响1)
李 霞 阎秀峰
(吉林师范大学,四平,136000) (东北林业大学)
氮素在植物营养生理中有很重要的作用,供氮水平可通过影响氮代谢关键酶活性而影响植物的生长、发育以及对环境的适应[1-3]。氮素供应水平对植物体内的硝酸还原酶(NR)和谷氨酰胺合成酶(GS)活性有不同程度的影响;也在一定程度上影响可溶性蛋白含量,而可溶性蛋白大部分为参与各种代谢的酶类,是植物体内贮藏氮的主要形式,其中绝大多数是卡尔文循环中最关键的酶,在植物的光合作用、生长发育及植物生物量的建成中起着重要作用[2-3]。黄檗(Phellodendron amurense)为芸香科(Rutaceae)黄檗属(Phellodendron)植物,是东北阔叶红松林的重要伴生树种,也是我国名贵中药黄柏的药源植物,其内皮(韧皮部)入药,称为关黄柏。近年来,笔者就黄檗中主要生物碱的分布规律和部分环境因子对黄檗中主要生物碱含量的影响、氮素形态对黄檗幼苗主要生物碱及氮代谢关键酶活性的影响等作了一些研究工作[4-6]。研究了不同氮素水平对当年生黄檗幼苗叶片中氮代谢关键酶活性的影响,为明确氮素对黄檗生长及一些生理过程的影响,确定黄檗生长所需的最佳氮素条件,以便进一步探讨黄檗生长与主要药用成分含量均佳的氮肥管理与调控。
1 材料与方法
黄檗幼苗在阳光温室内培养,温室为自然采光,温度控制在18~30℃,水培容器为长50 cm、宽37 cm、高13 cm的塑料盆,上覆具孔泡沫板用于黄檗幼苗的固定。从苗圃选取生长一致的1年生黄檗幼苗,先以自来水培养2d,再浇灌氮素浓度为8 mmol/L的正常营养液,以使幼苗生长健壮。完全营养液主要按Ultriainen等[7]方法配制,但略加修改:NH4NO34 mmol/L、KH2PO41 mmol/L、KC1 1 mmol/L、CaCl2-6H2O 1 mmol/L、MgSO4-7H2O 0.6 mmol/L、FeCl3-6H2O 0.02 mmol/L、MnCl2-4H2O 6 μmol/L、H3BO30.016 mmol/L、ZnCl20.3 μmol/L、CuCl2-2H2O 0.3 μmol/L、Na2MoO4-2H2O 0.3 μmol/L。在完全营养液基础上,通过改变NH4NO3的量调配出5种营养水平的氮素处理液,既1、4、8、16和32 mmol/L。每天用0.1 mmol/L的KOH和HCl将营养液pH值调至6.0左右。每个处理设3次重复,营养液3 d更换1次,全天用泵通气,并相应地补充损失的水分。
处理后每隔10 d分别采集黄檗幼苗顶端完全展开的第1片成熟叶片,并进行各项生理指标的测定,每重复5株。硝态氮和铵态氮测定参照Richardson[8]方法,可溶性蛋白含量采用考马斯亮兰比色法测定[9],NR 的测定采用活体法[10-11],GS的测定参照Miflin[12]的方法,用紫外可见分光光度计测定吸光值。处理后第50天,测量黄檗幼苗的株高、茎直径(基部)、单株生物量,并重复8株。所得数据用SAS 8.1 for Windows进行统计分析,用方差分析检验差异显著性。
2 结果与分析
2.1 氮素浓度对黄檗幼苗生长的影响
氮素浓度不同对黄檗幼苗的生长影响明显。表1是处理结束时(第50天)黄檗幼苗的生长状况。可以看出,随着营养液氮素浓度的升高,黄檗幼苗的株高、茎直径和全株生物量逐渐升高,16 mmol/L处理达到最大值,当氮素浓度升高到32 mmol/L时,株高、茎直径和全株生物量都比16 mmol/L时的最大值略有下降,但两者差异不显著。氮素浓度为16 mmol/L时黄檗幼苗的生长状况最好,而氮素浓度为1 mmol/L时,黄檗幼苗的生长状况最差。
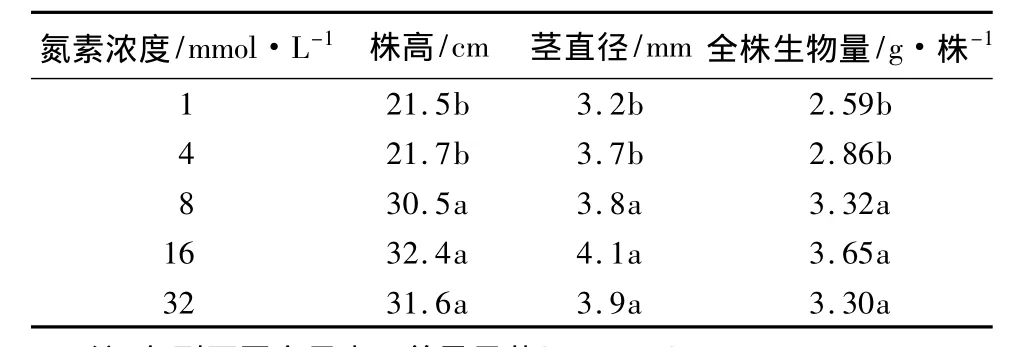
表1 不同氮素浓度下黄檗幼苗的生长状况
2.2 氮素浓度对黄檗幼苗叶片中铵态氮、硝态氮及可溶性蛋白质量分数的影响
随着处理时间的延长,氮素浓度较高的16和32 mmol/L 2个处理铵态氮质量分数略高于其他处理,而这2个处理间无明显差异;1和4 mmol/L 2个处理随着处理时间增加铵态氮质量分数明显下降;8 mmol/L处理铵态氮质量分数变化不大,只在后期略有增加。在处理第50天,氮素浓度较高的处理铵态氮质量分数相对较高,但不是完全的对应关系(表2)。在氮素处理20 d时,各处理黄檗幼苗叶片中硝态氮质量分数都有升高的趋势,然后逐渐下降趋于稳定。从处理第30天后测定的结果表明,培养液氮素浓度增加,硝态氮质量分数有升高的趋势,在16和32 mmol/L 2个处理硝态氮质量分数明显高于1、4和8 mmol/L 3个处理,但两者之间差异不显著,1、4和8 mmol/L 3个处理间差异也不显著,见表2所示。可见,培养液氮素浓度的变化不同程度地影响了黄檗幼苗中铵态氮和硝态氮的质量分数,总体看,虽然不是完全的对应关系,但基本上是氮素浓度升高,叶片中铵态氮和硝态氮的质量分数也较高。
在处理的前20 d,氮素浓度对黄檗幼苗叶片中可溶性蛋白质量分数的影响不明显,从处理的30d后,氮素浓度为8、16和32 mmol/L的3个处理,可溶性蛋白质量分数升高幅度较大,在处理后期,16和32 mmol/L的2个处理明显高于其他处理,但两者之间无显著差异;其他3个处理是氮素浓度越高,可溶性蛋白质量分数越高。可见,氮素浓度升高在一定程度上可提高黄檗幼苗叶片中可溶性蛋白质量分数,但当升高到一定程度时,可溶性蛋白质量分数不会继续升高,见表2。
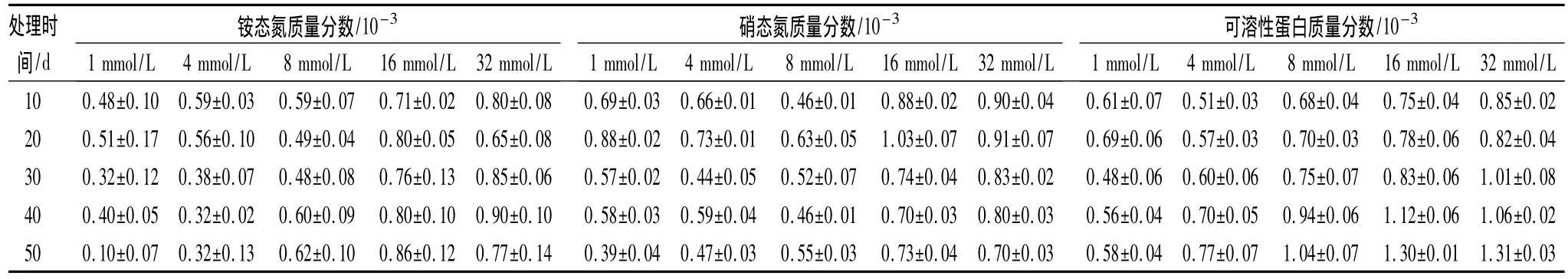
表2 不同氮素浓度下黄檗幼苗叶片铵态氮和硝态氮质量分数
2.3 氮素浓度对黄檗幼苗叶片中NR和GS活性的影响
由表3可见,在处理的最初阶段,氮素浓度对黄檗幼苗叶片中NR的影响较大,各处理间的差异较大,表现为氮素浓度越高NR活性越强。在处理的20 d后,8、16和32 mmol/L的3个处理NR活性波动较小,在处理后期都略有下降,3者差异不明显。1、4 mmol/L 2个处理NR活性波动较大,且都明显低于其他3个处理,两者差异不显著。氮素浓度对GS活性的影响与NR比较相似,在整个氮素处理的过程中,基本上是氮素浓度越高,GS活性越强,但不完全对应,比较显著的特征是8、16和32 mmol/L 3个处理GS活性比较相似,显著高于1、4 mmol/L这2个处理,而3者之间差异不显著,1、4 mmol/L 2个处理之间差异也不显著,见表3所示。
总体看,氮素浓度升高,可在一定程度上提高中NR和GS的活性。
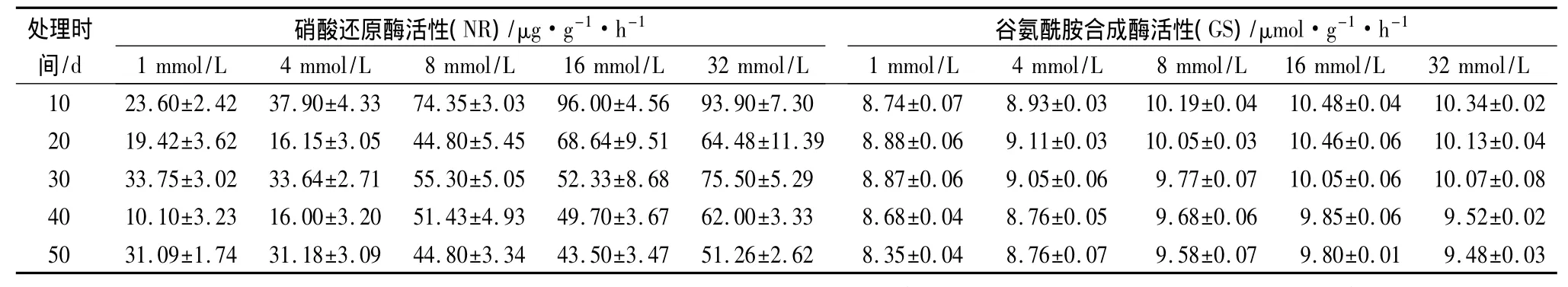
表3 不同氮素浓度下黄檗幼苗叶片NR和GS活性
3 结论与讨论
氮素作为重要的营养因子对树木生物量的限制作用尤为明显。可溶性蛋白大部分为参与各种代谢的酶类,是植物体内贮藏氮的主要形式,供氮水平可在一定程度上影响可溶性蛋白质质量分数,进而反映供氮对植物生长发育和代谢的影响。从本文的结果来看,1 mmol/L处理可溶性蛋白质量分数最低,且生物量也最低,说明缺氮可能导致氮素同化能力减弱,光合产物流向氮素代谢、用于NH3同化为氨基酸和蛋白质的相对较少。16和32 mmol/L的2个处理可溶性蛋白质量分数明显高于其他处理,但两者无明显差异,这也与生物量的变化相同,说明随着氮素水平的增加和氮素同化能力的增加,越来越多的光合产物流向氮素代谢,因而叶片中可溶性蛋白质质量分数增加。但由于黄檗幼苗的氮素同化能力有限,过量的供氮可能引发营养失衡,根系为抵御高氮胁迫,必须提高呼吸强度来尽量适应旱育环境,引起细胞早衰,生长受到严重限制,最终造成膜伤害[13]。所以只有供氮水平适宜,才能最大限度提高氮素利用率。
植物获取氮素营养包括吸收、转运和同化3个主要过程,即 NO-3和 NH+4的吸收转运、NO-3被 NR 还原为 NH+4,NH+4被谷氨酰胺合成酶/谷氨酸合酶(GS/GOGAT)同化为谷氨酸和谷氨酰胺,NR是一种诱导酶,为硝态氮同化的限速酶,其活性取决于介质中的NO-3浓度。在一定范围内,植物体内的NO-3浓度与NR的活性呈正相关,且NR只有在NO-3溶液中经过一段时间的诱导才能逐步形成。近年也有研究表明,即使同一物种,不同品种间的NR活性并非只受硝态氮的激活。中筋小麦豫麦49在施用铵态氮时,GS和GOGAT活性增强的同时,NR活性也有较大增强[14]。本试验结果表明,黄檗叶片中NR活性明显受供氮水平高低的影响,营养液供氮水平的提高,叶片中NR活性增加,并表现出了与黄檗叶片中硝态氮质量分数相似的变化趋势,从而再度证明,谷氨酰胺合成酶(GS)是NH+4同化过程中的一个关键酶,参与多种氮代谢的调节,是氮代谢中心的多功能酶。目前,尚不清楚对GS基因表达及活性起刺激信号的作用是NO-3还是其同化产物。
[1] 张福锁,樊小林,李晓林.土壤与植物营养研究新动态:第2卷[M].北京:中国农业出版社,1995:42-69.
[2] Inokuchi R,Kuma K,Miyata T,et al.Nitrogen-assimilating enzymes in land plants and algae phylogenic and physiological perspectives[J].Physiol Plantarum,2002,116:1-11.
[3] Wang Y H,Garvin D F,Kochian L V.Nitrate-induced genes in tomato roots.Array analysis reveals novel genes that may play a role in nitrogen nutrition[J].Plant Physiol,2001,127:345-359.
[4] 李霞,刘剑锋,阎秀峰.氮素形态对黄檗幼苗三种生物碱含量的影响[J].生态学报,2005,25(9):2159-2164.
[5] 李霞,阎秀峰,刘剑锋.氮素形态对黄檗幼苗生长、氮代谢相关酶类的影响[J].植物学通报,2006,23(3):255-261.
[6] 李霞,杨立学,阎秀峰.一年生黄檗幼苗药用生物碱的分布及其含量变化[J].东北师大学报:自然科学版,2006,38(2):101-104.
[7] Ultriainen J,Holopainen T.Nitrogen availability modifies the ozone responses of Scots pine seedlings exposed in an open-field system[J].Tree Physiol,2001,21:1205-1213.
[8] Richardson M,Cabrera R I,Murphy J A,et al.Nitrogen-form and endophyte-infection effects on growth,nitrogen uptake and alkaloid content of chewings fescue turfgrass[J].J Plant Nutr,1999,22:67-79.
[9] Baricevic D,Umek A,Kreft S,et al.Effect of water stress and nitrogen fertilization on the content of hyoscyamine and scopolamine in the roots of deadly nightshade(Atropa belladonna)[J].Environ Exp Bot,1999,42:17-24.
[10] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003:41-67.
[11] 周树,郑相穆.NR体内分析方法的探讨[J].植物生理学通讯,1985(1):47-49.
[12] Miflin B J,Lea P J.Ammonia metabolism[J].Annual Review of Plant Physiology,1977,28:288-329.
[13] 王强盛,丁艳锋,严定春,等.不同施氮量对水稻旱育秧苗形态特征和生理特性的影响[J].南京农业大学学报,2004,27(3):11-14.
[14] 王小纯,熊淑萍,马新明,等.不同形态氮素对专用型小麦花后氮代谢关键酶活性及籽粒蛋白质含量的影响[J].生态学报,2005,25(4):802-807.

