杨梅控根容器苗的光合及生理特性研究
宋其岩1,2,杜国坚2*,陈友吾2,翁永发3,戴慈荣4,管兴暖5,赵彩芳2
杨梅控根容器苗的光合及生理特性研究
宋其岩,杜国坚,陈友吾,翁永发,戴慈荣,管兴暖,赵彩芳
(1. 浙江林学院林业与生物技术学院,浙江 临安 311300;2. 浙江省林业科学研究院,浙江 杭州 310023;3. 浙江省衢州市林业技术推广站,浙江 衢州 320024;4. 浙江省开化县林场,浙江 开化 324300;5. 浙江省三门县健跳镇林业站,浙江 三门 317100)
以杨梅()1年生嫁接苗为试验材料,测定杨梅容器育苗在控根和不控根条件下的生长状况、生理特性及其光合作用指标。研究表明:杨梅控根容器苗的高生长、生物量积累都较普通容器苗有显著提高;其叶绿素、可溶性糖和淀粉含量较普通容器苗显著升高;其光合日进程与普通容器苗表现出相似的趋势,都呈现双峰型曲线;比较控根容器苗与普通容器苗的光响应曲线,控根容器苗具有较高的光饱和点和较低的光补偿点,说明其光能利用范围较宽,光合效能较高。
杨梅;控根容器苗;生理特性;光合作用
杨梅()为杨梅科杨梅属常绿树种,中国特有果树,栽培利用历史悠久。杨梅栽培主要分布在97° ~ 122° E、18° ~33° N,经济栽培主要集中在浙江、江苏、福建、广东、江西、安徽、湖南、贵州等省,四川、云南、广西、陕西、海南等省有少量栽培。杨梅具有较高的经济价值,同时与放线菌共生形成根瘤具有天然固氮能力,是经济价值与生态价值兼有的树种。
控根容器育苗是一种以调控根系生长为核心的新型快速育苗技术,主要由三个部分组成:控根容器、基质配制和配套管理技术。控根容器是控根育苗技术的核心,其在防止根腐病和主根的盘绕以及侧根“气剪”(空气修剪)方面有独特的效果。通过对植物根系的空气修剪,可以促使植物在根尖后部萌发出数倍以上新根继续向外向下生长,根的总量较大田育苗和普通容器苗均可提高若干倍。澳大利亚和中国对白皮松、油松、榆树、国槐、女贞、梧桐等树种进行了控根容器育苗试验,其苗木成活率、生长速度、保存率均较普通容器育苗有大幅度提高。本试验把控根育苗技术应用于杨梅嫁接幼苗的培育,观察测定杨梅幼苗的生长、生理及光合作用,比较分析控根容器苗与普通容器苗的差异,以期为今后控根容器育苗技术在杨梅等经济树种苗木生产上的推广应用提供科学依据。
1 材料与方法
1.1 试验材料
于2008年4月上旬,选取长势较一致的1年生东魁杨梅嫁接苗,分别采用控根容器和普通容器盆栽于浙江省林业科学研究院苗圃内。盆栽基质的配制比例为泥炭:V:V:V:V= 2:2:1:2.3:2.7,此比例较适合杨梅生长,基质的pH为5.5,容重为0.684 g/cm。采用完全随机实验设计,将所选杨梅分成2个处理:T—控根容器培育,T—普通容器培育。每个处理10株,重复3次。采用相同的管理措施。控根容器与普通容器的体积基本相同,分别是7 850 cm和7 348 cm。中午光照强烈时加遮荫网以免太阳灼伤。
1.2 测定指标及方法
2009年5月下旬分别进行各项指标的测定,其中生长参数的测定,分别采用钢卷尺测定苗高、主根长。
生理指标的测定为:①可溶性糖:蒽酮比色法;②淀粉:蒽酮比色法;③叶绿素含量:丙酮乙醇浸提法。
于2009年5月下旬选择晴朗的天气采用Li-6400光合测定系统进行净光合速率()日变化的测定,分3次进行,每隔1 h测定1次,为消除时间上的误差,每次重复测定时各处理间采用随机测定的方法。
于2009年5月下旬分3次进行光合作用—光响应曲线测定:采用Li-6400-02B红蓝光源,在光照强度梯度为2 000、1 500、1 000、500、200、150、100、80、50、0 μmol·m·s条件下测定相应值。测定时CO浓度、温度、湿度等均以外界环境为准。根据非直线双曲线模型求出各品种的最大净光合速率(P)、表观量子效率()和暗呼吸速率()。将PAR在0 ~ 200 μmol·m·s范围内的值进行直线回归分析,求出光补偿点()和光饱和点()。试验数据采用Excel进行整理计算和绘图,采用SPSS13.0进行统计分析。
2 结果与分析
2.1 不同育苗容器对杨梅生长的影响
控根容器主要通过调节植株根系的生长情况进而影响其整体生长。试验中观察到控根容器苗形成根团的时间明显早于普通容器苗,而且其根系生长蓬松舒展,体积明显大于普通容器苗。普通容器苗的主根呈暗黑色无光泽,控根容器苗的主根呈浅褐色且有光泽。由表1可以看出,T和T的主根长分别为25.01 cm和17.52 cm,其差异达到极显著水平(P < 0.01)。侧根的数量对于苗木移植后的成活率及以后的生长情况起着决定性的作用。T和T的侧根数分别为15.70条/株和8.50条/株,采用控根容器培育的杨梅在侧根数上显著大于普通容器育苗(P < 0.01),较多的侧根数量可以有效缩短杨梅造林后的恢复时间。
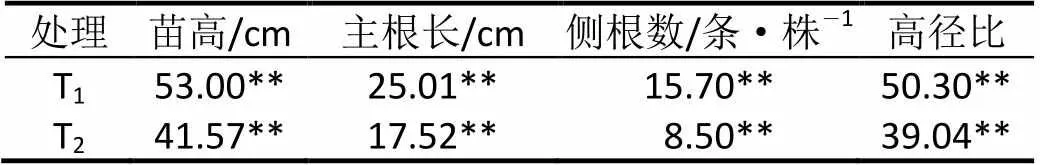
表1 不同处理对杨梅生长的影响
注:表中数值为3次重复的平均值,*和**分别表示在0.05和0.01水平差异显著(下同)。
从表1可看出,T和T的苗高分别为53.00 cm和41.57 cm,其差异达到极显著水平(P < 0.01),这表明采用控根容器培育杨梅苗木的高生长明显的优于普通容器育苗。
容器苗的质量主要决定于其体内的营养状况(碳水化合物状况)和根团质量,地下干重、地上干重、根冠比是评定容器苗质量的主要指标。由表2中可以看出,T的枝干、叶片、根的干重分别是227.40、129.46和187.49 g;T的枝干、叶片、根的干重分别是120.26、63.99和136.15 g。控根容器培育杨梅在枝干、叶片、根的生物量上分别提高了89.10%、102.31%、37.71%。表明采用控根容器培育的杨梅各器官生物量都显著高于普通容器苗(P < 0.01),这主要是由于杨梅控根容器苗在侧根数量上占有明显的优势,增加了根系对营养成分的吸收面积。

表2 不同处理对杨梅生物量的影响
2.2 不同育苗容器对杨梅生理指标的影响
叶绿素作为植物光合作用的重要色素,参与光合作用过程中光能的吸收、传递和转化,叶绿素含量直接影响植物的光合能力。由表3可以看出,T和T的叶绿素含量分别为1.71 mg/g和1.30 mg/g,其差异达到极显著水平(p < 0.01)。

表3 不同处理对杨梅生理指标的影响
植株中碳水化合物的含量水平影响植株造林后的生长表现情况,叶片中的可溶性糖不仅是植物的主要光合产物,而且是碳水化合物贮藏和积累及其在植物体中运输的主要形式,其含量对植株的生长有着重要作用。可溶性糖的含量是评定容器苗的质量关键指标。T和T的可溶性糖含量分别为2.84 mg/g和2.28 mg/g,T和T的淀粉含量分别为1.35 mg/g和1.04 mg/g,其差异均达到极显著水平(P < 0.01),控根培育的杨梅光合作用合成碳水化合物的量明显高于普通容器,较高的碳水化合物含量可以提高杨梅容器苗移栽后的生长速度和质量。
2.3 不同育苗容器对杨梅光合指标的影响
2.3.1 不同育苗容器对杨梅净光合速率日进程的影响 由图1可以看出,T和T净光合速率日变化趋势基本一致,均为双峰型曲线。通过表4可以看出随着时间的推移,净光合速率快速升高,在8:30时,达到最高值3.52,然后逐渐降低;此后在光合有效辐射继续增强、温度上升的情况下,净光合速率反而下降,表现出明显的光抑制;14:30出现次高峰1.65,但是峰值明显的低于上午的高峰值,且低于6:30的值(2.1)。由此可见夏季杨梅的光合作用在上午较强,光合高峰在7:00-11:00,中午显著光抑制,下午虽有回升,但处于较低水平。其中午出现的光抑制现象是由于中午光照强、温度高、空气湿度低导致气孔部分关闭而引起的。
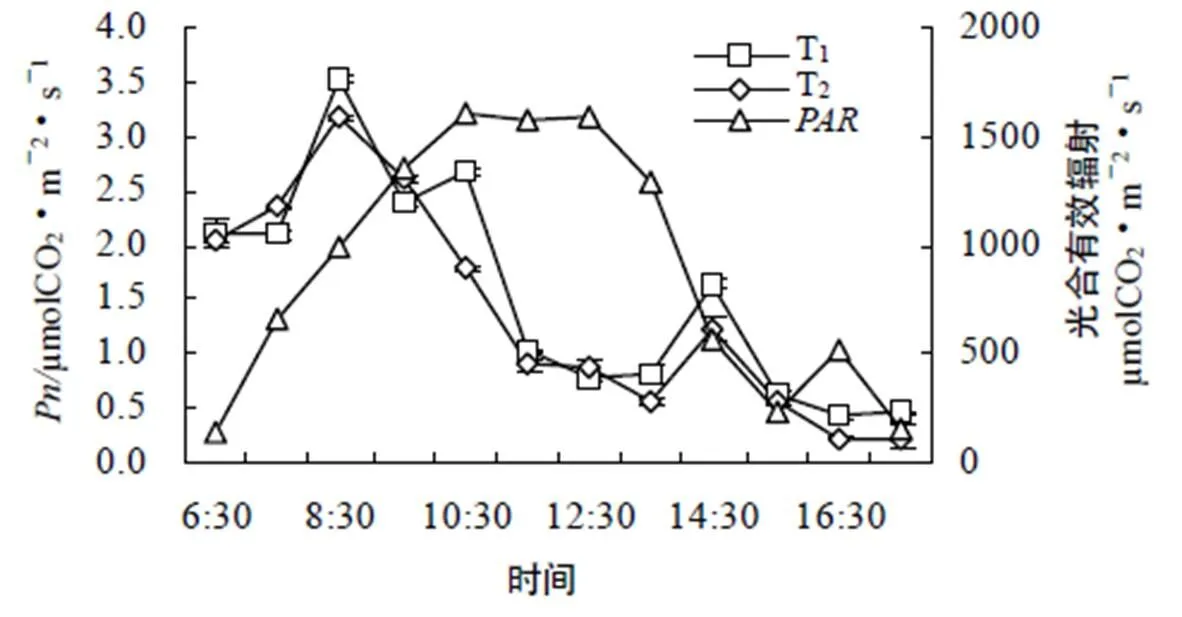
图1 杨梅净光合速率日变化
Figure 1 Diurnal changes in net photosynthetic rate ofseedling

表4 杨梅净光合速率的日变化
2.3.2 不同育苗容器对杨梅光响应的影响 由图2可以看出,采用不同容器培育的杨梅其-响应曲线呈相似的变化趋势。光饱和点与光补偿点可以作为植物需光特性的主要指标,用来衡量需光量。由表5可以看出,普通容器苗和控根容器苗的分别为235.95μmol·m·s和282.42μmol·m·s,两者间差异达到极显著(P < 0.01);其分别为51.47 μmol·m·s和32.50 μmol·m·s,两者间差异同样达到极显著水平(P < 0.01),这表明采用控根容器培育的杨梅对光能的利用范围比采用普通容器培育的杨梅宽。反映林木对光能的利用效率,值越大,其光响应曲线的初始斜率越大,其光能利用效率也越高,普通容器苗和控根容器苗的分别为0.019和0.022 COμmol·m·s,普通容器苗的显著小于控根容器苗(P < 0.05),说明采用普通容器培育的杨梅其光能利用效率较低。最大光合速率(P)可以反映叶片的光合潜能,T和T的分别是4.388 COμmol·m·s和4.476 COμmol·m·s,采用控根容器培育的杨梅与普通容器培育的杨梅其光合潜能无显著差异。在暗呼吸速率方面,二者也无显著差异。

实测数据, 拟合曲线
Figure 2 Response of Pn to PAR ofseedling

表5 杨梅光合特性
3 结论和讨论
植物根系具有吸收、合成、分泌和感知等多种重要的生理功能,任何影响根系生长的环境因子和栽培措施都会影响整个植株的生长发育。研究表明,与普通容器育苗相比,杨梅控根容器苗根系分支增多,侧根量明显增大,植株根系密度大大提高,根系舒展主根未出现“窝根”现象,最大程度上提高了土壤空间、水分、肥料的利用率,为杨梅的生长发育提供了良好的环境条件。
可溶性糖的含量是评定容器苗质量诸因素中的关键指标。杨梅叶片中的可溶性糖含量有其固有的变化规律,但同时也受到外界因素的影响。研究表明控根容器培育的杨梅其可溶性糖含量显著高于普通容器苗,控根容器透气性较好促进植株根系生长的同时控根容器苗的叶绿素含量较高,所以在碳水化合物的合成量上与普通容器苗存在较明显的差异。这与控根容器影响牡丹、枫杨和苦楝各项生理指标的研究结果基本一致。
控根容器培育的杨梅净光合速率日变化在夏季表现为双峰型曲线,最大净光合速率出现在8:30,第二个峰值出现在14:30,其净光合速率比第一个峰值下降了53.13%,12:30-13:30出现光合“午休”现象。在整个日变化进程中控根育苗技术培育的杨梅总体Pn值比普通育苗方式的杨梅高,表现出较高的光合效能,这可能是控根育苗技术培育杨梅比普通培育方式培育杨梅生长旺盛的原因之一。控根育苗技术培育的杨梅具有较高的光饱和点282.42μmol·m·s和较低的光补偿点32.50μmol·m·s,说明采用控根育苗技术培育杨梅较普通育苗方式对光的利用范围较宽,其光合效能也更高,这可能也是控根育苗技术培育杨梅比普通培育方式培育杨梅生长旺盛的原因之一。
综上所述,控根容器苗在营养生长及生理和光合能力方面明显优于普通容器苗,所以有必要深入开展控根育苗技术在杨梅生产上的应用研究。本研究主要针对杨梅控根容器苗在苗期的生长状况、光合及生理特性研究,对控根容器苗上山造林后的成活率、生长情况还需要进一步跟踪调查、深入研究。此外,在研究过程中还发现,由于控根容器的四壁有孔,导致水分散失速度较快,夏天浇水量较大,因此杨梅控根育苗在不同季节的最佳浇水间隔时间、适宜浇水量以及滴溉等技术尚有待于深入研究。
[1] 康志雄,骆文坚,吕爱华,等. 杨梅栽培气候区划与应用研究[J]. 果树学报,2002,19(2):118-122.
[2] 谭晓庆,康丽华,康志雄,等. 杨梅弗兰克氏菌生物学特性研究[J]. 浙江林业科技,2008,28(5):33-36.
[3] 候满伟,高照良,郑振华. 控根育苗技术的特点及应用现状[J]. 陕西农业科学,2003(4):32-44.
[4] 李三玉. 浙江效益农业百科全书·杨梅[M]. 北京:中国农业科技出版社,2002. 18.
[5] 李合生. 现代植物生理学[M]. 高等教育出版社,2006(7):357-359.
[6] 邹琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2000. 110-114.
[7] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006. 74-77.
[8] S von Caemmerer. Biochemical models of leaf photosynthesis[M]. Australia:Csiro Publishing,2000. 29-90.
[9] Farquhar G D,S von Caemmerer,Berry J A. Models of photosynthesis[J]. Plant Physio,2001,125(1):42-45
[10] 许大全. 光合作用气孔限制分析中的一些问题[J]. 植物生理学通讯,1997,33(4):241-244.
[11] 葛永金,朱锦茹,江波,等. 容器苗质量评定指标研究[J]. 浙江林业科技,2006,26(1):10-12.
[12] 李延菊,李宪利,张序,等. 3个扁桃品种的光合特性[J]. 林业科学,2006,42(11):23-28.
[13] 钟全林,胡松竹,贺利中,等. 刨花楠不同种源主要光响应指标分析[J]. 林业科学,2008,44(7):118-123.
[14] Eissenstant D,Yanair D. The ecology of root life span[J]. Adv in Ecol Res,1997,27:1-6.
[15] 苏晶,徐迎春,潘易萍,等. 应用控根容器火箭盆培育牡丹嫁接苗的研究[J]. 江苏农业科学,2007,2:108-111.
[16] 曲良谱. 苦楝、枫杨容器育苗技术研究[D]. 南京:南京林业大学,2007.
Studies on Photosynthesis and Physiological Characteristics of Root-control Container Seedlings of
SONG Qi-yan,DU Guo-jian,CHEN You-wu,WENG Yong-fa,Dai Ci-rong,GUAN Xing-nuan,ZHAO Cai-fang
()
Determination was implemented on physiological and photosynthesis indicators of 1-yeargrafting container seedlings with and without root-control. The results showed that root-control container seedlings had larger height growth and biomass than common container ones, as well as chlorophyll, soluble sugar and starch content. Both diurnal change in net photosynthetic rate(Pn)of the two container seedlings was two-peak pattern. The light saturation point(LSP)of root-control container seedlings was significantly higher than that of common container ones, but its light compensation point (LCP)was lower, indicating that photosynthetic efficiency of root-control container seedlings was much higher than common container ones.
; root-control container seedlings; physiological characteristics; photosynthesis
1001-3776(2010)01-0032-04
S723.133
A
2009-09-09;
2009-12-08
宋其岩(1983-),男,山东泰安人,硕士研究生,从事森林培育研究;*通讯作者。

