离子反应在高考中的地位及难点突破——有感2009、2010江苏新高考
杨 勇
(南京市宁海中学 江苏 南京 210024)
一、离子反应在高考中的地位
离子反应是重要的化学用语,在中学阶段的基本概念基础理论知识中,占有极其重要的地位,贯穿于中学化学教材的始终,是中学化学教学的重点和难点之一。而元素及其化合物的知识,都会涉及离子反应及其方程式的书写。离子反应在江苏历年高考中都有比较重要的地位,是历年高考的热点,在高考中重现率达标100%。2008年新课程改革后江苏高考总分为120分,在2008年高考中离子反应占15分,比重为12.5%;2009年高考中离子反应占23分,比重为19.2%;在2010年高考中占14分,比重为11.7%。可见离子反应在高考中所占比重都比较大,是考生必须重视和掌握的基本技能。
二、离子反应在高考中的考查形式
在2009年江苏高考卷中,第7题、第11题、第12题、第16题、第18题,第 17题,2010年江苏高考卷中,第3题、第6题、第11题、第12题、第15题、第16题、第17题都考了有关离子反应的知识,其中有离子反应方程式的正误判断和书写、离子共存、电极反应的离子方程式的书写或判断等。
1.离子反应方程式的正误判断和离子共存
在历届高考中,选择题会以离子反应方程式的正误判断和离子共存两道题出现。在2009年江苏卷中第11题、2010年江苏卷中第3题,直接考了离子方程式的正误判断,这道题通常会对一些常见的书写离子方程式时所犯的错误进行考查,如反应不符合客观事实、物质的化学式不正确、漏掉某些离子反应、电荷不守衡、反应物或产物的配比不正确等常见错误。其中尤其注意的物质配比的问题,如碳酸氢钙与氢氧化钠的反应、氯气和溴化亚铁的反应等等,都需要掌握一定的方法。另外,在2010年江苏卷中第11题中也涉及了离子反应方程式判断。
在2009年江苏卷的第2题,2010年江苏卷中第6题,考查的是离子共存问题,如:发生复分解能生成沉淀、气体、弱电解质的不能大量共存;能发生氧化还原反应的不能大量共存;能发生强烈双水解不能大量共存。尤其要注意题干所给的条件:酸性条件;能使酚酞溶液变红;由水电离出的氢离子浓度为10-13mol/L;向溶液中加入金属铝能产生氢气;同时注意题目要求是一定、可能、不能大量共存,还要注意隐含硝酸的问题。
这两道题题型固定,一般教师会在二轮复习中重点训练,层次较好点的学生就可以做到不失分,但基础不牢的学生仍会犯错,所以在一轮复习中要抓好基础,二轮时再进行专题训练。
2.离子方程式的书写
在江苏高考卷二卷中,离子反应的考查经常以离子方程式的书写形式出现,而且新的题目层出不穷,往往并不局限于课本知识的考查,而是越来越着重学生能力的考查。
在2009年江苏卷中,考查形式虽然没有变化,但考查内容却对学生的能力要求有了进一步的提高,如在第17题第4小题中考查了制备CuCl的离子方程式,第18题的第2小题中考查了 pH≤2.0 时,CIO-2与 I-反应的离子方程式的书写,这两个反应在平常教学中并没有涉及到,需要学生根据离子方程式的书写方法和题目的信息来答题。更有挑战的是在离子方程式的书写中往往还会涉及到在方程式的前后添加氢离子或氢氧根离子的问题,有时不认真思考是难以判断的,不够细心或能力不够强的学生都会在此失分。
3.电极反应离子方程式的考查
在高考试题中,电极反应的书写或判断也是必考题型之一。电化学的知识学生本来就难以全部掌握,而电极反应的书写要求又更进一步。2009年江苏卷的第12题的B答案,2010年江苏卷中第11题的B答案,都是考查的原电池电极反应的正误判断,2009年江苏卷的第16题的第4小题考查了电解池的电极反应的书写。选择题中电极反应的考查,一般都不直接考查课本上的反应,而是考查一些新型电池中的电极反应,需要学生根据原电池的知识和离子反应的知识加以判断,一般判断的依据是:得失电子与正负极是否对应、添加的氢离子或氢氧根离子是否正确,同样书写的时候也要注意。而电解池的电极反应的书写主要也是这两方面的问题。
从学生答题情况来看,主要错误集中在氧化还原反应的离子方程式的判断和书写。很多同学没有掌握基本方法和步骤,在书写过程中无从入手,也很多同学在书写过程中没有注意到题目中给出的所有条件,在添加氢离子或氢氧根离子方面出错而前功尽弃。笔者主要对离子反应中的难点氧化还原反应离子方程式的书写方法进行分析。
三、离子反应的难点突破
1.氧化还原反应离子方程式的书写方法
在氧化还原反应的离子方程式中从守恒的对象来讲涉及离子范围最小的是得失电子守恒,其次是电荷守恒,涉及离子最多的是质量守恒。解决问题的次序应该是从小到大,先个体再整体。因此配平时的次序应该是先利用得失电子守恒配平,再利用电荷守恒配平,最后利用质量守恒配平。
(1)确定主要反应物和产物,根据化合价升降守恒初步配平
氧化还原反应离子方程式的书写一般已经确定氧化剂、还原剂,根据所学氧化还原反应知识以及题目信息能确定氧化产物和还原产物,或者根据题目所给信息判断氧化产物和还原产物,分列于生成符号两侧。这样就可以根据氧化还原反应的本质得失电子守恒初步配平。
示例一:2009年高考卷第17题(4)在提纯后CuSO4溶液中加入一定量的 Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是______ 。
首先:列出氧化剂、还原剂、氧化产物、还原产物
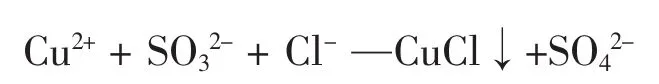
其次:根据化合价升价守恒初步配平:2Cu2++SO32-+2Cl-—2CuCl↓+SO42-
示例二:2009年高考卷第18题(2)①请写出pH≤2.0 时,ClO-2与 I-反应的离子方程式。
首先:列出氧化剂、还原剂、氧化产物、还原产物 ClO-2+I-—Cl-+I2
其次:根据化合价升价守恒初步配平ClO-2+4I-— Cl-+2I2
(2)根据溶液的酸碱性环境判断添加H+还是OH-
初步配平后后,根据信息判断出溶液酸碱性,决定添加H+还是OH-,但要注意酸性条件时H+不一定出现在反应物一侧,有可能在生成物一侧,一般要根据电荷守恒来加以判断,如酸性条件且左侧正电荷比较多,则应在右侧添加H+左侧添加H2O。最后根据质量守恒做最后的配平。
在示例一中硫酸铜应在酸性溶液中,应添H+,根据初步配平的方程式中左边多了2个正电荷,应在右边添加2个H+,再根据元素的质量守恒在左边添加1个H2O分子,从而得到:2Cu2++SO32-+ 2Cl-+H2O=2CuCl↓+SO42-+2H+, 最后用氧元素检查配平是否正确。
在示例二中根据pH≤2.0,判断溶液显酸性,应添H+,根据初步配平的方程式中左边多了4个负电荷,应在左边添加4个H+,再根据元素的质量守恒在左边添加2个H2O分子,从而得到:ClO-2+4I-+4H+=Cl-+2I2+2H2O。
2.电极反应式的书写
书写电极反应式必须首先明确电极反应式是氧化还原反应的离子方程式,而且应该将氧化剂发生的还原反应和还原剂发生的氧化反应分别独立的表示出来。原电池的负极、电解池的阳极发生氧化反应,化合价升高,失电子,它的标准格式为:还原剂–ne-—氧化产物;原电池的正极、电解池的阴极发生还原反应,化合价降低,得电子,其标准格式为:氧化剂+ne-—还原产物。书写的步骤同普通氧化还原反应离子方程式的书写,同样注意电解质的酸碱性环境。
示例:书写以氢氧化钾作电解质溶液的甲烷燃料电池的负极电极反应式。
第一步:确定该反应的还原剂是甲烷,它的燃烧产物一般为CO2,但电解质溶液是氢氧化钾呈碱性,所以氧化产物应为CO32-,负极电极反应式应该表述还原剂失电子。
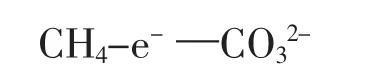
第二步:根据得失电子守恒配平
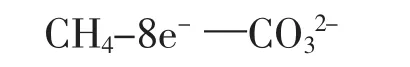
第三步:方程式左边带8个单位的正电荷,右边带2个单位的负电荷;反应溶液为碱性,因此为保证电荷守恒应在左边添加10个单位的OH-,右侧添加H2O。

第四步:根据质量守恒配平

第五步:检查无误后单线改成生成符号
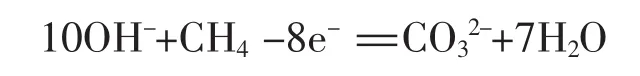
离子反应在江苏历年高考中都有比较重要的地位,是考生必须重视和掌握的基本技能,并且在高考中所占分值逐年增加,我们必须熟悉离子反应相关题型及其解题思路和方法。使学生能够掌握离子反应的本质和该知识点中的疑难题型,从而提高学生的解题能力,锻炼学生的思维。

